Abstract
Introducere
În ultimele decenii, obezitatea a devenit o problemă majoră de sănătate publică în țările dezvoltate și chiar în țările în curs de dezvoltare (Ng și colab., 2014). Mai mult de două treimi din adulții din SUA sunt considerați supraponderali sau obezi (Flegal și colab., 2012). Obezitatea este asociată pozitiv cu o serie de complicații, inclusiv diabetul de tip 2, bolile cardiovasculare, bolile vezicii biliare, osteoartrita și chiar unele tipuri de cancer (Jensen și colab., 2014). Se consideră că dezechilibrul dintre consumul de energie și cheltuieli contribuie la obezitate (Spiegelman și Flier, 2001). Țesutul adipos poate fi clasificat în țesut adipos alb (WAT) și țesut adipos maro (BAT). WAT este locul principal pentru stocarea energiei, iar BAT este locul principal pentru cheltuielile de energie termogenă prin metabolizarea glucozei și a acizilor grași pentru a produce căldură. Din punct de vedere istoric, se credea că BAT există doar la nou-născuții umani. Tehnologiile nou dezvoltate, în special tomografia cu emisie de pozitroni în combinație cu tomografia computerizată, au demonstrat că oamenii adulți au BAT (Cypess și colab., 2009; van Marken Lichtenbelt și colab., 2009; Virtanen și colab., 2009).
În ciuda cercetărilor ample, puține medicamente au fost aprobate pentru tratarea obezității de către Administrația SUA pentru Alimente și Medicamente (Narayanaswami și Dwoskin, 2017). Medicamentele aprobate în prezent vizează aportul de energie fie prin suprimarea poftei de mâncare (fentermină), fie prin interferența cu absorbția nutrienților (orlistat). Cu toate acestea, aceste medicamente au efecte secundare cardiovasculare și/sau psihiatrice severe, iar recesiunea obezității poate apărea la oprirea medicamentelor (Kakkar și Dahiya, 2015). Dovezile emergente privind rolul BAT funcționale în creșterea cheltuielilor de energie la adulții umani deschid o nouă direcție pentru terapia anti-obezitate.
Materiale și metode
Produse chimice și reactivi.
Pentru activitatea de cultură celulară, indometacin, insulină, triiodotironină, rosiglitazonă și dimetilsulfoxid au fost cumpărate de la Sigma (St. Louis, MO). Anticorpul primar pentru UCP1 a fost cumpărat de la Sigma Aldrich și anticorpul primar pentru PGC-1α a fost achiziționat de la Millipore (Temecula, CA). ERK1/2 și anticorpi anti-iepure conjugați cu peroxidază de hrean au fost cumpărați de la Cell Signaling Technology (Danvers, MA). Pentru studiul pe animale, Kolliphor HS15 a fost un cadou de la BASF (Florham Park, NJ), iar indometacinul a fost achiziționat de la Cayman Chemical Company (Ann Arbor, MI).
Cultura și tratamentul celular.
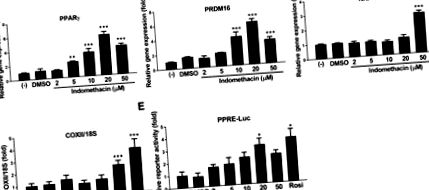
Linia de celule de grăsime maro marină a fost un cadou de la Dr. Johannes Klein (Universitatea din Lubeck, Lubeck, Germania), care a generat linia celulară de la iBAT de șoareci nou-născuți C57BL/6. Preadipocitele brune au fost menținute în mediul Eagle modificat de Dulbecco suplimentat cu 20% ser fetal bovin (Atlanta Biologicals, Flowery Branch, GA) la 37 ° C atmosferă umidificată cu 5% CO2 în aer, până când au ajuns la confluență (desemnată ca ziua 0). Celulele au fost diferențiate prin incubare în mediile de diferențiere care conțin mediul Eagle modificat de Dulbecco, suplimentat cu 20% ser fetal bovin, 1 nM triiodotironină și 20 nM insulină, iar mediul a fost schimbat în fiecare zi până în ziua 5. Pentru a studia efectele indometacinei pe preadipocite maro, s-a adăugat indometacin (2, 5, 10, 20 și 50 μM) sau controlul vehiculului (dimetilsulfoxid) în ziua 0 și înlocuit cu fiecare schimbare a mediului în timpul procesului de diferențiere.
Analiza Western Blot.
Lizatele celulare totale au fost preparate folosind 1X tampon de liză (Cell Signaling Technology), iar concentrațiile de proteine au fost determinate de setul de testare BCA (Thermo Scientific, Waltham, MA). Lizatele celulare totale au fost supuse la 10% SDS-PAGE și transferate la membranele de difluorură de poliviniliden (Bio-Rad, Hercules, CA). Membrana a fost blocată în Tris · HCI 20 mM, NaCl 137 mM și 0,1% Tween 20 (pH 7,4) conținând 5% lapte degresat. Membrana a fost imunoblotată cu anticorpi primari la 4 ° C peste noapte urmată de anticorp secundar conjugat cu peroxidază de hrean timp de 1 oră. Membrana a fost expusă pe film cu raze X după ce a fost dezvoltată de reactivi de detecție Western blot îmbunătățiți (Pierce, Rockford, IL). Semnalul a fost cuantificat prin densitometrie utilizând un sistem de imagistică ChemiDocXRS + cu software ImageLab (Bio-Rad).
Analiza cantitativă în timp real a reacției în lanț a polimerazei (PCR).
ARN-ul total a fost preparat folosind reactivul TRI (Molecular Research Center, Cincinnati, OH) conform instrucțiunilor producătorului. Abundența totală de ARN a fost cuantificată utilizând un spectrofotometru NanoDrop ND-1000 (NanoDrop Technologies, Wilmington, DE). Transcrierea inversă a fost efectuată folosind trusa de transcripție inversă cDNA de mare capacitate (Thermo Scientific, Pittsburgh, PA) conform instrucțiunilor producătorului. Expresia ARNm a genelor țintă și a genei menajere 36B4 a fost măsurată cantitativ folosind PowerUp SYBR Master Mix (Applied Biosystems, Austin, TX). Reacțiile PCR au fost rulate într-un format cu 96 de godeuri folosind un instrument ABI 7300HT. Condițiile ciclului au fost 50 ° C timp de 2 minute și 95 ° C timp de 10 minute, iar apoi 40 de cicluri de 95 ° C timp de 15 secunde și 60 ° C timp de 1 minut. Expresia relativă a genei a fost calculată utilizând metoda 2-Ct, care se normalizează față de 36B4. Toate secvențele de exemplu sunt listate în Tabelul 1 .
TABELUL 1
Exemple de secvențe atât pentru preadipocite de șoareci, cât și pentru șoareci C57BL6
| 36B4 | Înainte: GCGACATACTCAAGCAGGAGCA |
| Revers: AGTGGTAACCGCTCAGGTGTTG | |
| UCP1 | Înainte: GCTTTGCCTCACTCAGGATTGG |
| Revers: CCAATGAACACTGCCACACCTC | |
| PGC-1α | Înainte: GAATCAAGCCACTACAGACACCG |
| Revers: CATCCCTCTTGAGCCTTTCGTG | |
| PPARγ | Înainte: GTACTGTCGGTTTCAGAAGTGCC |
| Revers: ATCTCCGCCAACAGCTTCTCCT | |
| Prdm16 | Înainte: ATCCACAGCACGGTGAAGCCAT |
| Revers: ACATCTGCCCACAGTCCTTGCA | |
| Tfam | Înainte: GAGGCAAAGGATGATTCGGCTC |
| Revers: CGAATCCTATCATCTTTAGCAAGC | |
| Nrf-1 | Înainte: GGCAACAGTAGCCACATTGGCT |
| Revers: GTCTGGATGGTCATTTCACCGC | |
| ATGL | Înainte: TTGTCCTGCCCCACTAAGAG |
| Revers: ACTCAGAGAACCCCGTGAAG | |
| HSL | Înainte: AGACACTTCGCTGTTCCTCA |
| Revers: CTTCAGCCTCTTCCTGGGAA | |
| CPT1 | Înainte: GGACTCCGCTCGCTCATT |
| Revers: GAGATCGATGCCATCAGGGG | |
| Acadm | Înainte: TCAAGATCGCAATGGGTGCT |
| Revers: GCTCCACTAGCAGCTTTCCA | |
| Gaz1 | Înainte: TATGCCCAGAGAGAAGCCTG |
| Revers: AATCTGCCCACGAGAAAGGA | |
| Gaz2 | Înainte: AGCTCCAGACTACATGCCAG |
| Revers: AGCTTTGACCTCAGACTGCT | |
| Cox4b | Înainte: GGGCAGCTCTGGATAGTTCC |
| Revers: TCAACGTAGGGGGTCATCCT | |
| CoxII | Înainte: GCTCTCCCCTCTCTACGCAT |
| Revers: AGCAGTCGTAGTTCACCAGG | |
| 18S | Înainte: GATTCTCCGTTACCCGTCAA |
| Revers: CGTGCTGACGACAGATCACT |
ADN-ul total a fost preparat folosind reactivul TRI (Centrul de cercetare moleculară) conform instrucțiunilor producătorului, iar concentrațiile de ADN au fost cuantificate folosind spectrofotometrul NanoDrop ND-1000 (NanoDrop Technologies). Subunitatea 2 citocrom C oxidază mitocondrială 2 (COXII) și genele de control ale ARNr 18S au fost măsurate cantitativ folosind PowerUp SYBR Master Mix (Applied Biosystems). Reacțiile PCR au fost rulate într-un format cu 96 de godeuri utilizând instrumentul ABI 7300HT (Applied Biosystems, Foster city, CA). Condițiile ciclului au fost 50 ° C timp de 2 minute și 95 ° C timp de 10 minute, iar apoi 40 de cicluri de 95 ° C timp de 15 secunde și 60 ° C timp de 1 minut. Expresia relativă a genei a fost calculată utilizând metoda 2-Ct, care se normalizează împotriva ARNr de 18s.
Reporter Gene Assays.
Preadipocitele brune însămânțate pe plăci cu 48 de godeuri au fost transfectate tranzitoriu cu element de răspuns PPAR (PPRE) -luciferază reporter (Addgene plasmid # 1015) și plasmidă de expresie β-galactozidază cu reactiv de transfecție Lipofectamine 2000 și reactiv Plus (Thermo Fisher Scientific, Carlsbad, CA) . După 24 de ore de transfecție, celulele au fost tratate cu indometacină sau controlul vehiculului timp de 18 ore. Lizatul celular a fost preparat și activitățile reporterului de luciferază și β-galactozidază au fost măsurate folosind un luminometru GloMax (Promega, Madison, WI). Activitățile relative de luciferază au fost normalizate de activitățile β-galactozidazei.
Studiu pe animale.
Profilul lipidic plasmatic.
Concentrațiile plasmatice de trigliceride, colesterol total, colesterol lipoproteic cu densitate mare și colesterol lipoproteic cu densitate foarte scăzută au fost măsurate folosind analizorul de chimie clinică AU400 cu reactivi enzimatici (Beckman Coulter, Inc., Brea, CA), urmând manualul procedural AU400. Concentrațiile de colesterol de lipoproteine cu densitate scăzută au fost calculate utilizând formula Friedewald. Concentrațiile plasmatice ale acizilor grași neesterificați au fost măsurate folosind un kit de cuantificare a acizilor grași neesterificați (ab65341) de la Abcam (Cambridge, MA).
Colorarea H&E.
Țesuturile au fost fixate cu 10% formalină salină tamponată cu fosfat timp de 48 de ore. Colorarea H&E a fost efectuată de Departamentul de patologie de la Texas Tech University Health Sciences Center. Pe scurt, secțiunile de parafină ale țesuturilor adipoase (5 µm) au fost deprajate cu xilen și rehidratate cu alcool. Probele au fost spălate cu apă pentru a îndepărta orice reziduu de reactiv, incubate cu hematoxilină II Gill timp de 4 minute și apoi spălate de mai multe ori cu apă. Probele au fost contracolorate cu eozină timp de 1 minut. Apoi probele au fost deshidratate prin alcool absolut de trei ori. În cele din urmă, probele au fost curățate cu xilen și montate cu mediu de montare pe bază de xilen.
Compozitia corpului.
Compoziția corpului a fost măsurată la săptămânile 0, 2 și 4 folosind un EchoMRI Body Composition Analyzer (EchoMRI LLC, Houston, TX) în conformitate cu instrucțiunile producătorului la instalația pentru animale din Texas Tech University.
Testul de toleranță la insulină.
După șoareci de post timp de 4 ore în săptămâna 4, concentrațiile de glucoză din sânge au fost măsurate prin tăietura cozii folosind glucometrul OneTouch Ultra2 (LifeScan Europe, Zug, Elveția) și benzi de testare a glicemiei. Insulina (0,75 U/kg greutate corporală) a fost administrată șoarecilor prin injecție intraperitoneală, iar concentrațiile de glucoză din sânge au fost măsurate folosind metoda menționată mai sus la 15, 30, 45, 60 și 120 minute după injectare.
Analize statistice.
Efectele metabolice ale administrării locale de indometacin la iBAT la șoarecii obezi.
Indometacinul a albit grăsimea brună și a crescut expresia genelor implicate în activarea grăsimii brune la șoarecii obezi.
Deoarece indometacina a fost livrată direct la iBAT prin mini-pompe osmotice ALZET, am examinat în mod specific efectele indometacinei asupra morfologiei adipocitelor brune și a expresiei genelor marker iBAT. Colorarea H&E a celulelor iBAT la șoarecii martori a avut picături de lipide mărite și depunere de lipide îmbunătățită, dând aspectul de albire a iBAT (Fig. 3A). În schimb, fenotipul de albire nu a fost observat la celulele iBAT la șoarecii tratați cu indometacină. Comparativ cu martorul, indometacina a crescut semnificativ expresia mARN a UCP1, perilipin 1 (Plin1) și perilipin 2 (Plin2) (Fig. 3B). Nu au existat diferențe semnificative la alți markeri maro, inclusiv Prdm16, PGC-1α, PPARγ, factorul de transcripție mitocondrială A (Tfam) și Nrf-1, în genele de oxidare β a acidului gras, inclusiv acil-coenzima A dehidrogenază (Acadm) și citocromul c subunitatea oxidază IV isoforma 2 (Cox4b) și în gene de lipoliză incluzând adipocite triglicerid lipază (ATGL) și lipază hormonal-sensibilă (HSL) între șoarecii tratați cu indometacină și șoarecii de control (Fig. 3B).
- Mirabegron împiedică grăsimea maro, crește metabolismul - RxList
- Hormonul combate grăsimile cu grăsime Orexinul previne obezitatea la șoareci prin activarea grăsimilor brune care ard calorii
- MAI MULT PRO - ACTIVITATEA ESTE NECESARĂ ÎN LUPTA CONTRA OBEZITĂȚII LA BĂRBAȚI - Kirby - 2009 - BJU
- Izolarea Fucoxantinei și a monogalactozildiacilglicerolului foarte nesaturat din Fucusul din alga brună
- Anticorpi IgG cu activitate asemănătoare peroxidazei din serurile șobolanilor Wistar sănătoși - ScienceDirect