medicamente casnice lista a-z efecte secundare centru de droguri sonerie lactată în 5% dextroză (injecție de sonerie lactată și 5% injecție cu dextroză) medicament
Injecție Ringer lactată și 5% injecție cu dextroză, USP
în recipientul din plastic VIAFLEX
DESCRIERE
Injecție lactată Ringer și 5% Dextroză, USP este o soluție sterilă, nepirogenică pentru alimentarea cu lichide și electroliți și furnizarea calorică într-un recipient cu doză unică pentru administrare intravenoasă. Fiecare 100 ml conține 5 g Dextroză Hidrată, USP *; 600 mg clorură de sodiu, USP (NaCI); 310 mg lactat de sodiu (C3H5NaO3); 30 mg clorură de potasiu, USP (KCl); și 20 mg clorură de calciu, USP (CaCl2 · 2H2O). Nu conține agenți antimicrobieni.
PH aproximativ 5,0 (4,0 până la 6,5).
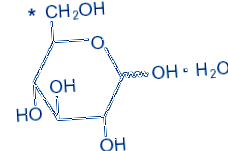 |
D-Glucopiranoză monohidrat
Injecție lactată Ringer și 5% Dextroză, USP administrat intravenos are valoare ca sursă de apă, electroliți și calorii. Un litru are o concentrație ionică de 130 mEq sodiu, 4 mEq potasiu, 2,7 mEq calciu, 109 mEq clorură și 28 mEq lactat. Osmolaritatea este de 525 mOsmol/L (calc). Intervalul fiziologic normal este de aproximativ 280-310 mOsmol/L. Administrarea de soluții substanțial hipertonice poate provoca leziuni ale venelor. Conținutul caloric este de 180 kcal/L.
Recipientul din plastic VIAFLEX este fabricat dintr-o clorură de polivinil special formulată (plastic PL 146). Cantitatea de apă care poate pătrunde din interiorul recipientului în înveliș este insuficientă pentru a afecta în mod semnificativ soluția. Soluțiile care intră în contact cu recipientul din plastic pot elimina anumite componente chimice ale acestuia în cantități foarte mici în perioada de expirare, de exemplu, di-2-etilhexil ftalat (DEHP), până la 5 părți pe milion. Cu toate acestea, siguranța plasticului a fost confirmată în testele pe animale în conformitate cu testele biologice USP pentru recipientele din plastic, precum și prin studii de toxicitate asupra culturilor tisulare.
INDICAȚII
Injecție Ringer lactată și 5% Dextroză, USP este indicată ca sursă de apă, electroliți și calorii sau ca agent alcalinizant.
DOZAJ SI ADMINISTRARE
După cum este îndrumat de un medic. Dozajul depinde de vârsta, greutatea și starea clinică a pacientului, precum și de determinările de laborator.
Produsele medicamentoase parenterale trebuie inspectate vizual pentru a detecta particule sau decolorare înainte de administrare ori de câte ori soluția și recipientul permit acest lucru.
Toate injecțiile din recipientele din plastic VIAFLEX sunt destinate administrării intravenoase folosind echipamente sterile.
După cum sa raportat în literatură, doza și rata de perfuzie constantă a dextrozei intravenoase trebuie selectate cu precauție la pacienții copii și adolescenți, în special la nou-născuți și sugari cu greutate redusă, din cauza riscului crescut de hiperglicemie/hipoglicemie.
Aditivii pot fi incompatibili. Informațiile complete nu sunt disponibile. Acei aditivi cunoscuți ca fiind incompatibili nu ar trebui utilizați. Consultați farmacistul, dacă este disponibil. Dacă, în opinia medicului informat, se consideră recomandabil să se introducă aditivi, utilizați tehnica aseptică. Se amestecă bine când s-au introdus aditivi. Nu depozitați soluții care conțin aditivi.
CUM FURNIZAT
Injecția Ringer lactată și 5% Dextroză injectabilă, USP în recipiente din plastic VIAFLEX sunt disponibile după cum urmează:
| Cod | mărimea | NDC |
| 2B2073 | 500 ml | NDC 0338-0125-03 |
| 2B2074 | 1000 ml | NDC 0338-0125-04 |
Expunerea produselor farmaceutice la căldură ar trebui redusă la minimum. Evitați căldura excesivă. Se recomandă păstrarea produsului la temperatura camerei (25 ° C); expunerea scurtă până la 40 ° C nu afectează negativ produsul.
Instrucțiuni de utilizare a recipientului din plastic VIAFLEX
AVERTIZARE: Nu folosiți recipiente din plastic în conexiuni de serie. O astfel de utilizare ar putea avea ca rezultat embolia aerului datorită extragerii de aer rezidual din recipientul primar înainte de finalizarea administrării fluidului din recipientul secundar.
A deschide
Răsturnați partea superioară a fantei și scoateți recipientul pentru soluție. Se poate observa o anumită opacitate a plasticului datorită absorbției umezelii în timpul procesului de sterilizare. Acest lucru este normal și nu afectează calitatea sau siguranța soluției. Opacitatea se va diminua treptat. Verificați dacă există scurgeri minute strângând ferm punga interioară. Dacă se constată scurgeri, aruncați soluția, deoarece sterilitatea poate fi afectată. Dacă se dorește medicamente suplimentare, urmați instrucțiunile de mai jos.
Pregătirea pentru administrare
- Suspendați recipientul de pe suportul ochiului.
- Îndepărtați protectorul de plastic din orificiul de ieșire din partea de jos a containerului.
- Atașați setul de administrare. Consultați instrucțiunile complete care însoțesc setul.
Pentru a adăuga medicamente
Avertizare: Aditivii pot fi incompatibili.
Pentru a adăuga medicamente înainte de administrarea soluției
- Pregătiți site-ul de medicamente.
- Folosind o seringă cu ac de calibru 19-22, găuriți orificiul pentru medicamente și injectați.
- Se amestecă bine soluția și medicamentul. Pentru medicamente cu densitate mare, cum ar fi clorura de potasiu, strângeți orificiile în timp ce orificiile sunt în poziție verticală și amestecați bine.
Pentru a adăuga medicamente în timpul administrării soluției
- Închideți clema pe set.
- Pregătiți site-ul de medicamente.
- Folosind o seringă cu ac de calibru 19-22, străpungeți orificiul de medicament resigilabil și injectați.
- Scoateți recipientul din stâlpul IV și/sau întoarceți-l în poziție verticală.
- Evacuați ambele orificii strângându-le în timp ce recipientul este în poziție verticală.
- Se amestecă bine soluția și medicamentul.
- Puneți containerul în poziția de utilizare și continuați administrarea.
Baxter Healthcare Corporation, Deerfield, IL 60015, SUA. Rev. Septembrie 2003. Data Rev. FDA: n/a
SLIDESHOW
EFECTE SECUNDARE
Reacții alergice sau simptome anafilactoide, cum ar fi urticarie localizată sau generalizată și prurită; edem periorbital, facial și/sau laringian, tuse, strănut și/sau dificultăți de respirație au fost raportate în timpul administrării Lingerilor Ringer și 5% Dextrose Injection, USP. Frecvența raportării acestor semne și simptome este mai mare la femei în timpul sarcinii.
Reacțiile care pot apărea din cauza soluției sau a tehnicii de administrare includ răspuns febril, infecție la locul injectării, tromboză venoasă sau flebită care se extinde de la locul injectării, extravazare și hipervolemie.
Dacă apare o reacție adversă, întrerupeți perfuzia, evaluați pacientul, instituiți măsuri terapeutice adecvate și salvați restul lichidului pentru examinare, dacă se consideră necesar.
ALTE INTERACȚIUNI
Nu au fost furnizate informații.
AVERTIZĂRI
Injecția lactată Ringer și 5% Dextroză, USP trebuie utilizată cu mare atenție, dacă este cazul, la pacienții cu insuficiență cardiacă congestivă, insuficiență renală severă și în stările clinice în care există edem cu retenție de sodiu.
Injecție lactată Ringer și 5% Dextroză, USP trebuie utilizat cu mare atenție, dacă este cazul, la pacienții cu hiperkaliemie, insuficiență renală severă și în condițiile în care este prezentă retenția de potasiu.
Injecție lactată Ringer și 5% Dextroză, USP trebuie utilizată cu mare atenție la pacienții cu alcaloză metabolică sau respiratorie. Administrarea ionilor de lactat trebuie făcută cu mare atenție în acele condiții în care există un nivel crescut sau o utilizare deficitară a acestor ioni, cum ar fi insuficiența hepatică severă.
Injecție lactată Ringer și 5% Dextroză, USP nu trebuie administrat simultan cu sânge prin același set de administrare din cauza probabilității de coagulare.
Administrarea intravenoasă de Lactated Ringer și 5% injecție cu dextroză, USP poate provoca supraîncărcări de lichide și/sau substanțe dizolvate rezultând diluarea concentrațiilor serice de electroliți, suprahidratare, stări congestionate sau edem pulmonar. Riscul stărilor de diluție este invers proporțional cu concentrațiile de electroliți ale injecției. Riscul supraîncărcării solutului care provoacă stări aglomerate cu edem periferic și pulmonar este direct proporțional cu concentrațiile de electroliți ale injecției.
La pacienții cu funcție renală diminuată, administrarea de Lactated Ringer și 5% injecție cu dextroză, USP poate duce la retenție de sodiu sau potasiu.
Injecție lactată Ringer și 5% Dextroză, USP nu este utilizată în tratamentul acidozei lactice.
PRECAUȚII
Evaluarea clinică și determinările periodice de laborator sunt necesare pentru a monitoriza schimbările în echilibrul fluidelor, concentrațiile de electroliți și echilibrul acid bazic în timpul terapiei parenterale prelungite sau ori de câte ori starea pacientului justifică o astfel de evaluare.
Injecția Ringer lactată și 5% Dextroză, USP trebuie utilizate cu precauție. Administrarea în exces poate duce la alcaloza metabolică.
Trebuie să se acorde prudență în cazul administrării de Ringer lactat și 5% injecție cu dextroză, USP la pacienții cărora li se administrează corticosteroizi sau corticotropină.
Injecție lactată Ringer și 5% Dextroză, USP trebuie utilizată cu precauție la pacienții cu diabet zaharat manifest sau subclinic.
Sarcina: Efecte teratogene
Sarcina Categoria C. Nu s-au efectuat studii de reproducere pe animale cu Lactated Ringer's și 5% Dextrose Injection, USP. De asemenea, nu se știe dacă Lactated Ringer's și 5% Dextrose Injection, USP pot provoca leziuni fetale atunci când sunt administrate unei femei gravide sau pot afecta capacitatea de reproducere. Injecție lactată Ringer și 5% Dextroză, USP trebuie administrată unei femei însărcinate numai dacă este clar necesar.
Utilizare pediatrică
Siguranța și eficacitatea injecției Lactated Ringer și 5% Dextroză, pacienții USPin pediatric nu au fost stabilite prin studii adecvate și bine controlate; Avertismentele, precauțiile și reacțiile adverse identificate în copia etichetei trebuie respectate la populația pediatrică.
La sugarii cu greutate foarte mică la naștere, administrarea excesivă sau rapidă a injecției cu dextroză poate duce la creșterea osmolalității serice și a unei posibile hemoragii.
Carcinogeneză, mutageneză, afectarea fertilității
Nu s-au efectuat studii cu Ringer lactat și 5% injecție cu dextroză, SUA pentru a evalua potențialul cancerigen, potențialul mutagen sau efectele asupra fertilității.
Mamele care alăptează
Nu se știe dacă acest medicament este excretat în laptele uman. Deoarece multe medicamente sunt excretate în laptele matern, ar trebui să se acorde precauție atunci când se administrează Linger Linger și 5% Dextrose Injection, USPis unei mame care alăptează.
Utilizare geriatrică
Studiile clinice efectuate cu Ringer lactat și 5% injecție cu dextroză, USP nu au inclus un număr suficient de subiecți cu vârsta peste 65 de ani pentru a determina dacă au răspuns diferit față de subiecții mai tineri. Alte experiențe clinice raportate nu au identificat diferențe în răspunsurile dintre pacienții vârstnici și cei mai tineri. În general, selecția dozei pentru un pacient în vârstă trebuie să fie precaută, de obicei începând de la capătul scăzut al intervalului de dozare, reflectând frecvența mai mare a scăderii funcției hepatice, renale sau cardiace și a bolii concomitente sau a tratamentului medicamentos.
A nu se administra decât dacă soluția este limpede și sigiliul este intact.
- Injecție Ringer lactată, SUA Ringer s lactată și injecție cu 5% Dextroză, USP
- Ce beneficii pentru sănătate, utilizări, efecte secundare, dozare și interacțiuni
- Utilizări de mană, efecte secundare, interacțiuni, dozare și avertisment
- Beneficii, utilizări, efecte secundare, dozare și interacțiuni asupra sănătății marshmallow
- Utilizări Khat, efecte secundare, interacțiuni, dozare și avertisment
