Date asociate
rezumat
În ultimii ani s-a înregistrat o schimbare în utilizarea Drosophila, de la studii de creștere și dezvoltare către caracterizarea genetică a metabolismului glucidic, sterol și lipidic. Această cercetare, revizuită mai jos, stabilește o nouă bază pentru utilizarea acestui sistem simplu de model genetic pentru a defini mecanismele de reglementare de bază care stau la baza homeostaziei metabolice și deține promisiunea de a oferi noi informații despre cauzele și tratamentele tulburărilor umane critice, cum ar fi diabetul și obezitatea.
Drosophila ca sistem pentru studiile metabolismului
Ușurința relativă de a crește un număr mare de larve de Drosophila sau de adulți depășește dezavantajul dimensiunilor lor mici, permițând cercetătorilor să folosească multe dintre aceleași teste de bază pentru a înregistra funcția metabolică. Acestea includ măsurători ale activității mitocondriale, teste ATP, profilare metabolică a lipidelor, teste de toleranță la insulină, teste pentru forma principală stocată a lipidelor, triacilglicerol (TAG), precum și nivelurile de zahăr atât la animale întregi, cât și la nivel circulant. Testele elegante pentru răspunsuri metabolice specifice sunt, de asemenea, posibile în Drosophila, care nu poate fi efectuată în sisteme vertebrate mai complexe, cum ar fi o analiză GFP pentru PIP3 asociat membranelor în țesuturile intacte, un semn distinctiv al semnalizării activate a fosfoinozidei-3-kinazei (PI3K) (Britton și colab., 2002), sau un reporter GFP care poate fi utilizat în studii pe animale întregi pentru a urmări modelele temporale și spațiale ale activării SREBP (Kunte și colab., 2006).
În această revizuire, analizăm răspunsurile metabolice majore care sunt conservate între muște și oameni, subliniind modul în care studiile din Drosophila au oferit noi informații despre modul în care aceste căi sunt reglementate. Pentru a restricționa studiul nostru, ne concentrăm pe lucrări care utilizează teste directe ale funcției metabolice pentru a caracteriza fenotipurile mutante și excludem lucrările care acoperă reglarea creșterii prin semnalizarea insulinei sau studii genetice ale îmbătrânirii, ambele fiind revizuite în altă parte (de exemplu, Edgar, 2006; Helfand și Rogina, 2003; Partridge and Gems, 2002). Imaginea care reiese din lucrările descrise mai jos este zorii unei noi ere în biologia Drosophila - în care acest sistem genetic simplu este din ce în ce mai exploatat pentru a defini căile centrale care controlează metabolismul și fiziologia, cu implicații pentru îmbunătățirea înțelegerii noastre asupra modului în care este homeostazia. menținută în toate organismele superioare și cauzele tulburărilor metabolice la om.
Drosophila ca nou model genetic pentru diabet
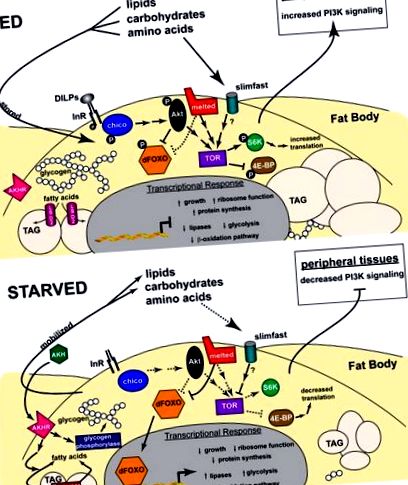
Căile de insulină/IGF conservate joacă un rol central în creștere și metabolism în organismele superioare. La mamifere, IGF reglează în primul rând creșterea, în timp ce insulina funcționează în principal în homeostazia glucozei. Aceste două activități sunt unificate în zbor într-o singură cale insulină/IGF. Șapte peptide asemănătoare insulinei (DILP1-7), ale căror funcții nu au fost complet elucidate (Brogiolo și colab., 2001; Ikeya și colab., 2002), acționează prin receptorul Drosophila insulin-like (InR) pentru a iniția un cascadă de evenimente intracelulare mediate de componentele conservate ale căii insulină/IGF. Acestea includ substratul receptorului de insulină (IRS) Chico, antagonistul de semnalizare a insulinei PTEN, PI3K, PKB/Akt kinaza și ortologul FOXO unic dFOXO (revizuit de Oldham și Hafen, 2003) (Figura 1).
Reprezentarea schematică a căilor de semnalizare care reglează metabolismul Drosophila. Interacțiunile funcționale descrise în text sunt descrise pentru o celulă grasă din corp, atât în condiții de hrănire, cât și în condiții de foame. Liniile solide și săgețile reprezintă interacțiuni de semnalizare, în timp ce liniile punctate și săgețile reprezintă efecte de reglare care apar în absența căii de semnalizare. În starea hrănită (de sus), DILP-urile și substanțele nutritive semnalizează prin insulină și, respectiv, căile TOR, rezultând retenția FOXO în citoplasmă și creșterea translației, determinând creșterea. Zaharurile și acizii grași sunt depozitați ca glicogen și TAG, în timp ce căile metabolice producătoare de energie sunt reglate în jos. La animalele înfometate (de jos), semnalizarea insulinei și TOR este atenuată, dirijând translocația nucleară FOXO și reducând sinteza proteinelor, restricționând creșterea. Glicogenul și TAG sunt mobilizate de AKH și lipaze precum Brummer, în timp ce căile metabolice producătoare de energie sunt reglate în sus. Consultați textul pentru mai multe detalii.
Studii pionierate din câteva laboratoare au oferit noi perspective interesante despre modul în care DILP reglează metabolismul glucidic în Drosophila. În condiții normale de hrănire, trei gene dilp (dilp2,3,5) sunt exprimate în grupuri mici de celule neurosecretorii mediane din creier (Brogiolo și colab., 2001; Broughton și colab., 2005; Ikeya și colab., 2002). Expresia dilp3 și dilp5 este redusă la aceste celule producătoare de insulină (IPC) ca răspuns la niveluri mai scăzute de carbohidrați din dietă, dar nu la foame de aminoacizi, indicând faptul că nivelurile de dilp pot răspunde la indicii nutriționali specifici, la fel ca insulina la om (Colombani și colab.)., 2003; Ikeya și colab., 2002). Mai mult, ablația IPC are ca rezultat fenotipuri diabetice, animalele prezentând o creștere semnificativă a glucozei și trehalozei circulante (o dizaharidă care este zahărul primar din sânge la insecte), precum și o creștere moderată a lipidelor stocate (Broughton și colab., 2005; Rulifson și colab., 2002). IPC-urile par să funcționeze ca celulele β pancreatice prin faptul că intră în contact direct cu inima și astfel ar putea elibera DILP-uri în sistemul circulator pentru a menține nivelurile adecvate de zaharuri circulante, deși reglarea secreției DILP de către IPC rămâne necunoscută (Rulifson și colab., 2002 ).
Funcțiile metabolice ale semnalizării TOR
Deși se știe că nivelurile de aminoacizi modulează activitatea TOR, mecanismele care stau la baza acestui răspuns rămân slab înțelese. Caracterizarea genetică a transportorului de aminoacizi Slimfast a furnizat câteva indicii inițiale în această cale, indicând faptul că funcționează ca un senzor de nutrienți în corpul larvelor de grăsime, controlând un răspuns sistemic care leagă nivelurile de aminoacizi cu creșterea organismului (Colombani și colab., 2003 ). Observația conform căreia inactivarea specifică a corpului adipos fie a slimfast, fie a dTOR duce la fenotipuri similare susține propunerea că Slimfast poate semnaliza prin dTOR în corpul gras pentru a regla global creșterea și metabolismul ca răspuns la nivelurile de aminoacizi. Această cale a senzorului de aminoacizi din corpul adipos poate anula semnalizarea insulinei în țesuturile periferice prin inhibarea activității PI3K, aparent prin unul sau mai mulți factori neidentificați care emană din corpul adipos (Figura 1).
Un ecran genetic pentru regulatorii de creștere din Drosophila a dezvăluit un nou membru al căii de semnalizare TOR, topit (Teleman și colab., 2005b). Această genă codifică o proteină cu un domeniu de omologie a pleckstrinei (PH) care este esențială pentru funcția sa. Topit poate lega TSC1 și recruta complexul TSC1/2 la membranele celulare, sugerând că poate acționa în amonte de TOR. mutanții topiți au lipide reduse, dar nu prezintă defecte aparente în nivelurile de zahăr circulante. Deși mecanismele rămân neclare, Topit poate ajuta la facilitarea fosforilării dFOXO și TSC2 de către Akt ca răspuns la aportul de insulină. În concordanță cu propunerea conform căreia Melted limitează răspunsul dFOXO, ținta dFOXO 4E-BP este puternic reglată în sus la mutanții topiți înfometați, iar nivelurile reduse de dFOXO pot suprima defectele metabolice lipidice ale mutanților topiți. Identificarea omologilor topiți la C. elegans, șoareci și oameni stabilește scena pentru studii ulterioare pentru a înțelege rolul său în semnalizarea TOR și FOXO, precum și în metabolismul lipidelor.
Bazat în mare parte pe studii efectuate pe celule cultivate, s-a considerat că 4E-BP mediază efectele de creștere ale TOR prin inhibarea directă a sintezei proteinelor (Hay și Sonenberg, 2004; Oldham și Hafen, 2003). Cu toate acestea, studiile genetice recente ale Drosophila au provocat acest model. Studiile privind pierderea funcției și câștigul funcției au demonstrat că 4E-BP nu are niciun efect asupra creșterii (Teleman și colab., 2005a). Mai degrabă, muștele mutante 4E-BP sunt sensibile la foamete și prezintă o scădere semnificativă a lipidelor stocate la foamete prelungită. În schimb, animalele care exprimă o formă activă constitutiv de 4E-BP prezintă niveluri totale de lipide. Acest rol pentru 4E-BP este în concordanță cu defectele metabolice lipidice observate la șoarecii mutanți 4E-BP (Tsukiyama-Kohara și colab., 2001). În plus, mutanții Drosophila Lk6 prezintă niveluri crescute de lipide, în concordanță cu rolul Lk6 în opunerea efectului inhibitor al 4E-BP (Reiling și colab., 2005). Aceste studii confirmă importanța critică a studiilor genetice la animale pentru a testa modele derivate din celule cultivate și oferă o bază pentru caracterizarea mecanismelor prin care semnalizarea FOXO și TOR reglează homeostazia.
Reglarea metabolismului de către SREBP și microARN
Studiile genetice ale unui mutant dSREBP au oferit informații despre rolurile sale la animal (Kunte și colab., 2006). dSREBP nule mutanți mor ca larve secundare subdimensionate și prezintă niveluri reduse de acizi grași, deși proporțiile relative ale acizilor grași cu lanț lung lung rămân neschimbate. În concordanță cu acest fenotip, autorii au găsit o expresie redusă a trei gene de sinteză a acizilor grași la mutanții dSREBP și adăugarea lipidelor de soia sau a acizilor grași cu lanț lung specific în mediul de creștere a fost suficientă pentru salvarea letalității. Autorii au proiectat un sistem de raportare dSREBP-GFP pentru a monitoriza tiparele spațiale și temporale ale activității transcripționale dSREBP la animal, arătând că este activ în mod normal în corpul gras, în intestinul mediu și în enocitele larvelor de hrănire. Important, această activitate poate fi suprimată prin adăugarea excesului de lipide în dietă, demonstrând că reporterul este supus unui control normal al feedback-ului. Va fi interesant să examinăm alți parametri metabolici în mutanții dSREBP, cum ar fi nivelurile de glucoză și lipide, precum și să identificăm ținte transcripționale directe care oferă un cadru mecanicist mai bun pentru înțelegerea rolurilor sale în fiziologia lipidelor.
Noi perspective asupra reglării lipolizei
Corpul de grăsime larvară servește ca sursă dinamică pentru menținerea homeostaziei energetice și ca rezervor necesar pentru lipidele stocate în timpul perioadei prelungite de nealimentare în timpul metamorfozei. În consecință, masa lipidică a corpului adipos crește la ~ 15% din greutatea totală a animalului în a treia etapă, de la ~ 6% ca o nouă etapă nou eclozionată, majoritatea putând fi atribuită TAG (Church and Robertson, 1966a; Church și Robertson, 1966b). Corpul de grăsime larvară la adulții nou-născuți este înlocuit în primele câteva zile de celulele adipoase adulte, adulții menținând ~ 6,5% din greutatea corporală ca lipide, similar cu cel observat în prima etapă (Aguila și colab., 2007; Rizki, 1978; Teague și colab., 1986). Această schimbare a încărcăturii lipidice este indicativă a schimbării funcției corpului adipos, de la dirijarea creșterii organismului și a depozitării TAG în timpul etapelor larvelor la menținerea homeostaziei energetice la vârsta adultă (Colombani și colab., 2003; Rizki, 1978). În concordanță cu aceasta, corpul adipos al adulților este supus unei supraîncărcări lipidice induse de dietă, spre deosebire de corpul de grăsime larvară, o observație care stabilește mușca adultă ca context ideal pentru studiile funcționale ale obezității induse de dietă, un factor de risc critic pentru bolile umane (Bross și colab., 2005; Sanchez-Blanco și colab., 2006).
Un exemplu în acest sens este mutantul adipos 60 natural, care prezintă niveluri crescute de lipide totale în condiții normale de hrănire la vârsta adultă, fără efecte în stadii anterioare, împreună cu rezistență semnificativă la înfometare (Hader și colab., 2003; Teague și colab. al., 1986). Gena adipoasă codifică o proteină cu repetări WD40, care este exprimată pe scară largă în toate etapele de dezvoltare și care poate scădea TAG atunci când este supraexprimată în corpul de grăsime larvară (Hader și colab., 2003). Acest studiu a remarcat, de asemenea, că ortologii adiposului sunt codificați atât de genomul șoarecelui, cât și de cel uman, și a speculat că rolul său în metabolismul lipidic poate fi conservat prin evoluție. Foarte important, această predicție a fost confirmată recent de Suh și colab. (2007), care au arătat că șoarecii cu o copie mutantă a adiposului sunt obezi și rezistenți la insulină, în timp ce supraexprimarea adipoză transgenică a grăsimilor are ca rezultat șoarecii slabi și sensibili la insulină. Studiile biochimice și de cultură celulară indică faptul că proteinele adipoase pot lega histone și HDAC3 și pot funcționa ca parte a unui complex corepresor transcripțional. Luate împreună, aceste studii demonstrează funcția predictivă puternică a geneticii Drosophila, în cazul în care genele descoperite în zbor dezvăluie noi niveluri de control metabolic care sunt conservate prin evoluție la șoareci și oameni.
Luate împreună, aceste studii genetice de pionierat asupra metabolismului lipidic Drosophila dezvăluie conservarea evoluției funcției perilipinei și ATGL, precum și mecanismele distincte prin care Brummer și AKHR controlează mobilizarea lipidelor în Drosophila. Numărul relativ mare de lipaze putative codificate de genomul muștei (Supliment. Tabelul 1), reglarea multor dintre aceste gene prin înfometare (Grönke și colab., 2005; Zinke și colab., 2002) și compoziția proteomică similară a picături de lipide cu muște și mamifere (Cermelli și colab., 2006), stabilesc paralele între muște și fiziologia lipidelor umane și indică faptul că studiile viitoare în Drosophila vor oferi noi perspective asupra modului în care este menținută homeostazia lipidică.
Defectele de absorbție și trafic ale sterolilor în patologia Niemann-Pick de tip C.
În afară de rolul său esențial în membranele celulare, colesterolul acționează ca un precursor al hormonilor steroizi, cum ar fi ecdisonul insectelor steroizi, care declanșează tranzițiile majore de dezvoltare în ciclul de viață (Thummel, 2001). Deși studii recente au definit multe dintre etapele biochimice prin care colesterolul este convertit în ecsonă (Rewitz și colab., 2006), mecanismele care controlează detectarea colesterolului, absorbția, traficul intracelular și homeostazia, au rămas neclare. Lucrările recente asupra proteinelor Niemann-Pick tip C (NPC) au oferit informații despre aceste procese în zbor, cu implicații pentru înțelegerea homeostaziei sterolului la oameni.
De ce să studiați metabolismul în Drosophila?
Abilitatea de a manipula genomul mustei în orice mod dorit, combinată cu o gamă de resurse genomice nou disponibile, permit cercetătorului să definească mecanismele moleculare ale funcției genice la un nivel de rezoluție care nu este posibil în organismele mai complexe. În plus, niciun studiu până în prezent nu a exploatat unul dintre punctele forte ale Drosophila - capacitatea de a efectua ecrane genetice deschise pe scară largă - o abordare care deține promisiunea extinderii înțelegerii noastre asupra reglării metabolice în direcții noi și neașteptate. Este probabil că avem multe de așteptat cu nerăbdare în următorii câțiva ani, deoarece studiile ulterioare exploatează umila muște a fructelor pentru a dezvălui noi perspective asupra reglementării metabolismului și homeostaziei.
- Efectele glicogenului sintetizat enzimatic asupra metabolizării lipidelor la șoarecii obezi induși în dietă
- Reglarea metabolismului glucozei la pacienții cu obezitate morbidă și la pacienții după biliopancreatic
- Hrănirea șoarecilor diabetici obezi cu o dietă cu genisteină induce schimbări termogene și metabolice - Rockwood -
- Metabolismul acizilor grași, sistemul nervos central și hrănirea - Ronnett - 2006 - Obezitate - Wiley
- Frontiere Microparticule derivate din trombocite de la indivizi obezi Caracterizarea numărului, mărimii,