Shahraam Kamalpour
o Louisiana State University Dermatology, New Orleans, Louisiana;
Keith Leblanc, Jr.
o Louisiana State University Dermatology, New Orleans, Louisiana;
b Centrul de chirurgie a pielii, Metairie și Mandeville, Louisiana
Abstract
LIPOSUCȚIA TUMESCENTĂ A FOST dezvoltată de dermatologul Jeffrey Klein în 1987 și de atunci a devenit standardul de aur printre tehnicile de îndepărtare a țesutului adipos subcutanat.1 Au fost dezvoltate de atunci numeroase alternative neinvazive și lipolitice la liposucție, inclusiv radiofrecvența, ultrasunetele focalizate de înaltă intensitate (HIFU), criolipoliză și ultrasunete netermice.1,2
Printre cele mai noi modalități pentru tratamentul depozitelor de grăsime subcutanată nedorite se numără adipoliza prin injecție, care utilizează produse care conțin ingredientul activ deoxicolat de sodiu (SDC). Această tehnică a stârnit interes datorită perioadelor de nefuncționare limitate și ușurinței injecției subcutanate și conferă capacitatea de a viza buzunare mici de țesut adipos care nu pot fi tratate cu alte modalități.
Practica mezoterapiei, inventată de medicul francez Michel Pistor în anii 1950, se referă la injecția subcutanată de substanțe menite să îmbunătățească aspectul țesuturilor adipoase.3 Maggiori a fost primul care a descris utilizarea preparatelor de mezoterapie care conțin fosfatidilcolină (PC) dizolvate în SDC .4 La scurt timp după aceea, numeroase studii pilot au raportat reducerea țesuturilor adipoase cu aceste injecții.
Cel mai cunoscut dintre acești agenți timpurii a fost Lipostabil Endovena® (Aventis Pharma, Germania), un agent intravenos pentru tratamentul hiperlipidemiei, a embolilor de grăsime, a angiopatiei diabetice, a aterosclerozei și a altor anomalii ale lipidelor intravasculare. a raportat efecte pozitive ale acestui agent IV asupra profilelor lipidice sistemice, determinând studiul ca agent mezoterapeutic.10,11
În ciuda utilizării rampante în Brazilia, cu mii de pacienți care solicitau injecții pentru celulită, rulouri de spate și hernie de tampon de grăsime a pleoapei inferioare, Lipostabil a fost interzis în decembrie 2002 pentru utilizare cosmetică de ANVISA, echivalentul brazilian al FDA, deoarece nu au existat studii clinice susținând eficacitatea sau siguranța medicamentului.12,13 Agenția de reglementare a medicamentelor și produselor medicale din Regatul Unit și FDA au emis ulterior avertismente puternice împotriva utilizării lor.
Cercetări suplimentare au elucidat SDC ca ingredient activ în aceste soluții mezoterapeutice, culminând cu aprobarea de către FDA a ATX-101, comercializată ca Kybella® (Kythera Biopharmaceuticals, filială a Allergan, Westlake Village, California). Acest preparat de deoxicolat de sodiu 10 mg/ml a fost aprobat pentru îmbunătățirea estetică a „convexității moderate până la severe sau a plenitudinii asociate cu grăsimea submentală la adulți” și este primul medicament pentru adipoliză injectabilă aprobat de FDA.14
MECANISMUL DE ACȚIUNE ȘI HISTOLOGIE
Efectele injecției subcutanate a soluțiilor care conțin PC și SDC au fost inițial dezbătute și s-a propus ca acestea să inducă o defalcare a trigliceridelor stocate în adipocite și lipase intracelulare activate. Această teorie, bazată pe efectul PC asupra nivelurilor sistemice de trigliceride și capacitatea sa de a emulsia grăsimile pentru transport, a condus la ipoteza că PC-ul a fost ingredientul activ.10,12,15
Cercetările ulterioare efectuate de Rotunda și colab în 2004 au arătat că SDC este probabil ingredientul activ, acționând ca detergent biologic și perturbând viabilitatea celulară. Experimentele de laborator au evidențiat o liză celulară dependentă de doză în celulele cultivate expuse la SDC.4,5,7,16,17
Cercetătorii au propus ca SDC să acționeze ca un detergent, rezultând în compromiterea stratului fosfolipidic al celulei și ducând la liza celulară. Solubilizarea bistratelor fosfolipidice în micele mixte de către detergenți a fost descrisă pentru prima dată de Lichtenberg în 1983. 18 Detergenții ionici, cum ar fi SDC, perturbă integritatea membranelor prin introducerea grupărilor lor hidroxil polare în nucleul hidrofob al bistratului. În cele din urmă, are loc solubilizarea proteinelor asociate membranei, iar membrana celulară se prăbușește în micele mixte de fosfolipide și molecule de detergent.19
Experimentele care utilizează cultura celulară, testele metabolice și evaluarea histologică au verificat independent această ipoteză, testând compuși SDC izolați, care au fost capabili să inducă liza celulară și necroza rezultată, în diferite tipuri de țesuturi. 3,7,16 Majoritatea celulelor au fost distruse în 15 minute de incubație cu soluții in vitro (Tabelul 1) .7
tabelul 1.
Timp necesar pentru a induce moartea celulară observabilă> 90%, confirmată de colorarea portocalie acridină la populațiile celulare expuse la compuși care conțin fosfatidilcolină dizolvată în deoxicolat de sodiu7
| 90 de secunde | Preadipocite |
| Șase minute | Celule musculare netede vasculare, miotuburi scheletice, celule epiteliale renale |
| 15 minute | Adipocite imature |
Aceste experimente au arătat, de asemenea, că adipocitele mature au fost mai rezistente la liza celulară indusă de detergenți decât alte tipuri de celule in vitro, ridicând întrebarea cât de sigure ar fi acești agenți, în cazul în care injecția are loc accidental în afara unui compartiment pentru grăsimi. datorită afinității SDC pentru albumină, concentrația scăzută de albumină și alte proteine din jurul țesuturilor adipoase ar putea explica susceptibilitatea lor relativă la acești compuși (Tabelul 2). Cozile de șoareci injectate cu SDC au dezvăluit aproape o completare a straturilor musculare, a dermei și a epidermei la examinarea histologică, în ciuda necrozei și fibrozei remarcabile a țesutului adipos subcutanat.20
masa 2.
Concentrația SDC necesară pentru inducerea lizei adipocitelor cultivate in vitro
| Nici unul | 0,045% |
| 0,7% | 0,075% |
| 1,3% | 0,100% |
Creșterea concentrațiilor de albumină a crescut LD50 observat într-o manieră dependentă de doză.20
Testarea soluțiilor izolate de PC a fost inițial considerată imposibilă, deoarece este insolubilă în soluție apoasă. Cu toate acestea, în 2009, Duncan și colab17 au folosit ulei mineral inert ca solvent, arătând că PC-ul singur a fost incapabil să provoace liza celulară observată cu soluțiile totale PC/SDC.
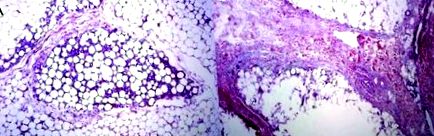
figura 1. (A) Paniculita indusă prin injectarea mixtă de soluție SDC/PC cu 3 săptămâni înainte; tipar lobular distribuit uniform de fibroză; (B) Adipoză injectată cu deoxicolat 4,2% la 4 săptămâni după injecția SDC, prezentând o paniculită fibroasă septală pronunțată. Figura adaptată din Duncan D, Rubin JP, Golitz L și colab. Rafinarea tehnicii în lipoliza injectabilă pe baza studiilor științifice și a evaluării clinice.
Figura 2. Derma suprapusă adipos tratată cu soluție mixtă PC/SDC. Pachetele de colagen nu sunt afectate. (B) Dermă adiacentă tratată numai cu SDC, omogenizare și scleroză a colagenului. Figura adaptată din Duncan D, Rubin JP, Golitz L și colab. Rafinarea tehnicii în lipoliza injectabilă pe baza studiilor științifice și a evaluării clinice.
Studiile radiomarcate au arătat că SDC injectat pătrunde în circulația GI în câteva zile de la injectare, fiind supus unei eliminări fecale similar cu acizii biliari endogeni. Unii teoretizează că PC poate ajuta la emulsificarea resturilor formate după adipoliză, ajutând la drenajul limfatic. Această teorie rămâne netestată, iar studiile radiomarcate care evaluează soarta acestor resturi celulare bogate în lipide pot ajuta la delimitarea în continuare a efectelor țesutului post-injecție și a diferențelor suplimentare cu soluțiile care conțin amestecul ambelor ingrediente.8,17,20
STUDII CLINICE
Multe studii privind soluțiile de mezoterapie care conțin PC/SDC au utilizat formulări compuse similare cu Lipostabil și nu au fost aprobate de FDA. Au fost încercate diferite locuri de injectare în aceste studii pilot, incluzând hernia tamponului de grăsime a capacului inferior, injecția cu volum mare de „celulită” în regiunea gluteotrocanterică, „rulouri din spate” și lipomii.9,17,21-24
ATX-101 a arătat rezultate promițătoare în primele studii clinice aprobate de FDA pentru o soluție bazată pe SDC. Rezultatele unui studiu multicentric pe 363 de pacienți care și-au exprimat nemulțumirea față de zona lor submentală au fost raportate în 2014. Pacienții au fost randomizați pentru a primi fie medicament, fie placebo pentru 1 până la 4 ședințe de tratament.
Din 241 de pacienți din grupul de medicamente, 19 au întrerupt tratamentul devreme din cauza efectelor adverse. Unul dintre cei 122 de pacienți din brațul de control a întrerupt tratamentul. O îmbunătățire semnificativă a fost raportată de 59,2% dintre pacienții din grupul cu doză mai mică, 65,3% din grupul cu doză mai mare și 23% din pacienții din grupul cu doză mai mică.
Studiul REFINE-1, publicat în ianuarie 2016, este cel mai mare studiu realizat până în prezent, cu 506 de subiecți în total. În plus față de scorurile vizuale, acest studiu a utilizat evaluarea prin rezonanță magnetică (RMN) a tamponului preplatistic de grăsime la 224 de pacienți. Autorii au stabilit că 46,3 la sută dintre participanți au demonstrat răspuns radiografic în grupul de tratament, comparativ cu 5,3 la sută din grupul placebo.
EVENIMENTE ADVERSE
Studiile de fază 1 cu ATX-101 nu au evidențiat niciun efect asupra profilelor lipidice sistemice, CRP sau IL-6.27 În studiile de fază 3, 90,8% din grupul de tratament cu doze mici și 95% din grupul de tratament cu doze mari au raportat efecte adverse, ca comparativ cu 50,8% din pacienții cu placebo. Cele mai frecvent raportate reacții adverse au fost de așteptat și au inclus dureri tranzitorii la locul injectării, umflături, vânătăi, indurație și amorțeală. Durata mediană a durerii a fost de o zi, în timp ce umflarea a durat 9-10 zile, iar amorțeala și indurația au rămas timp de 17 până la 25 de zile.25 Studiul REFINE-1 a raportat rezultate similare, dar a adăugat în continuare două evenimente adverse suplimentare, pretins de autorezolvare. Pareza nervului mandibular marginal a fost observată la 4,3% dintre pacienți, cu o durată mediană de 31 de zile, iar disfagia a fost observată la 1,6% dintre participanți, cu o durată mediană de patru zile. În general, sa observat că severitatea efectelor adverse scade la fiecare sesiune de injecție ulterioară.
Rapoartele despre compușii mixți care conțin PC/SDC enumeră evenimentele adverse, inclusiv durerea și edemul care durează 48 de ore și formarea hematomului timp de până la 10 zile. Un mic procent de pacienți au raportat greață, amețeli sau amețeli tranzitorii post-injecție. și altul după ce un pacient a avut un contact post-injecție al coapselor interioare în timpul mersului.
Două rapoarte de urticarie după injectarea unei soluții de PC și SDC au fost observate la pacienții cu alergie nedezvăluită la soia.28 Un alt raport a remarcat pierderea localizată a pielii peste coapsa posterioară după injectare de către un asistent medical inițiat inițiator, instruit numai prin instruire orală. Acest pacient a raportat liposucție agresivă anterioară în zona de tratament, iar zona de ulcerație a fost tratată cu oxigen hiperbar, rezolvându-se cu o neregularitate superficială minimă30.
Tehnica injectării pare a fi importantă în ceea ce privește evenimentele adverse; mici alicote de 0,2 ml sau mai puțin dau cele mai bune rezultate, iar injectoarele trebuie să mențină adâncimea adecvată a acului (aproximativ 9-11 mm pe majoritatea locurilor și aproximativ 6 mm în gât) .30,31 Compresia externă este contraindicată. Împreună cu edemul post-injecție, compresia poate provoca compromiterea aportului local de sânge și poate duce la necroză a dermei și epidermei deasupra.
În comparație cu studiile cu soluții mixte PC/SDC versus SDC singur, profilurile de efecte secundare sunt comparabile. Concentrațiile SDC trebuie crescute atunci când sunt administrate concomitent cu PC, deoarece cei doi compuși formează micele în soluție, scăzând porțiunea liberă de detergent.9,32 Un studiu realizat de Rotunda și colab, publicat în 2009,32 nu a arătat nicio diferență în incidența efectelor secundare sau eficacitatea tratamentului atunci când se compară soluțiile mixte PC/SDC cu SDC singur. Cu toate acestea, un studiu precedent, publicat de Salti et al9 în 2008, a constatat că pacienții tindeau să aibă o severitate mai mare a efectelor adverse și o rezoluție mai lentă cu soluții de SDC pur.9,32
În 2013, Park și colab. 33 au raportat efecte nedorite după injectarea unui compus similar cu Lipostabil endovena. Lipobean® (Ami Pharm Inc., Coreea), o soluție mixtă de PC și SDC, a fost utilizată la o femeie tânără care dorea reducerea grăsimii în abdomen. Pacientul a avut un nodul periumbilical persistent la șase luni după tratament, în ciuda a trei runde de triamcinolonă intralesională. Acest nodul a fost îndepărtat prin biopsie excizională și evaluat histologic. Țesutul adipos a fost înlocuit de fibroză cu infiltrare inflamatorie marcată și formare de microabces în derm. Paniculita septală și lobulară a fost observată cu septuri fibroase groase, necroză grasă și formarea microcistului.33 Se presupune că formarea de granulom pe termen lung și indurația persistentă sunt mai susceptibile să apară atunci când sunt utilizate doze mai mari de 0,2 ml și când concentrațiile de SDC sunt prea mari .34
Un raport de caz unic din Germania în 2011 a raportat disfuncție hepatică indusă de medicamente și nefrită tubulointerstițială, care necesită hemodializă temporară după utilizarea subcutanată a Lipostabil. Pacientul și-a revenit fără invaliditate pe termen lung.35
INDICAȚII
Până în prezent, singura indicație aprobată de FDA a injecției subcutanate SDC este convexitatea moderată până la severă sau plenitudinea asociată cu grăsimea submentală.14 Studiile clinice înregistrate aprobate de FDA au evaluat, de asemenea, siguranța și eficacitatea ATX-101 în tratamentul lipomelor., dar nu s-a acordat nicio indicație. Sunt necesare studii suplimentare pentru a determina dacă soluțiile PC/SDC pot fi utilizate și pentru tratarea excesului de grăsime în alte zone ale corpului.
CONCLUZIE
Injecțiile cu soluții care conțin PC și SDC au fost utilizate pe scară largă în America de Sud și pot reprezenta o alternativă viabilă pentru tratamentul micilor buzunare de țesut adipos care nu sunt supuse altor modalități de tratament. ATX-101 este prima soluție de SDC aprobată de FDA pentru injecție subcutanată, dar există și un potențial gol pentru produsele care conțin PC. Studiile de la cap la cap ale soluțiilor mixte PC/SDC împotriva SDC singure au arătat o durată redusă a efectelor adverse cu soluția mixtă, dar rapoartele ulterioare nu au observat această diferență. Sunt indicate cercetări suplimentare și pot duce la tratamente mai tolerabile.9,25,32
Soluțiile de adipoliză a injecției care conțin SDC par să aibă un profil de efect advers previzibil, cu dureri, umflături și amorțeli preconizate în perioada inițială post-injecție și potențialul ca un procent mic de pacienți să prezinte pareză post-injecție a nervului mandibular marginal, sau disfagie. Toate aceste reacții adverse s-au rezolvat spontan, deși există rapoarte rare de formare persistentă de granulom și ulcerații cutanate cu cicatrici care rezultă. Acest risc poate fi oarecum atenuat prin interogarea pacienților cu privire la istoricul personal de boală de piele coebnerizantă, boala țesutului conjunctiv, tratamente chirurgicale și nechirurgicale anterioare în zonă și istoricul alergiilor la soia cu soluții care conțin PC derivat din soia. Asigurarea faptului că pacienții nu comprimă zona de injecție după procedură poate reduce riscul de ulcerație.17,28,33
Ingredientul activ din aceste preparate s-a dovedit cu siguranță a fi SDC, iar mecanismul de acțiune este prin citotoxicitatea adipocitelor, nu prin inducerea lipazelor intracelulare așa cum se credea anterior. Cu toate acestea, studiile histologice seriale indică faptul că SDC poate fi mai bine tolerat și poate duce la modele mai favorabile din punct de vedere cosmetic de necroză a grăsimii și fibroză atunci când este administrat concomitent cu PC.17
De asemenea, au fost raportate greață, amețeli și amețeli asociate injecției. Un anumit grad de fibroză asociată injecției este de dorit și poate îmbunătăți laxitatea pielii după tratament, ducând la îmbunătățirea cosmezei, în special în zona submentală.17,31
Injectabile viitoare derivate din agenți mezoterapeutici sunt, de asemenea, în curs de dezvoltare. Medicamentele care activează lipazele intracelulare prin efectele stimulării beta-adrenergice a adipocitelor sunt în curs de dezvoltare, pierderea temporară rezultată a volumului adipos fiind denumită lipoliză injectabilă. Neothetics Corporation, cunoscută anterior sub numele de Lithera, are două formulări de injectabile pe bază de salmeterol care au finalizat studiile FDA (LIPO-102 și LIPO-202) [Neothetics Corporation Pipeline. http://www.neothetics.com/what_we_do.html]. Acestea pot oferi o alternativă mai sigură pentru tratamentul injectabil al țesutului adipos în viitor, cu un risc redus de efecte secundare desfigurante, deși experiența timpurie arată că rezultatele sunt temporare, iar taifilaxia la agenții beta-adrenergici apare rapid în adipocite atunci când nu este utilizată împreună cu corticosteroizii. .2,3,36
Agenții injectabili pe bază de preparate mezoterapeutice reprezintă o nouă categorie de medicamente care vizează țesutul adipos nedorit. Studiile aprobate de FDA pentru soluții combinate de PC/SDC și agenți beta-adrenergici pentru lipoliză injectabilă pot duce la rezultate mai sigure și mai consistente decât studiile anterioare, care au utilizat formulări intravenoase proprietare, injecții cu mai mulți agenți și medicamente compuse de la diferite farmacii și producători. Între timp, ATX-101 pare a fi un tratament sigur și eficient pentru depozitele de grăsime submentală atunci când se află în mâinile unui injector cu experiență.
Note de subsol
Dezvăluire:Autorii nu raportează conflicte de interese relevante.
- Templul de injecție lipotropă, Killeen, TX Centrul de pierdere în greutate din Texas
- Injecție cu liraglutidă (gestionarea greutății)
- Mecanisme și aplicații ale soluției saline hipertonice
- Bazele indolil azaspirocetale Mannich sunt agenți antimicobacterieni puternici cu membrană selectivă
- Terapie prin injecție Bloomington MN Ameliorarea Durerii Naturale