Abstract
fundal
La nivel global, rinita este una dintre cele mai frecvente tulburări cronice. În ciuda disponibilității medicamentelor pentru gestionarea simptomatologiei rinitei, cercetătorii încă se concentrează pe identificarea unor ținte moleculare noi pentru o mai bună gestionare. MicroARN-urile sunt implicate în multe procese biologice și patologice. Cu toate acestea, rolul miR-17-5p în rinită rămâne neexplorat. Acest studiu a avut ca scop explorarea rolului miR-17-5p în leziunea indusă de lipopolizaharidă (LPS) a celulelor epiteliale nazale RPMI2650 și elucidarea posibilului mecanism molecular de bază.
Rezultate
LPS a deteriorat celulele RPMI2650 prin inhibarea proliferării celulare, promovarea apoptozei și stimularea eliberării citokinelor inflamatorii. Expresia miR-17-5p a fost semnificativ crescută în celulele RPMI2650 după tratamentul cu LPS. Mai mult, s-a constatat că supraexprimarea miR-17-5p a dus la agravarea leziunilor induse de LPS. miR-17-5p expresie reglată negativ a Smad7; supraexprimarea Smad7 a protejat celulele RPMI2650 prin inactivarea căilor de catenină NF-κB și Wnt/β și invers.
Concluzii
Supraexprimarea miR-17-5p a deteriorat celulele RPMI2650 induse de LPS. Exprimarea Smad7 a fost reglementată negativ de miR-17-5p; Expresia Smad7 a inactivat căile de catenină NF-κB și Wnt/β.
fundal
Rinita este una dintre cele mai frecvente afecțiuni inflamatorii ale căilor respiratorii superioare [1]. Această afecțiune este declanșată de expunerea celulelor mucoasei nazale la alergeni. Statisticile actuale sugerează că aproximativ 15% dintre adolescenți suferă de rinită alergică la nivel mondial [1, 2]. Pe lângă obstrucția nazală, senzația de mâncărime și strănutul frecvent, rinita este, de asemenea, una dintre cauzele importante ale somnului tulburat [1]. Această afecțiune este dificil de diagnosticat la copiii mici [3]. Identificarea posibililor factori de mutagenitate genetică și de mediu, elucidarea căilor moleculare implicate în patogeneza rinitei, identificarea unor ținte medicamentoase noi și îmbunătățirea strategiilor actuale de tratament, rămân obiectivul principal în cercetarea rinitei [1,2,3].
MicroARN-urile (miARN-urile sau miR-urile) aparțin familiei ARN-urilor necodificate, așa cum sugerează și numele lor, au dimensiuni mai mici, formate din 22-25 de nucleotide. miARN-urile se leagă de 3’-UTR (regiunea netradusă) a mARN-ului lor corespunzător și provoacă inhibarea post-translațională a acestor mARN-uri [4]. Se știe că miARN-urile sunt exprimate pe scară largă în corpul uman și modulează diverse procese fiziologice și patologice, cum ar fi dezvoltarea de organe, proliferarea celulară, diferențierea celulară, tumorigeneză și apoptoză [5]. Studiile au stabilit deja rolul mai multor miARN în rinită, inclusiv miR-21, miR-30-5p, miR-199b-3p, miR-874, miR-28-3p, miR-203, miR-875-5p etc. . [6,7,8]. Unele dintre miARN-urile menționate mai sus sunt exprimate ridicat, în timp ce altele sunt exprimate scăzut [6,7,8].
Mai multe studii au explorat rolul miR-17-5p în diferite tipuri de cancer [9,10,11,12]. De exemplu, miR-17-5p a mediat autofagia indusă de hipoxie și a inhibat apoptoza în celulele musculare netede vasculare [13]. Creșterea expresiei miR-17-5p a indus proliferarea și a inhibat apoptoza celulelor cancerului pulmonar, în timp ce a redus sensibilitatea celulelor cancerului pulmonar la Gefitinib [14]. În plus, miR-17-5p a fost considerat o potențială țintă terapeutică pentru leziunile aterosclerotice [15], inflamația retinei [16], osteonecroza netraumatică a capului femural [17] și ficatul gras [18]. Cu toate acestea, nu a fost efectuat niciun studiu pentru a explora rolul miR-17-5p în rinită.
Lipopolizaharida (LPS), un agonist al receptorului de tip 4, este principala componentă a peretelui celular al bacteriilor Gram-negative. Funcția sa principală este menținerea integrității structurale a celulei bacteriene [19]. LPS acționează, de asemenea, ca o endotoxină care produce un răspuns imun puternic și inflamație [20]. Studiile au folosit deja leziuni celulare epiteliale nazale induse de LPS ca model de rinită [19]. În acest studiu am explorat rolul miR-17-5p în deteriorarea celulelor epiteliale nazale induse de LPS și am încercat, de asemenea, să explorăm căile și țintele moleculare de bază.
Metode
Cultura și tratamentul celular
Linia de celule epiteliale nazale umane (RPMI2650) a fost achiziționată de la American Type Culture Collection (ATCC, Rockville, MD, SUA). Celulele RPMI2650 au fost cultivate în mod obișnuit în RPMI 1640 (Invitrogen, Carlsbad, CA, SUA) suplimentat cu 10% ser fetal bovin (FBS; Sigma, St. Louis, MO, SUA) în prezența penicilinei/streptomicinei (Sigma, St. Louis, MO, SUA) la 37 ° C într-o cameră umidificată cu 5% CO2. Celulele au fost tratate cu LPS (5 μg/ml) timp de 12 ore.
transfecția miARN
Scramble, siNC, si-miR-17-5p și miR-17-5p mimic au fost sintetizate de GenePharma Co (Shanghai, China). Transfecțiile celulare au fost efectuate folosind reactivul Lipofectamine 3000 (Invitrogen) conform protocolului producătorului.
PCR cantitativ în timp real (RT-PCR)
ARN-urile din celulele cultivate au fost extrase folosind kitul de extracție rapidă ARN pur (Bioteke Corporation, Beijing, China) conform instrucțiunilor producătorului. Pentru transcrierea inversă a miARN, sinteza ADNc într-o singură etapă a fost făcută prin adăugarea cozii poli (A) la capătul 3 'al miARN cu primer adaptor oligo (dT) și transcriptază inversă Super M-MLV (Bioteke Corporation, Beijing, China). Pentru ARNm, ARN-urile totale au fost transcrise invers într-un sistem de reacție care conțin primeri aleatori și transcriptază inversă M-MLV. Ulterior, produsele de transcripție inversă (ADNc) au fost amplificate utilizând reacția în lanț a polimerazei în timp real (RT-PCR) cu Master Mix verde SYBR; RT-PCR a fost efectuat în blocul termic cantitativ Exicycler 96 în timp real (BIONEER, Daejeon, Coreea de Sud). U6 a fost utilizat ca control intern pentru analiza expresiei miARN, în timp ce GAPDH a fost utilizat ca control intern pentru determinarea nivelurilor de expresie a ARNm. Condițiile RT-PCR au fost următoarele: incubare inițială de 10 min la 95 ° C, apoi 40 de cicluri la 95 ° C timp de 10 s, la 60 ° C timp de 20 s și la 72 ° C timp de 30 s, urmată de 5 min incubație la 4 ° C. Analiza relativă de cuantificare a fost efectuată folosind metoda CT 2 - △ △. Fiecare probă a fost analizată în trei exemplare și toate experimentele au fost efectuate de trei ori independent.
Transfecția și generarea de linii celulare transfectate stabil
Secvențe Smad7 de lungime completă și ARN cu ac scurt de păr îndreptate împotriva Smad7 au fost construite în plasmide pEX-2 și respectiv U6/GFP/Neo (GenePharma). Au fost denumiți pEX-Smad7 și respectiv sh-Smad7. Reactivul lipofectamină 3000 (Life Technologies Corporation, Carlsbad, CA, SUA) a fost utilizat pentru transfecția celulelor conform instrucțiunilor producătorului. Plasmida care poartă o secvență care nu vizează a fost utilizată ca un control negativ (NC) al sh-Smad7 denumit sh-NC. Celulele transfectate stabil au fost selectate folosind mediu de cultură conținând 0,5 mg/ml G418 (Sigma-Aldrich, St Louis, MO, SUA). După aproximativ 4 săptămâni, s-au stabilit clone celulare rezistente la G418.
Analiza CCK-8
Celulele au fost însămânțate într-o placă cu 96 de godeuri cu 5000 de celule/godeu. Viabilitatea celulară a fost evaluată de un kit de numărare a celulelor-8 (CCK-8, Dojindo Molecular Technologies, Gaithersburg, MD). Pe scurt, după stimulare, soluția CCK-8 a fost adăugată la mediul de cultură și culturile au fost incubate timp de 1 oră la 37 ° C în aer umidificat 95% și 5% CO2. Absorbanta a fost masurata la 450 nm folosind un cititor de microplaci (Bio-Rad, Hercules, CA).
Testul apoptozei
Analiza apoptozei a fost efectuată pentru a identifica și cuantifica celulele apoptotice utilizând trusa de detectare a apoptozei anexina V-FITC/PI (Beijing Biosea Biotechnology, Beijing, China). Celulele (100.000 celule/godeu) au fost însămânțate în 6 plăci de godeuri. Celulele tratate au fost spălate de două ori cu PBS rece și resuspendate în tampon. Celulele aderente și celulele plutitoare au fost combinate și tratate conform instrucțiunilor producătorului și măsurate cu citometru de flux (Beckman Coulter, SUA) pentru a diferenția celulele apoptotice (anexina-V pozitivă și PI-negativă) de celulele necrotice (anexinina-V și PI-pozitivă) ))).
Elisa
Supernatantul de cultură a fost colectat din plăci cu 24 de godeuri și concentrații de citokine inflamatorii măsurate prin test imunosorbent legat de enzime (Elisa) folosind protocoale furnizate de producător (R&D Systems, Abingdon, Marea Britanie).
Test de citotoxicitate
Citotoxicitatea a fost testată utilizând setul de testare a citotoxicității LDH (Beyotime, Shanghai, China). Pe scurt, celulele au fost însămânțate într-o placă cu 96 de godeuri cu 5000 de celule/godeu și au crescut la 80
90% confluență. Supernatantul fiecărei godeuri (50 pl) a fost transferat pe o placă transparentă cu 96 de godeuri și s-au adăugat 100 pl amestec de reacție în fiecare godeu. După 30 de minute de incubație la temperatura camerei, absorbanța la o lungime de undă de 450 nm a fost determinată folosind un instrument Elisa.
Analiza dublă a activității luciferazei
Site-ul țintă 3’UTR a fost generat de PCR și reporterul luciferază construiește cu Smad7 3’UTR purtând un site presupus de legare miR-17-5p în vectorul de raport pMiR au fost amplificate prin PCR. Celulele au fost co-transfectate cu reporterul de construcție, vectorul de control și miR-17-5p sau scramble folosind Lipofectamine 3000 (Life Technologies, SUA). Testele reporterului s-au făcut folosind sistemul de testare dual-luciferază (Promega) în urma informațiilor producătorului.
Western blot
analize statistice
Toate experimentele au fost repetate de trei ori. Rezultatele mai multor experimente sunt prezentate ca medie ± deviație standard (SD). Analizele statistice au fost efectuate folosind software-ul statistic Graphpad (GraphPad Software, San Diego, CA). P-valorile au fost calculate utilizând o analiză unidirecțională a varianței (ANOVA). O valoare P de
Rezultate
LPS a indus leziuni celulare și a crescut expresia citokinelor inflamatorii în celulele RPMI2650
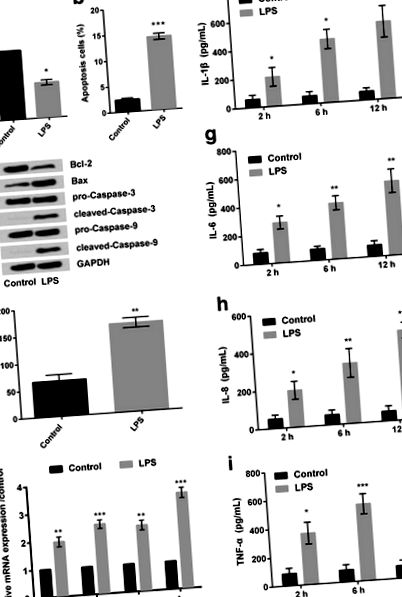
Testul CCK-8 a arătat că după tratamentul celulelor RPMI2650 cu LPS (5 μg/mL); procentul de celule viabile a fost redus semnificativ (P FIG. 1
Apoi, RT-PCR, a dezvăluit că expresia relativă a ARNm a diferitelor citokine inflamatorii, inclusiv IL-1β, IL-6, IL-8 și TNF-α, au fost crescute în celulele tratate cu LPS (Fig. 1e) comparativ cu grup de control al celulelor. În mod similar, estimarea efectivă a citokinelor inflamatorii menționate mai sus (făcută de Elisa) a relevat, de asemenea, aceleași rezultate (Fig. 1f-i). În plus, se pare că LPS a îmbunătățit eliberarea citokinelor inflamatorii într-o manieră dependentă de timp. Având în vedere că 12 ore de LPS au indus creșterile cele mai notabile ale eliberării citokinelor inflamatorii, 12 ore au fost selectate ca o condiție stimulatoare a LPS pentru utilizare în următoarele investigații.
LPS a indus expresia miR-17-5p
Expresia relativă a ARN a miR-17-5p (realizată de RT-PCR) a relevat că expresia miR-17-5p a fost semnificativ crescută (P FIG. 2
Supraexprimarea și suprimarea miR-17-5p în celulele RPMI2650
După transfecția celulelor RPMI2650 cu scramble, siNC, si-miR-17-5p și miR-17-5p mimică, s-a făcut RT-PCR pentru a estima expresia relativă a ARN a miR-17-5p. S-a constatat că expresia miR-17-5p a crescut semnificativ în grupul mimic de celule miR-17-5p în comparație cu grupul de celule amestecate. În mod similar, expresia miR-17-5p a fost semnificativ scăzută în grupul de celule si-miR-17-5p comparativ cu grupul de celule siNC (P FIG. 3
Supraexprimarea miR-17-5p leziuni celulare induse de LPS agravate și eliberarea de citokine inflamatorii
Analiza CCK-8 a exprimat faptul că procentul de celule viabile a scăzut semnificativ (P FIG. 4
Astfel s-a constatat că supraexprimarea miR-17-5p a agravat leziunea indusă de LPS a celulelor RPMI2650 prin suprimarea proliferării celulare, promovarea apoptozei și facilitarea eliberării mediatorilor inflamatori.
miR-17-5p expresie reglementată negativ a Smad7
Expresia relativă a ARNm a Smad7 a fost semnificativ redusă (P FIG. 5
Suprimarea miR-17-5p a redus leziunile celulare prin supraexprimarea Smad7
RT-PCR a dezvăluit că expresia relativă a ARNm a Smad7 a fost semnificativ crescută (P FIG. 6
Astfel, s-a constatat că miR-17-5p a agravat leziunea indusă de LPS a celulelor RPMI2650 prin suprimarea expresiei Smad7.
Supraexprimarea Smad7 a atenuat leziunile celulare induse de LPS
Celulele RPMI2650 tratate cu LPS care supraexprimă Smad7 ca în (grupul de celule LPS + pEX-Smad7) au arătat o creștere semnificativăP FIG. 7
Prin urmare, se poate spune că Smad7 a protejat celulele RPMI2650 de leziuni induse de LPS.
Supraexprimarea Smad7 și supresia miR-17-5p au atenuat leziunile celulare induse de LPS prin inactivarea căilor de catenină NF-κB și Wnt/β
Western blot a dezvăluit că supraexprimarea Smad7 ca în (grupul de celule LPS + pEX-Smad7) a dus la inactivarea ambelor căi NF-κB și Wnt/β catenină (Fig. 8a-b). Deoarece s-a înregistrat o scădere a expresiei proteinelor asociate căii NF-κB, și anume p65 fosforilată (p-p65) și INKα fosforilată (p-INKα) în grupul de celule LPS + pEX-Smad7 (Fig. 8a) comparativ cu celulele cu expresia Smad7 suprimată (grupul de celule LPS + sh-Smad7). În mod similar, proteinele asociate căii Wnt/β catenină cum ar fi Wnt3a, Wnt 5a și β-Catenin au fost, de asemenea, scăzute în celulele care supraexprimă Smad7 ca în grupul de celule pEX-Smad7 (Fig. 8b) comparativ cu celulele cu expresie Smad7 suprimată (LPS + sh -Smad7 grup de celule). În contrast, supraexpresia miR-17-5p (LPS + miR-17-5p mimică) a condus la activarea căilor NF-κB și Wnt/β catenină, în timp ce suprimarea miR-17-5p (LPS + si-miR-17-5p grup de celule) au inactivat aceste două căi (Fig. 8c-d).
Supraexprimarea Smad7 și supresia miR-17-5p au atenuat leziunile celulare induse de LPS prin inactivarea căilor NF-κB și Wnt/β catenină. Supraexprimarea Smad7 a dus la inactivarea ambelor A NF-κB și b Căi de catenină Wnt/β. Suprimarea miR-17-5p a dus la inactivarea ambelor c NF-κB și d Căi de catenină Wnt/β
Discuţie
Rinita, una dintre cele mai frecvente boli cronice ale căilor respiratorii superioare, este destul de răspândită în întreaga lume [1,2,3]. Acumularea de dovezi demonstrează că miARN-urile sunt implicate în patogeneza și procesele biologice ale multor boli [4]. miR-17-5p este unul dintre miARN-urile investigate pe scară largă; cu toate acestea, majoritatea studiilor au explorat rolul său în cancer [9, 10]. Din nou, mai multe studii au discutat rolul miARN-urilor în patogeneza rinitei [6, 7]; cu toate acestea, rolul miR-17-5p în patogeneza rinitei rămâne neclar. În acest studiu am explorat rolul miR-17-5p în patogeneza rinitei și am elucidat mecanismul molecular subiacent folosind linia celulară RPMI2650. RPMI2650 este o linie de celule epiteliale nazale umane, cu caracteristici asemănătoare cu cele ale celulelor epiteliale nazale normale [21].
Smad7 este o proteină codificată de SMAD7 gene [29]. Mai multe studii au descris rolul protector al Smad7 în bolile inflamatorii [29, 30]. Liu GX și colegii săi au descris că Smad7 a protejat rinichii de inflamația mediată de angiotensina II în modelul murin [31]. Între timp, studii recente au raportat că Smad7 ar putea spori diferențierea musculară și ar putea juca un rol important în prevenirea metastazei celulelor canceroase [32, 33]. Cu toate acestea, dacă Smad7 a fost implicat în reglarea leziunilor celulare induse de LPS în rinită rămâne neclar. În studiul nostru am constatat că suprimarea expresiei Smad7 a dus la agravarea leziunii celulare induse de LPS, în timp ce supraexprimarea Smad7 a atenuat leziunile celulelor RPMI2650 induse de LPS.
Calea NF-κB este considerată ca prototip de cale proinflamatorie în principal datorită rolului său asupra expresiei citokinelor și chemochinelor [34]. Similar cu descoperirile noastre, Fei XJ și colegii săi au arătat în studiul lor că Acanthopanax senticosus, un medicament obișnuit în medicina orientală a protejat celulele pulmonare murine de leziunile induse de LPS prin inactivarea căii NF-κB [35]. Mai mult, s-a constatat că acțiunea protectoare a Smad7 împotriva deteriorării celulelor induse de LPS este mediată de inactivarea căii NF-κB, după cum se estimează prin Western blot. Similar cu descoperirile noastre, Wang J, și colab. a descris că Smad7 a inactivat calea NF-κB și a protejat șoarecii de hepatocarcinogeneză [36].
Calea Wnt/βcatenin este una dintre căile conservate evolutiv. Are roluri importante atât în procesele biologice, cât și în boli [37]. LI B și colegii săi au demonstrat că celulele stem mezenchimale au protejat macrofagele alveolare de apoptoza indusă de LPS prin inhibarea căii Wnt/β catenină [38]. Wu și colab. a constatat că Smad7 a reglat în jos expresia Wnt4, Wnt5a, Wnt7a și Wnt10a în osteoartrita [39]. Similar cu aceste studii anterioare, rezultatele noastre au demonstrat că Smad7 proteja celulele RPMI2650 de daunele induse de LPS prin inactivarea căii Wnt/β-catenină. Mai interesant, studiile anterioare au propus reglarea încrucișată între căile NF-κB și Wnt/β-catenină [40, 41]. Cho și colab., Au indicat că diclofenacul inhibă semnalizarea Wnt/β-cateninei în celulele cancerului de colon prin activarea NF-κB [42]. Cu toate acestea, există o corelație între Wnt/β-catenina mediată de Smad7 și semnalizarea NF-κB mai trebuie să fie dezvăluite în continuare.
Concluzii
Astfel, din studiul nostru se poate concluziona că supraexprimarea miR-17-5p a agravat leziunea indusă de LPS a celulelor RPMI2650 prin reglarea negativă a expresiei Smad7, care a protejat celulele RPMI2650 prin inactivarea căii NF-κB și Wnt/β-catenină.
- Cum trec celulele canceroase la o dietă de foame MIT News Massachusetts Institute of Technology
- Aici; s Dieta Paul George recunoaște revenirea sa remarcabilă după rănirea îngrozitoare a picioarelor
- JCI - Ketogeneza previne leziunile hepatice grase induse de dietă și hiperglicemia
- Remediați-vă rănirea cu alimente vindecătoare ACTIVE
- Niveluri scăzute de cupru legate de celulele grase mai grase Hub