Subiecte
Abstract
Studiile epidemiologice au arătat că obezitatea și boala hepatică grasă nealcoolică (NAFLD) aferentă promovează dezvoltarea carcinomului hepatocelular (HCC). Am urmărit să descoperim modificările genetice ale NAFLD-HCC folosind secvențierea întregului exom. Am comparat dezvoltarea HCC la șoarecii obezi genetic și la șoarecii obezi din dietă cu șoareci slabi de tip sălbatic hrăniți cu un chow normal după tratamentul cu dietilnitrosamină. Tumora HCC și probele adiacente normale de la șoareci obezi și slabi au fost apoi supuse secvențierii întregului exom. Importanța funcțională și mecanicistă a mutațiilor identificate în Carboxil ester lipaza (Cel) genă și Oncogenul virusului sarcomului de șobolan Harvey 1 (Hras) a fost elucidată în continuare. Am demonstrat incidențe semnificativ mai mari de HCC atât la șoarecii obezi genetici, cât și la cei dietetici, cu dezvoltare NAFLD, comparativ cu șoarecii slabi fără NAFLD. Semnăturile mutaționale ale NAFLD-HCC și slabe HCC au fost distincte, cu
Introducere
Carcinomul hepatocelular (HCC) este acum din ce în ce mai diagnosticat în rândul persoanelor obeze din țările occidentale și din Asia. 1, 2, 3, 4 Manifestările hepatice ale obezității și sindromului metabolic sunt denumite în mod colectiv boală hepatică grasă nealcoolică (NAFLD). Spectrul clinicopatologic al NAFLD variază de la steatoza hepatică la forma mai agresivă de steatohepatită nealcoolică. Recent, steatohepatita nealcoolică a fost considerată a fi un factor cauzal important în HCC. 5 Studii de cohortă pe scară largă din populație din Statele Unite, Europa și Asia demonstrează un risc crescut de 1,89 ori de HCC în cohorte obeze comparativ cu controalele sănătoase. În plus, diabetul de tip 2 a fost identificat și ca un factor de risc independent pentru HCC. 7 Deși procentul de pacienți diagnosticați anual cu HCC asociat NAFLD (NAFLD-HCC) este încă relativ scăzut, acest număr real este ridicat datorită unei populații mondiale mari de indivizi cu obezitate și diabet. Inflamarea indusă de obezitate, rezistența la insulină și stresul oxidativ pot fi implicate în carcinogeneza NAFLD-HCC. Cu toate acestea, mecanismul de bază, în special mecanismul genetic al carcinogenezei hepatice asociate cu NAFLD, este încă necunoscut.
Cel, carboxil esterul lipazei, funcționează în metabolismul lipidic, inclusiv absorbția esterului colesterilic în ficat și hidroliza esterilor colesterilici. 8 Om CEL s-a raportat că mutația provoacă un sindrom care implică diabet. 9 Dar nu a fost niciodată investigat în niciun fel de tipuri de cancer. Oncogenul 1 al virusului sarcom al șobolanului Harvey (Hras) aparține superfamiliei ras. Hras este o GTPază care funcționează în conversia GTP în PIB pentru a transmite semnalul pentru a regla creșterea celulară. Mutații în genele care codifică proteina Ras, inclusiv Hras au fost raportate în cancer. 10 Cu toate acestea, implicarea Cel și Hras nu a fost încă demonstrată în carcinogeneza hepatică asociată cu NAFLD.
În studiul de față, am demonstrat că obezitatea dietetică și genetică sunt promotori direcți ai dezvoltării NAFLD-HCC și apoi am examinat mecanismul său de acțiune. Am combinat secvențierea întregului exom și oncogenomica încrucișată pentru a identifica mutații genice importante legate de NAFLD-HCC. Am demonstrat semnătura mutației și opt căi metabolice importante și legate de cancer în HCC asociat NAFLD. Am identificat mutații inactivante în Cel și activarea mutațiilor în Hras care a promovat dezvoltarea NAFLD-HCC. Mai mult, am elucidat mecanismele moleculare ale acestor mutații în NAFLD-HCC.
Rezultate
NAFLD este asociat cu o susceptibilitate crescută a hepatocarcinogenezei la modelele genetice și dietetice de șoareci obezi
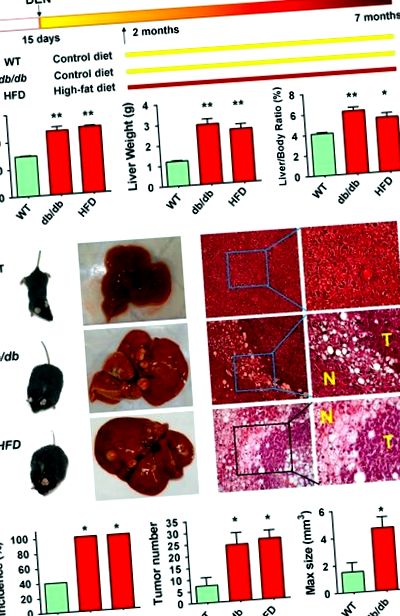
Pentru a compara incidența HCC între șoareci obezi și șoareci slabi, am tratat obezi genetic (db/db) șoareci și șoareci slabi de tip sălbatic cu dietilnitrosamină carcinogenă (DEN) prin injecție intraperitoneală la vârsta de 13-15 zile; șoarecii obezi din dietă au fost stabiliți utilizând o dietă bogată în grăsimi (HFD) la vârsta de 2 luni după administrarea DEN la șoareci slabi de tip sălbatic (Figura 1a). La 7 luni, șoarecii obezi db/db și HFD aveau greutate corporală semnificativ mai mare (47,0 ± 9,7 și 48,6 ± 2,3 g față de 29,3 ± 1,7 g; P 3 vs 1,5 ± 2,1 mm 3; P figura 1
Secvențierea întregului exom a relevat peisajul alterării genomice în HCC asociat NAFLD
Pentru a elucida baza genetică a HCC asociată cu NAFLD, ficatul tumoral și non-tumoral adiacent de la doi șoareci db/db și doi șoareci slabi de tip sălbatic au fost supuși secvențierii de captare a întregului exom. Adâncimea medie de secvențiere a fost de 177,0 ± 31,6 ×, acoperind 97,7 ± 0,1% din exomul vizat. S-au identificat variante somatice și noi de un singur nucleotid (SNV) și inserții mici și deleții (indels) prin compararea tumorii cu probele adiacente non-tumorale și filtrarea împotriva bazei de date dbSNP128. Un total de 282 de SNV-uri noi sinonime și 1 indel exonic care acoperă 277 de gene au fost identificate în tumorile din db/db șoareci, în timp ce 271 de SNV-uri noi sinonime care acoperă 268 de gene au fost găsite în tumori de la șoareci de control slabi (fără indel) (Figura 2a). Opt gene mutante s-au suprapus între HCC obezi și slabi. Printre genele de mutație la șoareci obezi, trei gene, inclusiv Cel , 4933432B09Rik și Ttn (titin) s-au dovedit a fi recurent mutate la cei doi șoareci obezi. Cel și 4933432B09Rik au fost mutați doar la șoareci obezi, în timp ce mutații la Ttn a fost, de asemenea, observată la un șoarece slab (Figura 2a). Prin urmare, două gene (Cel și 4933432B09Rik) au fost identificate ca fiind recurent și în mod specific mutate în HCC asociat NAFLD.
Analiza de secvențiere a întregului exom a identificat modificări genomice ale NAFLD-HCC. (A) Mutațiile non-sinonime asociate HCC au fost identificate prin secvențierea exomului în db/db șoareci și șoareci slabi WT. Genele mutate în mai multe cazuri au fost definite ca gene mutante recurente. (b) Analiza de îmbogățire a căilor KEGG a identificat opt căi importante de interes care ar trebui să fie disregulate în mod semnificativ db/db șoareci obezi, în timp ce doar doi la șoareci slabi.
Căile importante sunt în mod specific neregulate de mutațiile asociate NAFLD în timpul hepatocarcinogenezei
Pentru a înțelege procesele moleculare neregulate în HCC asociate cu NAFLD, s-a efectuat o analiză de îmbogățire a Enciclopediei Kyoto a genelor și genomelor (KEGG) folosind gene mutante identificate în tumori de la șoareci obezi și, respectiv, șoareci de tip sălbatic. Așa cum se arată în Figura 2b și Tabelul 1 suplimentar, genele mutante din HCC asociate cu NAFLD s-au dovedit a fi îmbogățite în opt căi de cancer (cu ⩾ 4 gene implicate în fiecare cale și P ⩾ 4 gene, P 11 semnalizare chemokină, 12 interacțiune citokină - receptor citokină 13 și joncțiune gap 14) pe lângă căile legate de cancer (semnalizare MAPK, semnalizare GnRH, aderență focală și căi în cancer). Interesant, mutat Hras a fost implicat în șase din cele opt căi afectate la șoareci obezi (Figura 2b), demonstrând importanța funcțională a mutaților Hras în rețeaua de semnalizare nereglementată prin modificări genetice în timpul dezvoltării NAFLD-HCC.
Validarea a rafinat gena Cel mutată recurent Cel în HCC asociat NAFLD
Carboxil ester lipaza, codificată de genă Cel, funcții în metabolismul lipidelor. 15 Prin urmare, mutații în Cel, care s-a produs recurent și în mod specific la șoareci obezi, așa cum a fost dezvăluit prin secvențierea exomului, poate lua parte la dezvoltarea HCC asociată NAFLD. Apoi am efectuat ulterior examinarea mutației pe Cel prin secvențierea PCR și Sanger în ficați tumorali și non-tumorali adiacenți de la 29 șoareci obezi (16 db/db și 13 HFD) și 16 șoareci de control slabi. Non-sinonim somatic Cel mutații s-au găsit semnificativ mai frecvent în HCNA NAFLD de la șoareci obezi (10/29, 34,5%) decât în HCCs slabe de control (1/16, 6,3%)P Figura 3
Reglarea descendentă a CEL favorizează proliferarea celulară prin creșterea nivelului esterului de colesteril
Am examinat în continuare nivelul de expresie al genei CEL între HCC asociat nutriției și HCC asociat infecției cu virus, care era disponibil în baza de date TCGA. Am constatat că expresia ARNm a CEL în HCC asociată nutriției (n= 78) a fost semnificativ mai mic decât în HCC asociată cu infecția cu virus (n= 56) (Figura 3b). Pentru a înțelege rolul CEL în celulele hepatice, am doborât expresia CEL în linia celulară normală imortalizată a ficatului uman MIHA folosind shRNAs împotriva CEL (Figura 3c). Knock-down de CEL prin doi vectori shCEL (SH1 și SH2) au promovat în mod semnificativ creșterea celulară, așa cum s-a evidențiat prin testele de viabilitate celulară și formarea coloniilor (Figurile 3d și e), deducerea reglării descendente a CEL favorizează creșterea celulelor hepatice.
Proteina CEL colesteril esterază funcționează în hidrolizarea esterilor colesteril. 7 Am examinat astfel dacă eliminarea lui CEL ar altera homeostazia colesterolului și a colesteril esterului. Așa cum se arată în Figura 4a1, reglarea descendentă a CEL a crescut semnificativ cantitatea de ester colesterilic în celulele MIHA (Figura 4a1). Palmitatul de colesteril este o formă de ester de colesteril având stări lichid-cristaline, astfel adecvat pentru a fi utilizat în cultura celulară. 16, 17 Tratamentul cu acest ester lichid de colesteril a stimulat semnificativ creșterea celulelor MIHA (Figura 4a2). Pe de altă parte, esterul colesteril intracelular acumulat cauzat de CEL eliminarea ar putea fi eliminată semnificativ prin tratamentul cu Avasimibe, un inhibitor al enzimei majore în esterificarea colesterolului, ACAT (acil-coenzima A: colesterol aciltransferază) (Figura suplimentară 2A). Această reducere a colesteril esterului de către Avasimibe a redus ulterior creșterea celulelor în CEL eliminarea celulelor MIHA (Figura 2B suplimentară). Aceste rezultate sugerează colectiv că reglarea descendentă a CEL favorizează proliferarea celulară prin creșterea acumulării intracelulare de colesteril ester.
Knock-down-ul CEL determină stresul reticulului endoplasmatic și, prin urmare, activarea IRE1α/c-Jun N-terminal kinază/c-Jun/activarea căii proteinei-1
Mutațiile pierderii funcției în CEL promovează proliferarea celulară și activează calea IRE1α/JNK/AP-1 prin stres ER
Pentru a înțelege efectul mutațiilor în CEL, funcția biologică a mutațiilor din CEL (CELD454N și CELD555N) a fost evaluată în celulele MIHA. Așa cum se arată în Figura 4c1, expresia ectopică a mutanților CELD454N și CELD555N a crescut semnificativ acumularea anormală de ester colesterilic în comparație cu transfecția CEL de tip sălbatic în celulele MIHA. În concordanță cu inducerea colesteril esterului, CELD445N și CELD555N au promovat în mod semnificativ creșterea celulară în comparație cu CEL de tip sălbatic (Figura 4c2), sugerând că CEL de tip sălbatic are efect de supresie a tumorii prin reglarea homeostaziei esterului colesterilic, care poate fi perturbată de mutațiile sale.
Am evaluat în continuare efectul mutantului CEL pe stresul ER și cascada consecventă. Expresia ectopică a două CEL mutanții au crescut în mod remarcabil nivelurile de proteine ale GRP78, p-IRE1α, p-JNK și p-c-Jun (Figura 4d1) și au îmbunătățit activitatea AP-1 (Figura 4d2). Mai mult, am detectat un nivel crescut de colesteril ester în NAFLD-HCC comparativ cu țesuturile slabe de HCC din modelele de șoarece (P Figura 5
Mutanții Hras au promovat proliferarea celulară prin cascadă de semnalizare MAPK
Schimbarea acestei glutamine/Q în arginină/R sau lizină/K ar putea modifica activitatea bazală a Hras, deoarece această glutamină este implicată în reglarea activității GTPazei. Pentru a determina efectul acestor mutații, am exprimat ectopic formele de tip sălbatic și mutante ale Hras (Q61R și Q61K) în celulele MIHA. Exprimarea de Hras mutanții (Q61R și Q61K) au promovat în mod semnificativ formarea coloniilor și creșterea celulelor în comparație cu transfecția Hras de tip sălbatic, precum și transfecția vectorului gol (Figurile 5b și c) celulele MIHA. Am efectuat în continuare testul activității Ras pentru a determina efectul mutațiilor asupra activității Hras. Rezultatele noastre au arătat că activitățile de Hras mutanții Q61R și Q61K au fost semnificativ mai mari decât Hras de tip sălbatic (Figura 5d). Aceste rezultate demonstrează că Hras mutații la codonul 61 (Q61R și Q61K) identificate în NAFLD-HCC activează mutații oncogene.
Pentru a determina dacă căile de semnalizare Ras/MAPK și fosfatidilinozitol-4,5-bisfosfat 3-kinază (PI3K)/AKT, cunoscute ca fiind în aval de proteinele RAS, 1 sunt reglementate de mutațiile de activare Hras, am evaluat activitatea cheii efectorii acestor căi. Așa cum se arată în Figura 5e, Hras de tip sălbatic a activat semnalizarea Ras/MAPK numai prin creșterea p-MEK1/2 și p-ERK1/2; în timp ce mutanții Q61R și Q61K au activat atât cascadele de semnalizare Ras/MAPK, cât și PI3K/3-fosfoinozozidă dependentă de kinază-1 (PDK1)/AKT (incluzând factorii p-p85, p-PDK1 și p-AKT) în celulele MIHA. De remarcat, un nivel relativ mai ridicat de p-p85 a fost detectat în NAFLD-HCC în comparație cu HCC slab din modelele de șoarece (Figura 5f). Rezultatele oferă, prin urmare, detalii mecaniciste pentru mutațiile oncogene ale Hras în patogeneza NAFLD-HCC (Figura 5g).
Discuţie
În acest studiu, incidența, multiplicitatea și dimensiunea tumorii HCC au fost semnificativ mai mari la șoarecii obezi cu ficat gras în comparație cu șoarecii slabi, demonstrând că obezitatea promovează dezvoltarea NAFLD-HCC. Acest lucru este susținut de constatările anterioare că obezitatea este un factor major de risc HCC la omul 21 și la modelele animale. 22 Modelul HCC indus de DEN a fost utilizat în mod obișnuit. 22, 23, 24 Deși am folosit carcinogenul chimic DEN pentru a accelera dezvoltarea HCC la șoareci, comparația dintre tumoare și țesuturile normale adiacente, precum și comparația dintre șoarecii obezi și șoarecii slabi de control, ar putea elimina efectul direct al DEN. Restul modificărilor genetice ar trebui asociate cu NAFLD. Astfel, acest model este potrivit pentru investigarea modificărilor genetice ale HCC asociate cu NAFLD în acest studiu.
Trei gene, inclusiv Cel, 4933432B09Rik și Ttn, s-au dovedit a fi recurent mutați în NAFLD-HCC obezi. Ttn mutația a fost, de asemenea, găsită într-un control slab HCC, sugerând că Ttn mutația poate fi importantă pentru dezvoltarea HCC, dar nu poate fi asociată în mod specific cu NAFLD-HCC. 4933432B09Rik codifică o proteină necaracterizată. Cel are un interes deosebit, deoarece s-a raportat că servește ca proteină compensatoare pentru alte enzime lipolitice pentru a completa digestia și absorbția nutrienților lipidici. 15 Defecțiunea Cel poate avea un rol în dezvoltarea HCC asociată NAFLD. Frecvența de mutație semnificativ mai mare în Cel a fost validat în continuare în NAFLD-HCC de la 29 șoareci obezi decât HCC slab de la 16 șoareci slabi de control (P 31 Colectiv, descoperirile noastre sugerează că mutațiile dominant-negative sau epuizarea CEL au un rol oncogen important în patogeneza NAFLD-HCC prin inducerea acumulării anormale de esteri de colesteril, care are ca rezultat stresul ER și, prin urmare, activează IREα/JNK/c- Jun/AP-1 cascadă de semnalizare.
Studiile noastre celulare de CEL knock-down și CEL mutațiile au dezvăluit că esterul colesterilic ar fi un jucător cheie pentru promovarea creșterii celulelor hepatice. Reducerea colesteril esterului de către Avasimibe, un inhibitor al enzimei de esterificare a colesterolului ACAT, a suprimat proliferarea celulară în celulele CEL knock-down (Figura suplimentară 2). S-a raportat că acumularea esterului colesteril promovează creșterea și invazia în celulele canceroase de prostată PTEN-nule, susținând rolul său important în progresia cancerului, dar mecanismul molecular a rămas evaziv. 32 În acest studiu, am dezvăluit că acumularea de colesteril ester cauzată de pierderea sau inactivarea CEL a activat cascada de semnalizare IRE1α/JNK/c-Jun legată de UPR, activând ulterior activitatea transcripțională a AP-1 care reglează genele din aval implicate în promovarea proliferării celulare. 33 S-a raportat că stresul ER contribuie semnificativ la dezvoltarea HCC. 34 UPR aparține unei părți a stresului ER. Am constatat că acumularea anormală de esteri de colesteril a dus la activarea stresului ER. Prin urmare, studiul nostru a descoperit mecanismele de acumulare a esterilor de colesteril prin pierderea sau inactivarea CEL în conducerea dezvoltării NAFLD-HCC.
În concluzie, acest studiu a definit rolul important al obezității în promovarea inițierii și dezvoltării NAFLD-HCC în modele animale. Am găsit semnăturile mutaționale și căile specifice ale HCC asociate cu NAFLD prin secvențierea întregului exom (Figura 6). Mai exact, am dezvăluit că mutațiile pierderii funcției în Cel și mutații de câștig de funcție în Hras sunt asociate cu NAFLD-HCC. Ambii Cel mutații inactivante și Hras activarea mutațiilor favorizează creșterea celulelor hepatice. Mecanismele prin care mutațiile inactivante din Cel promovarea creșterii celulelor hepatice sunt mediate de acumularea de colesteril ester, ducând la inducerea stresului ER și, prin urmare, activarea cascadei de semnalizare IRE1α/JNK/c-Jun/AP-1; în timp ce mutațiile care activează Hras (Q61R și Q61K) promovează proliferarea celulelor hepatice prin activarea căilor Ras/MAPK și PI3K/PDK1/Akt. Interesant este că cascadele de semnalizare activate de mutant Cel și Hras ambele sunt asociate cu calea de semnalizare MAPK, care este semnificativ dereglată de gene mutante în NAFLD-HCC (Figura 2b și 6). Descoperirile noastre ilustrează un peisaj genomic cuprinzător și evidențiază evenimentele moleculare specifice și căile de semnalizare în patogeneza NAFLD-HCC.
Rezumat schematic al acestui studiu. Gene care adăpostesc mutații somatice non-sinonime au fost identificate la șoareci NAFLD-HCC, afectând opt căi de semnalizare a cancerului. Dintre toate genele mutante, Cel și Hras prezintă un interes deosebit. Mutațiile acestor două gene au ambele efecte oncogene cu mecanisme diferite.
- Rata în creștere a bolilor hepatice grase nealcoolice crește cazurile de carcinom hepatocelular - U
- Obezitatea la pacienții cu cancer de col uterin crește riscul de evenimente adverse - ScienceDirect
- Căi spre diferențe etnice în obezitate Rolul migrației, culturii și socio-economice
- Căi neurofiziologice către obezitate sub conștientizare și dincolo de controlul individual
- Rolul răspunsului la stres celular mediat de sorbitol în degenerescența retiniană asociată cu obezitatea -