Termeni asociați:
- Amino acid
- Carbohidrați
- Proteină
- Glucoză
- Amoniac
- Azot
- Androgen
- Aportul de proteine
Descărcați în format PDF
Despre această pagină
Funcția alcoolului și a tractului gastro-intestinal
3.4.2 Proteine, grăsimi și carbohidrați complecși
Steatoreea și creșterea excreției de azot fecal sunt caracteristici bine cunoscute ale pacienților care consumă alcool și cu insuficiență pancreatică exocrină și/sau ALD avansată. Cu toate acestea, excreția crescută a grăsimilor fecale a fost raportată și la alcoolicii fără ciroză sau pancreatită cronică (Bode și Bode, 1990). Creșterea excreției de azot fecal a fost, de asemenea, observată la aproximativ 50% dintre alcoolici care nu aveau nici boală hepatică avansată, nici pancreatită cronică (Roggin și colab., 1969). Patomecanismul digestiei perturbate și/sau absorbției lipidelor și proteinelor la alcoolici nu a fost clarificat. Descoperirea că etanolul interferează cu hidrolipidele intestinale ale peptidelor (Dinda și colab., 1984) ar putea explica cel puțin parțial „malabsorbția” proteinelor.
O contribuție importantă la acest domeniu a venit dintr-un studiu asupra alcoolicilor fără tulburări de confuzie, cum ar fi ciroza sau insuficiența pancreatică (Pfeiffer și colab., 1992). Când absorbția duodenală și jejunală a unei soluții nutritive conținând un amestec de proteine, lipide și carbohidrați (maltoză dextrină 90%) a fost determinată folosind o tehnică de perfuzie intestinală, absorbția duodenală a tuturor acestor nutrienți a fost mai mică la alcoolici comparativ cu vârsta potrivită controale, dar ratele de absorbție jejunală nu au fost scăzute atunci când datele pentru segmentele duodenale și jejunale au fost combinate; nu au fost detectate diferențe semnificative statistic între cele două grupuri pentru niciunul dintre nutrienți (Pfeiffer și colab., 1992). Autorii au explicat că diferitele rate de absorbție în duoden față de jejunul alcoolicilor s-au datorat deteriorării mai pronunțate a mucoasei induse de alcool în duoden.
PROTEINĂ
Pierderi obligatorii de azot la adulți
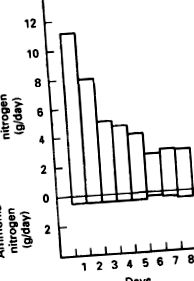
Următorul studiu se referă la datele privind excreția azotului și implică oameni. Acesta a fost conceput pentru a determina pierderile obligatorii de azot. Subiecții au consumat o dietă care a furnizat 150 g de glucoză pe zi. Dieta nu conținea proteine. În prima zi, aproximativ 11 g de azot au fost excretați în urină și aproximativ 0,8 g în fecale. Pe parcursul mai multor zile, în dieta numai cu glucoză, N urinar s-a stabilizat la aproximativ 3,0 g/zi și N fecal la aproximativ 0,8 g/zi. Odată cu stabilizarea pierderilor obligatorii de N, pierderile totale de N s-au ridicat la aproximativ 3,8 g N/zi. Această valoare este echivalentă cu aproximativ 24 de grame de proteine din organism pierdute pe zi. Pierderile urinare de N, sub formă de uree și amoniac, în cursul dietei numai cu glucoză sunt prezentate în Figura 8.18. Datele demonstrează că majoritatea pierderilor urinare de N au luat forma ureei, nu a ionilor de amoniu.
FIGURI 8.18. Cantitatea de azot rezidual din urină pe parcursul unei săptămâni.
Managementul nutrițional al pacienților cu boală renală cronică
Nashat Imran,. William E. Mitch, în Boala renală cronică, 2015
Azot non-uree
În rezumat, excreția totală de azot este calculată din excreția de azot în greutate, SUN și uree. Excreția totală de azot este comparată cu aportul de proteine prescris. În cazul în care valorile diferă cu mai mult de 20%, atunci ar trebui studiate motivele care stau la baza neconformității sau a echilibrului negativ al azotului. 24
O altă utilizare potențială a acestei metode de evaluare a proteinelor alimentare ar fi prima evaluare a aportului de calorii al unui pacient. Acest lucru este posibil, deoarece un dietetician calificat poate estima raportul dintre proteinele alimentare și aportul de calorii din istoricul alimentar al unui pacient. În al doilea rând, aportul de proteine este calculat din producția de azot ureeic de 24 de ore. În al treilea rând, aportul de proteine calculat este împărțit la raportul dintre proteine și aportul de calorii. Rezultatul dă o estimare a aportului de calorii. Acest tip de analiză trebuie utilizat în mod regulat la pacienții tratați cu diete restrânse, deoarece trebuie să fie disponibil un aport suficient de calorii pentru a utiliza proteine în dietă pentru a menține depozitele de proteine din corp. Importanța utilizării acestor calcule în mod regulat este raportul potrivit căruia pacienții cu BCR își „raportează” frecvent consumul de calorii, mai ales dacă sunt obezi. 37 Alte metode de evaluare a aportului de proteine, inclusiv istoricul dietetic, sunt mai puțin exacte și, în timp, pacienții învață răspunsurile adecvate la întrebări despre obiceiurile dietetice. De exemplu, când s-au evaluat înregistrările alimentare și antropometria pacienților cu BCR, s-a constatat că aportul de energie a fost serios subestimat atunci când a fost evaluat prin înregistrările dietetice.
PROTEINĂ Digestia și absorbția echilibrului de proteine și azot
Măsurarea echilibrului de azot
Balanța de azot este definită ca diferența dintre admisie și ieșire și poate fi reprezentată formal prin următoarea ecuație: Balanță = I - U + F + M
unde I este aportul de azot, U este excreția urinară de azot, F este excreția azotului fecal și M este suma tuturor celorlalte căi prin care azotul se pierde din corp.
Aportul de azot este în principal sub formă de proteine și poate fi convenabil măsurat prin metoda Kjeldahl, care măsoară practic tot azotul, cu excepția celui legat de oxigen (de exemplu, nitrați și nitriți). Aceeași metodă este, de asemenea, adecvată pentru măsurarea diferitelor componente ale excreției de azot. Determinarea exactă a balanței de azot necesită analiza directă a porțiunilor duplicate ale dietei, deși se poate face o aproximare rezonabilă utilizând o înregistrare a alimentelor cântărite și tabele cu compoziția alimentelor. O abordare alternativă este de a hrăni subiecții o cantitate constantă dintr-o dietă care a fost special formulată folosind cantități cunoscute de ingrediente.
Urina este calea principală pentru excreția de azot, astfel încât azotul urinar este determinantul major al echilibrului de azot și este necesară o colecție fiabilă de probe de urină de 24 de ore pentru măsurarea echilibrului de azot. Majoritatea azotului din urină se prezintă sub formă de uree, care este produsul final al oxidării aminoacizilor. Alți compuși azotați din urină includ amoniacul, creatinina și acidul uric, precum și cantități mici de peptide, aminoacizi și alte molecule mici. Cantitatea de amoniac depinde de starea acid-bazică a corpului, iar cantitatea de acid uric variază în funcție de aportul de acid nucleic. Cantitatea de creatinină este destul de constantă de la o zi la alta la un individ sănătos și prezintă o bună corelație cu masa musculară. Când aportul de proteine este redus, proporția de uree în urină va scădea, astfel încât conținutul de uree urinară nu este un indicator fiabil al azotului total urinar.
Azotul fecal este compus în principal din celule bacteriene din intestinul gros, împreună cu celule mucoase care au fost îndepărtate de peretele intestinal și unele resturi de proteine alimentare nedigerate. Într-o dietă mixtă normală, azotul fecal se ridică la 8% din aportul de azot destul de constant, deși la dietele cu conținut ridicat de fibre și în special la cele care conțin cantități mari de leguminoase, această proporție poate crește. În măsurarea echilibrului azotului este convențional să se utilizeze un marker neabsorbabil pentru a marca începutul și sfârșitul colecției fecale sau să se utilizeze un marker fecal continuu.
Celelalte căi prin care se pierde azot din corp includ vărsarea de păr, unghii și celule moarte ale pielii, transpirație, salivă, material seminal, sânge pierdut în timpul menstruației sau îndepărtat pentru testare clinică și amoniac expirat în respirație. Pierderile cutanate variază în funcție de rata transpirației și de aportul de proteine. Multe dintre aceste pierderi sunt mici și greu de măsurat, astfel încât se poate lua o singură cifră de 0,5 g de azot pe zi pentru a aproxima suma acestor căi diverse.
Cea mai importantă utilizare a echilibrului azotului este în evaluarea adecvării aportului alimentar. Este criteriul major care este utilizat pentru a evalua necesarul cantitativ de proteine. Astfel de studii au demonstrat că aportul de energie este, de asemenea, un factor determinant major al echilibrului azotului. Măsurarea echilibrului azotului este, de asemenea, baza multor metode biologice de măsurare a calității proteinelor.
Aminoacizi
Căi alternative de eliminare a deșeurilor de azot
Terapia nutrițională a pacienților cu boală renală cronică și impactul acesteia asupra insuficienței renale progresive
Echivalent proteic cu aspectul azotului
Această metodă de estimare a aportului de proteine se bazează pe conceptul că azotul ingerat este egal cu excreția totală de azot dacă nu există nicio modificare în grupul de azot din organism. Proteina ingerată plus produsele care provin din proteina endogenă sunt metabolizate în mai mulți produse azotate (de exemplu, uree, aminoacizi, peptide, urat și creatinină). Dacă echilibrul azotului este neutru (nici catabolism și nici anabolism), produsele azotate care sunt îndepărtate din organism prin urină, scaun și piele plus orice modificare a bazinului de azot ureic al corpului sunt egale cu aportul de azot. Deoarece ureea este principalul produs rezidual de azot, aportul de proteine la pacienții CKD stabili poate fi estimat din rata de apariție a ureei în urină. 27, 28 Rata de apariție a azotului ureic (adică excreția de uree în urină plus acumularea) este similară cu aportul de proteine, dar excreția de azot nonuree (adică azotul din fecale și creatinina urinară, acidul uric, amoniacul, peptidele și așa mai departe) nu variază substanțial cu proteine dietetice; are în medie 0,031 g N/kg zilnic.
În starea de echilibru (când azotul și greutatea ureei din sânge sunt constante), aspectul azotului ureic este egal cu excreția de azot uree urinar. În consecință, aportul de azot este egal cu azot uree urinar plus 0,031 g N/kg. Pentru a converti grame de azot în echivalentul său proteic (PNA), înmulțiți-l cu 6,25, deoarece proteinele constau în medie din 16% azot. Această metodă de estimare a aportului de proteine poate fi utilizată pentru a evalua conformitatea cu o dietă prescrisă, așa cum este ilustrat în exemplul din Caseta 66-2 .
Există limitări importante în interpretarea estimărilor derivate din uree ale aportului de proteine din dietă. În primul rând, în stările catabolice (de exemplu, acidoză, infecție), descompunerea proteinelor endogene poate crește aspectul ureei, astfel încât PNA va depăși estimările aportului de proteine. În schimb, atunci când un pacient devine anabolic, PNA va subestima aportul efectiv de proteine. În al doilea rând, variațiile zilnice ale aportului de proteine sunt reflectate rapid de PNA, astfel încât o singură măsurare nu ne poate spune despre aportul mediu de proteine pe parcursul lunii. În cele din urmă, aspectul azotului proteic poate să nu estimeze cu precizie aportul la extreme ale aportului de proteine. Acest lucru se datorează pierderilor crescute de azot prin căi de excreție nemăsurate la un aport mai mare de proteine și catabolismului proteic endogen mai mare la un aport mai mic de proteine. 29 Indiferent, această metodă este mult mai precisă și reproductibilă decât istoricul dietetic sau metodele de rechemare.
Monitorizare și îngrijire
Elizabeth J. Carey,. Hugo E. Vargas, în Transplantarea ficatului (ediția a treia), 2014
Strategia de reducere a amoniacului
Dizaharidele neabsorbabile, cum ar fi lactuloza, sunt utilizate în mod obișnuit pentru a reduce producția de amoniac în intestin. Lactuloza crește excreția de azot fecal facilitând încorporarea amoniacului în bacterii și printr-un efect cathartic. Lactuloza administrată oral ajunge la cecum, unde este metabolizată de bacteriile enterice, provocând o scădere a pH-ului. Această scădere a pH-ului duce la schimbarea metabolică a bacteriilor favorizând absorbția amoniacului. Doza este ajustată pentru a produce zilnic două sau trei mișcări intestinale moi. 127
Antibioticele precum neomicina sunt de asemenea utile pentru scăderea nivelului de amoniac din sânge, în principal printr-un efect asupra producției de amoniac de către bacteriile intestinale. Cu toate acestea, terapia cu neomicină este asociată cu efecte secundare toxice semnificative și acest lucru a dus la reticența în a o folosi ca agent de primă linie. 127.137 cea mai frecventă
Introducerea unui antibiotic neabsorbabil, rifaximin, ca opțiune pentru tratamentul HE a schimbat abordarea tuturor pacienților cu ciroză care pot avea HE. 133,138,139 Studiul controlat randomizat de referință a înscris 299 de pacienți stabili cu HE documentată, care au fost repartizați la rifaximin versus placebo. 140 de pacienți au fost lăsați să rămână pe lactuloză (> 90% dintre subiecți au primit lactuloză). Punctul final clinic a fost timpul până la prima spitalizare pentru HE în 6 luni de tratament. Dintre pacienții tratați, 22,1% au dezvoltat HE, 13,6% dintre aceștia necesitând spitalizare. Dintre pacienții din grupul placebo, 45,9% au dezvoltat HE, cu spitalizare în 22,6%. Ambele rezultate au fost extrem de semnificative și, în ciuda îngrijorărilor cu privire la utilizarea ridicată a lactulozei, FDA a aprobat calea pentru aprobarea rifaximinului în tratamentul HE. Pacienții trebuie tratați cu 550 mg oral de două ori pe zi, cu sau fără lactuloză. Date recente sugerează că calitatea vieții pacienților cu ciroză crește odată ce HE este gestionat în mod optim cu adăugarea de rifaximină. 141
O strategie alternativă pentru scăderea nivelului de amoniac din sânge este stimularea fixării amoniacului. În condiții fiziologice normale, amoniacul este îndepărtat prin formarea de uree în hepatocitele periportale și prin sinteza glutaminei în hepatocitele perivenoase, mușchiul scheletic și creierul. În ciroza atât enzimele ciclului ureei, cât și activitatea glutaminei sintetazei sunt scăzute în ficat. Strategiile de stimulare a activităților reziduale ale ciclului de uree și/sau sinteza glutaminei au fost încercate în ultimii 20 de ani. Unul dintre cei mai de succes agenți care trebuie utilizați până acum este l -ornitină-l-aspartat (OA). Studiile clinice controlate randomizate cu OA demonstrează scăderea semnificativă a amoniacului și îmbunătățirea concomitentă a testelor psihometrice. 142
Benzoatul este, de asemenea, eficient în reducerea nivelului de amoniac din sânge atât la pacienții cu tulburări ereditare ale ciclului ureei, cât și la pacienții cu ciroză. Într-un studiu clinic controlat randomizat cu benzoat de sodiu versus lactuloză, îmbunătățirea performanței neuropsihiatrice sa dovedit a fi comparabilă. 137
Boala critică
LAURA E. NEWTON MA, RD, DOUGLAS C. HEIMBURGER MD, în Manualul nutriției clinice (ediția a patra), 2006
Proteoliză și pierderea azotului
Hipercatabolismul (proteoliza accelerată) este frecventă la pacienții cu boli critice. Acesta derivă în mare parte din mușchi și poate fi măsurat ca excreție crescută de azot de uree în urină. Acesta reflectă un răspuns sistemic la stres și nu doar eliberarea de proteine din țesuturile rănite. La fel ca și cheltuielile de energie (vezi Fig. 9-2), excreția de azot este proporțională cu severitatea insultei. Glucocorticoizii sunt un mediator major al catabolismului proteinelor, accelerând mișcarea aminoacizilor de la mușchiul scheletic la ficat, unde servesc drept surse de glucoză și proteine de fază acută pentru apărarea gazdei. Alanina este principalul precursor al glucozei pentru producerea de ATP în răspunsul hipermetabolic. Glutamina joacă, de asemenea, un rol în procesul glucogen, contribuind cu azot la rinichi pentru sinteza amoniacului, care neutralizează încărcătura acidă produsă de degradarea rapidă a proteinelor. Producția de proteine viscerale sintetizate de ficat, cum ar fi albumina și prealbumină, este redusă în cazul bolilor critice.
KWASHIORKOR
Metabolismul proteinelor
În kwashiorkor, proteinele sunt digerate în mod adecvat, iar retenția de azot este mult mai eficientă, așa cum se poate observa într-o scădere a producției de azot urinar. Indiferent dacă volumul total de proteine este influențat sau nu de nivelul aportului de proteine, sinteza proteinelor scade în țesuturile individuale, cum ar fi mușchiul și pielea, deoarece acestea acționează ca tampoane în ajustarea metabolismului proteinelor. (Vezi PROTEINE | Digestia și absorbția echilibrului de proteine și azot.)
Modelul aminoacizilor din plasmă prezintă modificări caracteristice. Concentrația de aminoacizi esențiali, în special aminoacizii cu lanț ramificat, a scăzut. Concentrația plasmatică a albuminei este, de asemenea, scăzută, deoarece rata de sinteză este foarte sensibilă la aportul redus de proteine și scade imediat la apariția deficitului de proteine dietetice. Concentrația γ-globulinelor este de obicei normală și poate fi chiar crescută în prezența infecției. Alte proteine plasmatice, cum ar fi transferina și proteina care leagă retinolul, sunt reduse și acest lucru explică frecvența anemiei și keratomalaciei însoțitoare în kwashiorkor. Au fost raportate, de asemenea, concentrații reduse ale unor enzime plasmatice, inclusiv colinesterază, fosfatază alcalină, amilază și lipază.
Exercițiu pentru îmbătrânirea cu succes
Cerințe de proteine și exerciții fizice
Antrenamentul de rezistență de intensitate ridicată este clar anabolic atât la persoanele mai tinere, cât și la cele mai în vârstă. Datele din laboratorul nostru demonstrează o scădere de 10% până la 15% a excreției de azot la inițierea antrenamentului care persistă timp de 12 săptămâni. Adică, formarea progresivă a rezistenței a îmbunătățit echilibrul azotului, astfel subiecții mai în vârstă care efectuează antrenamentul de rezistență au o necesitate medie mai mică de proteine decât subiecții sedentari. 72 Acest efect a fost observat la un aport de proteine de 0,8 g și 1,6 g, indicând faptul că efectul antrenamentului de rezistență asupra retenției de proteine poate să nu fie legat de aportul de proteine din dietă. Aceste rezultate sunt oarecum diferite de cercetările noastre anterioare, 73 demonstrând că exercițiile aerobice efectuate în mod regulat determină o creștere a necesității medii de proteine a sportivilor de rezistență de vârstă mijlocie și tineri. Această diferență rezultă probabil din oxidarea crescută a aminoacizilor în timpul exercițiului aerob care ar putea să nu fie prezent în timpul antrenamentului de rezistență.
Strawford și colab. 74 au demonstrat, de asemenea, efecte similare ale antrenamentelor de rezistență la echilibrul azotului la pacienții cu scădere în greutate legată de HIV. Anchetatorii au examinat efectele unui steroid anabolizant (oxandrolon, 20 mg/zi și un placebo) și antrenament de exerciții de rezistență de intensitate ridicată la 24 de bărbați eugonadali cu scădere în greutate asociată cu HIV (medie, 9% scădere în greutate corporală). Ambele grupuri au prezentat o retenție semnificativă de azot și au crescut în masa corporală slabă, în greutate și în rezistență. Câștigurile medii au fost semnificativ mai mari în grupul oxandrolon decât în grupul placebo în bilanțul de azot, acumularea de FFM și rezistență. Rezultatele au fost similare, indiferent dacă pacienții au luat sau nu inhibitori de protează. Aceste rezultate confirmă efectele pozitive ale exercițiului de rezistență asupra retenției de azot și a necesităților de proteine.
Aceste studii luate în ansamblu demonstrează efectele puternice ale antrenamentelor de exerciții de rezistență asupra nutriției proteinelor. Efectele anabolice au implicații importante în tratamentul multor boli și condiții irositoare, cum ar fi cancerul, infecția cu HIV, îmbătrânirea, insuficiența renală cronică și subnutriția observate la mulți bărbați și femei foarte bătrâni. Prin scăderea eficientă a necesităților de proteine dietetice, exercițiile de rezistență pot limita pierderile suplimentare de masă musculară scheletică, crescând simultan forța musculară și capacitatea funcțională.
- Popcorn - o prezentare generală a subiectelor ScienceDirect
- Candidoza pielii - o prezentare generală Subiecte ScienceDirect
- Amidon de cartofi - o prezentare generală Subiecte ScienceDirect
- Cheltuielile de energie în repaus - o prezentare generală Subiecte ScienceDirect
- Rice Bran - o prezentare generală a subiectelor ScienceDirect