Grupul nostru organizează peste 3000 de evenimente globale Conferenceseries în fiecare an în SUA, Europa și Asia, cu sprijinul a încă 1000 de societăți științifice și publică peste 700 de jurnale cu acces deschis, care conține peste 50000 de personalități eminente, oameni de știință reputați ca membri ai consiliului de redacție.
Jurnalele cu acces deschis câștigă mai mulți cititori și citări
700 de jurnale și 15.000.000 de cititori fiecare jurnal obține peste 25.000 de cititori
Acest nivel de citire este de 10 ori mai mare în comparație cu alte jurnale de abonament (sursă: Google Analytics)
- Raport de caz
- J Obes Pierdere în Greutate Ther 9: 388, Vol 9 (4)
Data primirii: 30 apr 2019/Data acceptării: 30 iul 2019/Data publicării: 06 aug 2019
Abstract
Introducere: Aproximativ 25% dintre pacienții care suferă de insuficiență cardiacă în stadiu final (ESHF) sunt obezi. IMC> 40 împiedică pacienții să primească o grefă de organe, deoarece obezitatea morbidă (MO) crește dramatic mortalitatea după transplantul de inimă (HTx). Mai mult, MO (IMC> 40) crește riscul de evenimente tromboembolice cu 20%. Tratamentul ESHF la pacienții obezi trebuie să includă tratamentul obezității lor.
Chirurgia bariatrică (BS) este cel mai eficient tratament pentru MO, dar are o mortalitate chirurgicală prohibitivă la pacienții cu ESHF. O strategie este de a implanta mai întâi un dispozitiv de asistare ventriculară stângă (LVAD) pentru a oferi stabilitate hemodinamică în timpul BS și, în cele din urmă, pentru a reduce IMC-ul pacientului la valori compatibile cu HTx (abordare punte-candidatură). Cu toate acestea, oprirea anticoagulării pentru BS crește riscul de tromboză LVAD și/sau evenimente tromboembolice, în special în prezența MO. Raportăm calea terapeutică pe care am aplicat-o pentru a rezolva această situație provocatoare.
Metodă: Un bărbat de 54 de ani, fost fumător, cu un IMC de 43,8 kg/m 2 și sindrom de apnee în somn, suferea de ESHF datorită cardiomiopatiei ischemice (ocluzie LAD) și ritmică (fibrilație atrială non-valvulară) cu scor CHA2DS2- VASC 5. Stânga fracția de ejecție a ventriculului a fost de 20%. Presiunea pulmonară medie a fost de 35 mm Hg și indicele cardiac a fost de 2,0 l/min/m 2. IMC-ul său a fost singura contraindicație pentru HTx. Echipa noastră instituțională de insuficiență cardiacă a decis să implanteze un LVAD cu flux continuu pentru a îmbunătăți starea hemodinamică a pacientului și apoi să efectueze o gastrectomie de mânecă (SG).
Cuvinte cheie: Dispozitiv de asistență ventriculară stângă chirurgie bariatrică; Gastrectomia laparoscopică a mânecii; Insuficiență cardiacă în stadiul final; Transplant de inimă
Introducere
Suportul LVAD asigură stabilitate hemodinamică în timpul BS. Cu toate acestea, oprirea anticoagulării la pacienții obezi pentru BS crește riscul de tromboză LVAD și/sau evenimente tromboembolice. Raportăm calea terapeutică pe care am aplicat-o pentru a rezolva această situație provocatoare.
Descrierea cazului
Pacientul a fost tratat între 02.2018 și 01.2019 la Spitalul Universitar Vaud (CHUV, Lausanne, Elveția).
Domnul. R. C, un bărbat de cincizeci și patru de ani, fost fumător la 45 PA, suferind de hipertensiune arterială, obezitate în stadiul III cu IMC 43,8 kg/m 2 (134 kg pentru 175 cm) și sindrom de apnee în somn tratat cu CPAP. Pacientul a avut în plus un istoric de numeroase intervenții chirurgicale abdominale (9 prin intervenții chirurgicale deschise și unul prin abord laparoscopic).
În fundalul cardiac, are o boală cardiacă ischemică după o ocluzie a LAD, cu o restenoză cronică a unui stent în acea poziție. Are o fibrilație atrială non-valvulară persistentă (scor CHA2DS2-VASC 5 puncte) ca tulburări ritmice, anticoagulate de apixaban. Pacientul poartă, de asemenea, un Defibrilator Cardioverter implantabil în prevenirea primară a morții subite cardiace. Un RMN cardiac efectuat cu trei ani mai devreme a arătat o dilatație a VS cu fracție de ejecție redusă
(LVEF 28%), diskinezie a peretelui anterior și a vârfului pe șapte segmente miocardice împreună cu fibroză transmurală.
El a fost internat cu o insuficiență cardiacă acută cu dispnee NYHA în stadiul IV. Diagnosticul IC avansat al bolii cardiace ischemice (IHD) a fost păstrat. El a fost diagnosticat cu insuficiență cardiacă avansată din cauza IHD.
O ecocardiogramă transtoracică cu 4 luni înainte de intervenția chirurgicală LVAD a confirmat o dilatare severă a ventriculului stâng, cu fracție de ejecție deprimată sever (FEVS 20%), akinezie anteroseptală anterioară și anteroseptală cu diskinezie apicală, disfuncție diastolică și dilatare atrială stângă cu un volum de 39 cc/m 2. Nu a fost identificată valvulopatie cardiacă semnificativă. Presiunea sistolică a arterei pulmonare a fost măsurată la 30 mm Hg.
Tratamentul farmacologic al IC a fost limitat din cauza hipotensiunii arteriale severe. După discuțiile din partea echipei de inimă, s-a păstrat implantarea LVAD în „abordarea Podului către candidatură”.
Cateterizarea inimii drepte a arătat un indice cardiac sever redus la 2,0 l/min/m 2, presiunea capilară pulmonară la 24 mm Hg și o presiune medie a arterei pulmonare de 35 mmHg. Niciun răspuns la Dobutamină cu privire la presiunea de frecvență, debit sau umplere. Am finalizat evaluarea preoperatorie prin ciclu ergometru cu test de stres submaximal la nivel metabolic, care a fost întrerupt din cauza dispneei severe (9/10). Am concluzionat asupra capacității aerobe foarte modificate, cu un MVO2 max la 11,0 ml/kg/min și o pantă VE/VCO2 până la 38. Am adăugat cel puțin o scanare computerizată Tomografie (CT), precum și o CT sinusală, nu au evidențiat anomalii contraindicate interventie chirurgicala.
Implantul LVAD (Abbott HeartMate 3) a fost efectuat sub bypass cardiopulmonar (CPB; 75 min) utilizând o abordare minim invazivă printr-o mini-sternotomie superioară și o hemitoracotomie anterioară stângă. Operațiunea și faza post-operatorie au fost fără evenimente. Cursul postoperator al pacientului a fost lipsit de evenimente (durata de ventilație mecanică 2, masa grasă absolută în funcție de statura pacientului. Masa totală de grăsime a fost de 47,8% și Indicele de masă grasă (FMI) = 19,05 kg/m 2 .
În ciuda managementului nutrițional și a reabilitării, greutatea pacientului a crescut cu 7 kg în perioada postoperatorie. Astfel, s-a decis efectuarea gastrectomiei manecilor folosind o abordare laparoscopică la 10 luni după implantarea LVAD. În pregătirea pentru chirurgia bariatrică (BS), anticoagularea orală a fost suspendată cu 3 zile înainte de procedură și înlocuită cu Heparină profilactică IV (anti-Xa 2. După primele 3 luni post-operatorii pacientul a obținut o reducere totală a IMC de 9 puncte și Pacientul este acum listat pentru transplant de inimă cu un IMC de 35,3 kg/m 2 .
Discuţie
ESHF (NYHA IV) este corelat cu mortalitate ridicată, până la 40 până la 50% până la un an fără HxT. Aproximativ 25% dintre pacienții care suferă de insuficiență cardiacă în stadiu final (ESHF) sunt obezi. IMC> 40 împiedică pacienții să primească o grefă de organe, deoarece obezitatea morbidă (MO) crește dramatic mortalitatea după transplantul de inimă (HTx). Într-o punte către Htx în greutate, singura modalitate este de a implanta suport LVAD care nu este contraindicat de obezitatea lor. Într-adevăr, obezitatea nu are impact asupra supraviețuirii la jumătatea perioadei după implantarea LVAD, dar este asociată cu un risc crescut moderat de infecție cu transmisie [2,3] și eveniment de tromboză.
La pacientul nostru, în ciuda managementului și reabilitării nutriționale a cărui îmbunătățire clară a abilităților fizice ale pacientului, greutatea a crescut cu 7 kg în timpul celor șase luni de la implantarea unui dispozitiv de asistare ventriculară stângă cu flux continuu (CF-LVAD). De fapt, capacitatea de efort la pacienții cu insuficiență cardiacă rămâne redusă sub sprijinul LVAD [4], ceea ce face ca pierderea în greutate să fie mai dificilă. Echipa noastră instituțională de insuficiență cardiacă a decis să efectueze o gastrectomie a mânecii (SG) pentru a reduce în cele din urmă IMC-ul pacientului la valori compatibile cu HTx (abordare punte-tocandidacție).
Înaintea noastră, puține echipe au lucrat la o abordare combinată LVAD/SG la pacienții obezi ESHF ca o „punte către candidatură”, totuși nu au fost efectuate studii pe scară largă. Într-adevăr, cele mai largi includ nu mai mult de unsprezece pacienți [5]. În toate cazurile descrise, niciun pacient nu a fost sub HM III și au fost raportate evenimente trombotice [6].
Insuficiența cardiacă cronică a fost un predictor puternic al mortalității la pacienții supuși unei intervenții chirurgicale. Motiv pentru care, părea rezonabil să se implanteze mai întâi un flux continuu LVAD (Abbott Heartmate III ™) pentru a îmbunătăți starea hemodinamică a pacientului înainte de a lua în considerare o gastrectomie de mânecă (SG).
Am folosit studii anterioare pentru a alege tehnica SG. Mai multe lucrări au arătat superioritatea SG comparativ cu gastrectomia din Y, care pare să inducă tulburări imunologice care compromit terapia imunosupresoare după HTx. S-a suspectat modificarea structurală a mucoasei. Abordarea laparoscopică a fost cea mai sigură tehnică chirurgicală [7]. Astfel, o incizie care ar fi prea aproape de cablul pompei sau cablul de transmisie poate fi evitată. Alte echipe încearcă BS cu o abordare diferită folosind (Roux en– Y- bypass gastric) [8].
Stabilire de zece luni între implantarea LVAD și LSG. Deși au fost efectuate mai multe studii pentru a demonstra siguranța unei proceduri chirurgicale non-cardiace la pacienții echipați cu LVAD, chirurgia bariatrică a fost rar descrisă, ceea ce ne face să ne confruntăm cu mai multe provocări.
În timpul operației, pe de o parte, au existat complicații ale pompei. Primul pas dificil al intervenției chirurgicale a fost gestionarea tulburărilor hemodinamice cauzate de Pneumoperitoneul. Într-adevăr, insuflarea gazului și anti-tendința exponentului de revenire venoasă la riscul de dezamorsare a pompei, obligându-ne să menținem constant o presiune de insuflație 40), crește riscul de evenimente tromboembolice cu 20% mai mare crescând prin oprirea anticoagulării pentru BS crește riscul de tromboză LVAD și/sau evenimente tromboembolice, în special în prezența MO.
Utilizarea HM III, o pompă rotativă continuă (nepulsatilă), un flux mare de sânge cu suspensie cu suspensie electromagnetică, suprafețe texturate care intră în contact cu sângele, este un dispozitiv revoluționar de asistență ventriculară care oferă un risc mai mic de tromboză. Studiu ridicat Comparați HM II cu HM III și ați concluzionat că dispozitivul HM III a fost mai eficace în comparație cu HM II, dar reduce și complicațiile trombotice [9]. Prin urmare, Mehra și colab. în studiul momuntum, s-au arătat 9,4 la sută din diferența de supraviețuire la 6 guri fără accident vascular cerebral cerebral sau reintervenție pentru tromboza pompoasă între HM II și HM III [9]. LVAD-urile de nouă generație fac managementul tratamentului anticoagulant mai sigur decât oricând chiar și la pacienții cu risc crescut de complicații tromboembolice, făcând posibilă luarea în considerare a LSG într-o manieră senină.
Posibilitatea transformării în chirurgie deschisă nu a fost neglijabilă la pacientul nostru din cauza istoricului a numeroase intervenții chirurgicale abdominale, 9 prin intervenții chirurgicale deschise și una prin abord laparoscopic. Complicația hemoragică datorată adhesiolizei, angiodisplaziei și malformațiilor arteriovenoase a fost crescută prin tratamentul cu aspirină.
De asemenea, am fost îngrijorați de riscul unei cicatrici gastrice slabe. Într-adevăr, perfuziile non-pulsatile datorate LVAD cauzează hipo-perfuzie în sistemul digestiv.
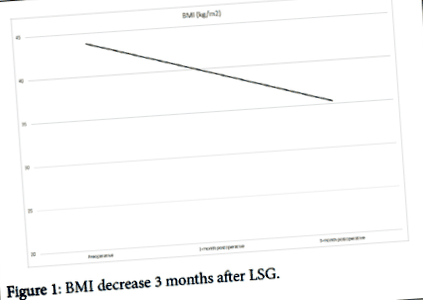
La trei luni după LSG, pacientul a slăbit 22 kg (figura 1) atingând IMC de 35,3 kg/m 2 (Figura 2). În ciuda unei pierderi excesive de greutate, nu s-a observat nici un prejudiciu de cablu, fractură sau mișcare ca efect colateral.
Figura 1: IMC scade la 3 luni după LSG.
- Corecția morbidității obezității, chirurgia morbidității obezității în Allahabad, Lucknow, Noida, Delhi India
- Cum să vorbești cu o persoană dragă despre chirurgia bariatrică - Coaliția de acțiune pentru obezitate
- Îmbunătățirea vieții chirurgicale la un moment dat - Ziua de chirurgie bariatrică a săptămânii naționale de îngrijire a obezității
- Gastrectomia laparoscopică a mânecii la pacienții cu insuficiență cardiacă în stadiu final poate fi efectuată în siguranță
- Chirurgie laparoscopică reglabilă a bandelor gastrice pentru obezitatea morbidă Imagistica anatomică normală