Guenther Boden
Laura H. Carnell Profesor de medicină și șef, Divizia de Endocrinologie/Diabet/Metabolism, Școala de Medicină a Universității Temple, Philadelphia, PA
INTRODUCERE
Obezitatea este strâns asociată cu rezistența la insulină (periferică și hepatică) (1) și cu o stare de inflamație de grad scăzut caracterizată prin creșterea citokinelor proinflamatorii în sânge și țesuturi (2). Ambele, insulina și inflamația, contribuie la dezvoltarea diabetului de tip 2 (T2DM), a hipertensiunii arteriale, a dislipidemiilor aterogene și a tulburărilor de coagulare a sângelui și fibrinolizei. Toate aceste tulburări sunt factori de risc independenți pentru boala vasculară aterosclerotică (ASVD), cum ar fi atacurile de cord, accidentele vasculare cerebrale și boala arterială periferică (3).
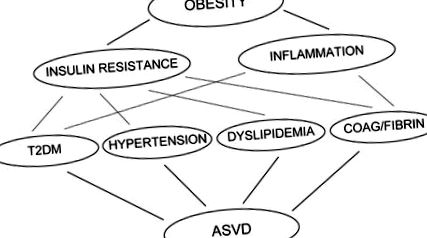
Motivul pentru care obezitatea este asociată cu rezistența la insulină nu este bine înțeles. În acest capitol, voi revizui dovezile care demonstrează că acizii grași liberi (FFA) cauzează atât rezistența la insulină, cât și inflamația în țesuturile țintă majore ale insulinei (mușchiul scheletic, ficatul și celulele endoteliale) și, prin urmare, reprezintă o legătură importantă între obezitate, rezistența la insulină, inflamație și dezvoltarea T2DM, hipertensiune arterială, dislipidemie, tulburări de coagulare și ASVD (Figura 1).
Obezitatea provoacă rezistență la insulină și o stare de inflamație de grad scăzut. Ambele contribuie la dezvoltarea mai multor tulburări, inclusiv T2DM, hipertensiune arterială, dislipidemie și tulburări de coagulare și fibrinoliză, care sunt factori de risc independenți pentru dezvoltarea bolii vasculare aterosclerotice. T2DM: diabet zaharat tip 2, ASVD: boală vasculară aterosclerotică.
Efectele FFA asupra sistemului nervos central, inclusiv demonstrația că infuzia de acid oleic în cel de-al treilea ventricul al șobolanilor a redus aportul de alimente și producția hepatică de glucoză, sunt revizuite separat (vezi capitolul 4).
REZISTENȚA FFA ȘI LA INSULINĂ
Recunoașterea faptului că țesutul adipos nu numai că stochează și eliberează acizi grași, ci și sintetizează și eliberează un număr mare de alți compuși activi (4) a oferit un cadru conceptual care ajută la înțelegerea modului în care obezitatea poate duce la dezvoltarea rezistenței la insulină. Conform acestui concept, o masă de grăsime în expansiune eliberează cantități tot mai mari de compuși precum FFA, angiotensină 2, rezistină, TNF-α, interleukină 6, interleukină 1-β și altele. Unii dintre acești compuși, atunci când sunt perfuzați în cantități mari, pot produce rezistență la insulină. Cu toate acestea, orice substanță, pentru a se califica drept o legătură fiziologică între obezitate și rezistența la insulină, ar trebui să îndeplinească cel puțin următoarele 3 criterii: 1) substanța ar trebui să fie ridicată în sângele persoanelor obeze; 2) creșterea nivelului sanguin (în limitele fiziologice) ar trebui să crească rezistența la insulină și 3) scăderea nivelului sanguin ar trebui să scadă rezistența la insulină. Până în prezent, doar FFA poate îndeplini aceste 3 criterii la subiecții umani. Nivelurile de FFA din plasmă sunt crescute la majoritatea indivizilor (5); creșterea nivelului de FFA plasmatic crește rezistența la insulină (6) și scăderea FFA îmbunătățește rezistența la insulină (7).
Nivelurile FFA sunt crescute în obezitate
Nivelurile de FFA plasmatice sunt de obicei crescute în obezitate deoarece 1) masa mărită a țesutului adipos eliberează mai mult FFA și 2) clearance-ul FFA poate fi redus (8). Mai mult, odată ce nivelurile plasmatice de FFA sunt crescute, acestea vor inhiba acțiunea anti-lipolitică a insulinei, ceea ce va crește în continuare rata de eliberare a FFA în circulație (9).
Creșterea FFA crește rezistența la insulină
În mușchiul scheletic, creșterea acută a FFA plasmatic, de exemplu prin perfuzarea emulsiilor lipidice heparinizate, reduce absorbția de glucoză stimulată de insulină (din care peste 80% are loc în mușchiul scheletic) în funcție de doză, la toate persoanele, indiferent de sex și vârstă (6,10) . În aceste condiții, rezistența la insulină se dezvoltă în decurs de 2-4 ore după creșterea concentrațiilor plasmatice de FFA și dispare în decurs de 4 ore după normalizarea nivelurilor de FFA (11).
În ficat, rezistența la insulină hepatică indusă de FFA este mai dificil de demonstrat, deoarece ficatul este mai sensibil la insulină decât mușchiul scheletic (12). Cu toate acestea, există dovezi convingătoare că creșterile fiziologice ale FFA, precum cele observate după o masă bogată în grăsimi, inhibă suprimarea insulinei a producției hepatice de glucoză (HGP), rezultând o creștere a HGP (1). Acut (1-4 ore), această creștere a HGP se datorează inhibării mediată de FFA a suprimării insulinei a glicogenolizei (13). Cu toate acestea, creșteri mai îndelungate ale FFA sunt susceptibile să crească și gluconeogeneza.
În celulele endoteliale, perfuzia IV de insulină sa dovedit a crește producția de oxid nitric, ducând la creșterea fluxului de sânge vascular periferic (14,15). Creșterile fiziologice ale FFA plasmatice produc rezistență la insulină în celulele endoteliale prin inhibarea creșterii induse de insulină a oxidului nitric și a fluxului sanguin (16).
Scăderea FFA reduce rezistența la insulină
Nivelurile cronice crescute ale FFA plasmatice, așa cum se observă frecvent la persoanele cu diabet zaharat și non-diabetici, provoacă, de asemenea, rezistență la insulină. Acest lucru ar putea fi demonstrat prin normalizarea nivelurilor crescute ale FFA plasmatice pentru doar 12 ore, ceea ce a dus la normalizarea absorbției de glucoză stimulată de insulină la persoanele obeze nediabetice, îmbunătățind în același timp sensibilitatea la insulină din
½ din normal la pacienții obezi cu T2DM (7). Acest lucru a sugerat că nivelurile ridicate ale FFA plasmatice ar fi putut fi singura cauză a rezistenței la insulină la subiecții obezi non-diabetici, dar au fost responsabili doar
1/2 din rezistența la insulină la pacienții obezi cu T2DM (7). Rezultate similare au fost raportate la subiecți non-diabetici predispuși genetic la T2DM (17).
Mecanisme de rezistență la insulină mediată de FFA
FFA poate interfera, de asemenea, cu stimularea insulinei a transportului glucozei prin modularea transcripției genei transportor de glucoză (Glut) și stabilitatea ARNm (28,29)
FFA ȘI INFLAMARE
Obezitatea este asociată cu niveluri crescute de citokine și chemokine proinflamatorii în circulație și în țesuturi (2). După cum sa menționat, țesutul adipos produce și eliberează un număr mare de citokine și chemokine (denumite în mod colectiv adipokine) (4), dintre care unele sunt proinflamatorii. Studii recente au arătat o oarecare lumină asupra motivelor eliberării crescute a citokinelor proinflamatorii în obezitate. Într-un studiu, șoarecii hrăniți cu o dietă bogată în grăsimi timp de 3 luni au dezvoltat inflamație hepatică de grad scăzut, care a fost asociată cu creșterea producției și secreției mai multor citokine proinflamatorii (30). Acest lucru a sugerat că starea inflamatorie a fost cauzată fie de o componentă a dietei, fie de o substanță eliberată din țesutul adipos mărit. FFA sunt candidați buni pentru ambele posibilități, deoarece sunt crescute la majoritatea persoanelor obeze atât în timpul unei mese grase (31), cât și în condiții bazale și postprandiale (5).
Demonstrația recentă conform căreia creșterea acută a FFA plasmatic, pe lângă producerea rezistenței la insulină periferică și hepatică, a activat și calea proinflamatorie NFκB (20), rezultând o expresie hepatică crescută a mai multor citokine proinflamatorii, inclusiv TNF-α, IL1-β, IL6 și un creșterea circulației MCP-1 (22), a susținut noțiunea că FFA este o legătură principală între obezitate sau hrănirea cu conținut ridicat de grăsimi și dezvoltarea modificărilor inflamatorii (Figura 2). În acest context, creșterea circulației MCP-1 ca răspuns la o creștere acută a FFA plasmatice este deosebit de interesantă, deoarece MCP-1 este bine stabilit pentru a regla recrutarea macrofagelor în locurile de inflamație (32). Prin urmare, creșterea nivelului plasmatic al MCP-1 poate explica observația recentă a infiltrării macrofagelor în țesutul adipos al animalelor obeze (33).
FFA ȘI SINDROMUL METABOLIC
Creșterea sindromului metabolic (numit și sindromul rezistenței la insulină) este determinată în principal de creșterea la nivel mondial a obezității. Nu este surprinzător, prin urmare, rezistența la insulină asociată cu obezitatea și acidul gras este intim legată de toate componentele majore ale acestui sindrom, adică T2DM, hipertensiune arterială și dislipidemie aterogenă, precum și alte componente care nu au fost încă incluse în mod formal în complexul sindromului metabolic, cum ar fi ca tulburări ale coagulării sângelui și fibrinolizei.
Diabet de tip 2 (T2DM)
Rezistența la insulină mediată de FFA va duce la dezvoltarea T2DM, cu excepția cazului în care rezistența la insulină este compensată prin excreția de insulină. Există dovezi din ce în ce mai mari că FFA stimulează secreția de insulină, acut și cronic, și că rezistența la insulină indusă de FFA este compensată de excreția mediată de FFA a insulinei la persoanele obeze, dar altfel sănătoase (39). Cu toate acestea, la indivizii pre-diabetici (subiecții cu predispoziție moștenită de a dezvolta T2DM, inclusiv rudele de gradul întâi ale pacienților cu T2DM), această compensare eșuează și consecința rezistenței la insulină indusă de FFA va fi T2DM (17,39). Acest lucru explică numai de ce
50% dintre toți indivizii obezi, rezistenți la insulină, și anume cei care nu sunt în măsură să compenseze, vor dezvolta T2DM pe parcursul vieții (40).
Hipertensiune
Rezistența la insulină indusă de FFA reduce, de asemenea, producția endotelială de oxid nitric prin activarea dependentă de PKC a NAD (P) H oxidazei, rezultând o producție crescută de ROS (vezi pagina 5 și ref. 24). Deficitul de oxid nitric scade vasodilatația și favorizează dezvoltarea hipertensiunii.
Dislipidemie aterogenă
Obezitatea și rezistența la insulină sunt asociate cu producția crescută de VLDL-TG. Un factor major pentru acest lucru este considerat a fi fluxul crescut de FFA în ficat în combinație cu rezistența la insulină asociată cu hiperinsulinemia. Mecanismul precis al acestei supraproducții hepatice VLDL determinate de rezistența la insulină rămâne, totuși, incert (41).
Tulburări ale coagulării și fibrinolizei
Hiperinsulinemia, semnul distinctiv al rezistenței la insulină, este acum recunoscută pentru a crea o stare procoagulantă la persoanele diabetice și non-diabetice prin creșterea nivelului circulator al activității procoagulante a factorului tisular, creșterea generării de trombină, niveluri plasmatice crescute ale factorilor de coagulare VII și VIII și activarea trombocite (42,43).
Obezitatea, rezistența la insulină și T2DM sunt, de asemenea, asociate cu afectarea fibrinolizei (44). Concentrațiile plasmatice ale inhibitorului activatorului plasminogenului 1 (PAI-1), care este inhibitorul primar al fibrinolizei, sunt crescute la persoanele obeze rezistente la insulină și la pacienții cu T2DM (45,46). PAI-1 reglează în jos fibrinoliza prin inhibarea producției de plasmină și astfel promovează tromboza. PAI-1 este sintetizat în celulele endoteliale și hepatocite și este prezent în trombocite și în plasmă (Revizuit în ref. 47). In vitro, secreția PAI-1 este stimulată de insulină în adipocitele umane și de FFA în hepatocite. Prin urmare, nivelurile crescute ale FFA plasmatice, prin producerea de rezistență la insulină și hiperinsulinemie (cu sau fără hiperglicemie), promovează o stare de tendință crescută de tromboză (vezi mai sus) și capacitate scăzută de a liza cheaguri de sânge. Împreună, acest lucru crește riscul de evenimente vasculare acute.
FFA și metaloproteinaze matrice
FFA CA ȚINTĂ PENTRU TERAPIE
Obezitatea, hrănirea cu grăsimi și perfuzia de heparină lipidică cresc toate nivelurile plasmatice de FFA. FFA plasmatic crescut produce rezistență la insulină prin DAG/PKC prin scăderea semnalizării insulinei la nivelul IRS 1/2. Rezistența la insulină promovează ASVD prin hiperinsulinemie cronică, o stare de tendință crescută la coagulare a sângelui și scăderea fibrinolizei și prin mecanisme care nu sunt prezentate aici, inclusiv hipertensiune arterială și dislipidemie aterogenă. FFA plasmatic crescut provoacă, de asemenea, inflamații prin activarea căilor NFκB și JNK. Inflamația poate promova ASVD prin creșterea producției de citokine inflamatorii și prin activarea MMP. ASVD: vascular aterosclerotic; DAG: diacilglicerol; JNK: c-jun NH2 kinază terminală; MMP: metaloproteinaze matrice; PKC: protein kinaza C; TF: factor tisular
MULȚUMIRI
Mulțumim Maria Mozzoli, BS și Karen Kresge, BS pentru asistență tehnică și Constance Harris Crews pentru tastarea manuscrisului.
Această lucrare a fost susținută de granturile Institutelor Naționale de Sănătate RO1-DK-68895, RO1-HL-733267 și RO1-DK-066003.
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Obezitatea; Boală hepatică grasă nealcoolică - tabără de pregătire; Institutul Militar de Fitness
- Obezitate și boli hepatice grase nealcoolice Implicații biochimice, metabolice și clinice -
- Strategii pentru realizarea unei diete sănătoase și reducerea sănătății grăsimilor trans și a acizilor grași saturați -
- Boli hepatice grase nealcoolice la copii - Cartea electronică gratuită pentru obezitate
- PPT - Prezentare PowerPoint a obezității copilăriei și adolescenților, descărcare gratuită - ID 1194060