Abstract
INTRODUCERE
Compușii care perturbă endocrinele (EDC) sunt substanțe chimice care interferează cu funcția hormonului endogen în sistemul endocrin. Expunerile pot duce la anomalii ale reproducerii, modificări ale dezvoltării, defecte ale creierului și ale comportamentului, afectarea funcției imune și cancer (revizuite în (Diamanti-Kandarakis și alții, 2009). Cele mai frecvent studiate EDC sunt DDT, bifenili policlorurați (PCB), difenil polibrominat eteri (PBDE), ftalați și bisfenol A (BPA) În plus față de proprietățile lor endocrine active, s-a demonstrat că unele EDC perturbă programarea epigenomică (Anway și Skinner, 2008; Dolinoy și alții, 2007; Kang și Lee, 2005; Li și alții, 1997. Aici, în urma unui scurt rezumat al epigeneticii, vom descrie sensibilitatea epigenomului la expunerile din mediu în timpul dezvoltării și două tipuri de loci deosebit de sensibili: gene imprimate și epialelele metastabile. Vom rezuma apoi cercetarea folosind galbenul viabil Agouti Modelul de șoarece (A vy) pentru a detecta epigenotoxicitatea BPA și a discuta potențialul acestui model pentru screeningul altor EDC. Efectele transgeneraționale ale EDC sunt bec omiind mai aparent. Pentru a înțelege mecanismele biologice din spatele moștenirii fenotipurilor, trebuie examinate îndeaproape modificările epigenetice ale genomului și ale genelor imprimate.
PROGRAMARE EPIGENETICĂ: UN SISTEM ORCHESTRAT
Ipoteza „originile fetale ale bolii” explică fenomene în care expunerile timpurii ale dezvoltării influențează debutul bolii mai târziu în viață. Ipoteza, propusă pentru prima dată de David J. P. Barker, a postulat inițial că expunerile nutriționale timpurii afectează bolile cardiace (Barker și Clark, 1997). Această teorie cuprinde acum efectele numeroaselor expuneri asupra inițierii cancerului, a tulburărilor de dezvoltare, a bolilor neurologice și a sindroamelor metabolice (Barker și alții, 2002).
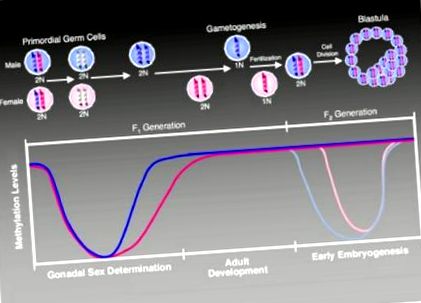
În timpul dezvoltării, epigenomul trece printr-o serie de modificări de metilare cu timp precis concepute pentru a asigura o dezvoltare adecvată (Figura 1). Momentul adecvat și precizia extraordinară a metilării în gameți și fertilizarea ulterioară fac ca acest sistem extrem de concertat să fie deosebit de vulnerabil la interferențele cauzate de expunerile din mediu (Murphy și Jirtle, 2003). Pe scurt, genomul patern este demetilat activ, iar genomul matern este demetilat pasiv după fertilizare. În stadiul morulei, metilarea de novo a genomului apare pentru a stabili modele adecvate de metilare în timpul dezvoltării embrionare.
Modificări ale stării de metilare în timpul dezvoltării (Jirtle și Skinner, 2007). În celulele germinale primordiale, demetilarea la nivelul genomului șterge semnele anterioare de metilare specifică parentală care reglează expresia genelor imprimate. În urma acestei ștergeri, modelele de metilare în genele imprimate sunt restabilite într-o manieră specifică sexului, mai întâi în gonocitele în curs de dezvoltare (masculin, violet colorat), iar mai târziu în linia germinativă feminină (roz colorat) Genele imprimate își mențin semnele de metilare primare pe tot parcursul vieții și în timpul reprogramării epigenomice care urmează fertilizării generației următoare. În generația F2, reprogramarea epigenetică restabilește totipotența zigotului. Genomul patern este activ demetilat (indicat de linia purpurie mai deschisă din grafic), în timp ce genomul matern suferă demetilare pasivă (indicat de linia roz mai deschisă din grafic) (Weaver și Susiarjo, 2009). După implantare, remetilarea genomului are loc pentru a regla diferențierea diferitelor tipuri de celule. Amprentele secundare sunt, de asemenea, stabilite în acest moment și, împreună cu amprentele primare, sunt menținute pe tot parcursul vieții individului. Această întreținere permite moștenirea expresiei monoalelice specifice părinților în țesuturile somatice de-a lungul maturității.
Imprimarea este vulnerabilă la dereglementare în momentul ștergerii primare a amprentei și stabilirea în timpul gametogenezei. Aceste amprente trebuie, de asemenea, protejate de ștergerea necorespunzătoare la scurt timp după fertilizare, atunci când ADN-ul suferă demetilare globală (Jirtle și Skinner, 2007). Astfel, agenții de mediu care modifică amprenta acestor gene vor duce la tulburări severe de dezvoltare și susceptibilitate sporită a bolii (Das și alții, 2009).
REAZĂ REACȚIILE ȘI CONSECINȚELE EPIGENOMULUI
Natura labilă a epigenomului îi permite să răspundă și să se adapteze la factorii de stres ai mediului. Aceste modificări epigenetice pot fi, de asemenea, dăunătoare - atât mai târziu în viață, cât și pentru generațiile viitoare. Chiar și în rândul indivizilor identici genetic, modificările epigenetice pot afecta profund fenotipul. De exemplu, gemenii monozigoți crescuți în medii diferite au niveluri de metilare semnificativ contrastante până la vârsta adultă (Fraga și alții, 2005). Se crede că acest fenomen este responsabil pentru incidențele discordante ale cancerului, astmului și bolilor cardiovasculare întâlnite adesea în rândul gemenilor monozigoți. Cel mai recent, s-a constatat că lupusul eritematos sistemic (LES) variază între gemenii monozigoți (Javierre și alții, 2010). Gemenii discordanți pentru boală au arătat, de asemenea, diferențe semnificative în metilarea ADN și expresia genelor relevante pentru patogeneza LES. Într-un caz rar, o pereche de gemeni monozigoți a fost găsită discordantă pentru un sindrom de dublare caudală. Nu s-au găsit mutații genetice și s-a demonstrat că hipermetilarea genei AXIN1 duce la tulburare (Oates și alții, 2006). Aceste descoperiri semnifică măsura în care dereglarea epigenetică guvernează debutul și progresia bolii.
Modificările epigenetice nu sunt numai ereditare în celulele somatice, dar pot fi menținute și în timpul meiozei. Ca rezultat, informațiile epigenetice pot fi moștenite de-a lungul generațiilor. Exemple de acest lucru apar la plante, insecte și mamifere. La plante, expunerile la mediu pot schimba reglarea epigenetică a expresiei genelor care persistă de-a lungul generațiilor de succes (Boyko și alții, 2010; Molinier și alții, 2006). La drosophila melanogaster, moștenirea epigenetică transgenerațională este guvernată de remodelarea cromatinei (Ruden și Lu, 2008). În cele din urmă, la șoarecele galben viabil Agouti, moștenirea fenotipului culorii stratului în generațiile succesive este controlată de mecanisme epigenetice la alela Agouti (Blewitt și alții, 2006; Morgan și alții, 1999).
Răspunsurile epigenomice umane la foamete par a fi, de asemenea, în concordanță cu moștenirea transgenerațională. Metilarea la gene imprimate este modificată la cei expuși la foamete în uter (Heijmans și alții, 2008; Tobi și alții, 2009). Se consideră că acest răspuns este adaptiv pentru a promova supraviețuirea într-un mediu subnutrit; cu toate acestea, disregularea epigenomică se menține până la vârsta adultă și se corelează cu stări de boală crescute, cum ar fi cancerul, schizofrenia și bolile cardiovasculare (Barker și alții, 2009; Song și alții, 2009). În plus, adipozitatea neonatală crescută, cancerul, bolile atopice și autoimune au fost observate la copiii părinților expuși, indicând potențialul de moștenire transgenerațională a defectelor epigenetice (Painter și alții, 2008). Deoarece modificările metilării ADN-ului în elementele de reglare a amprentei sunt prezente la persoanele expuse in utero la condițiile de foamete cu zeci de ani mai devreme, s-a propus a fi potențial utile ca biosenzori pentru expunerile de dezvoltare la agenți care modifică epigenomul (Hoyo și alții, 2009).
EPIALLELE METASTABILE: BIOSENZORI DE MEDIU
Epialelele metastabile sunt alele care sunt variabile exprimate la indivizi identici genetic datorită modificărilor epigenetice care sunt stabilite în timpul dezvoltării timpurii. Aceste semne epigenetice au o serie de caracteristici importante: 1) sunt stabilite într-un mod stochastic (Morgan și alții, 1999), 2) sunt potențial moștenite transgenerațional (Rakyan și alții, 2003) și 3) stabilirea lor poate fi modificată de către agenți de mediu, cum ar fi suplimentele alimentare (Waterland și Jirtle, 2003). Șoarecii viabili Agouti galbeni (A vy) și Axin Fused (Axin Fu) sunt modele animale unice care poartă epialelele metastabile A vy și, respectiv, Axin Fu. Deși epialelele metastabile nu au fost încă identificate la om, acești biosenzori de șoarece sunt modele utile pentru a determina dacă expunerile nutriționale și toxice materne influențează programarea epigenetică la descendenți.
Epialelele metastabile A vy și Axin Fu conțin inserții intracisternale de particule A (IAP). Retrotranspozițiile IAP sunt răspândite în genomul șoarecelui la aproximativ 1000 de copii pe celulă și constau din elemente de până la 7 kb în lungime completă (Kuff și Lueders, 1988; Maksakova și alții, 2006). Elementele IAP, împreună cu alte câteva, cuprind retrovirusuri endogene de clasa II, care reprezintă 3% din genomul șoarecelui, dar numai 0,3% din genomul uman (Consortium, 2002). Deși elementele IAP sunt inexistente în genomul uman, sunt prezente și alte elemente transpozabile, inclusiv elemente similare retrovirale (Consortium, 2002). Repetările terminale lungi (LTR) care înconjoară IAP poartă promotori care inițiază transcrierea IAP și - în cazul acestor epialelele metastabile - secvențele gazdă adiacente (Falzon și Kuff, 1988; Lewin, 2000; Mietz și Kuff, 1990).
Șoarecele A vy poartă o inserție retrotransponibilă IAP în gena Agouti murină, în amonte de locul normal de început al transcrierii (Dickies, 1962) (Figura 2A). Gena Agouti murină codifică o moleculă de semnalizare paracrină care promovează melanocitele foliculare pentru a produce pigment galben în loc de pigment negru (Miltenberger și alții, 1999). În mod normal, transcrierea se inițiază de la un promotor specific ciclului părului în piele. Expresia tranzitorie în foliculii de păr are ca rezultat o bandă galbenă sub-apicală pe fiecare păr negru, provocând culoarea maronie (agouti) a șoarecilor de tip sălbatic.
Reglarea genelor epigenetice la locusul A vy. (A) Epialelele metastabile A vy conțin o inserție intracisternală de particule A în pseudoexonul 1A. Transcrierea normală are loc de la un promotor specific ciclului părului în exonul 2 și duce la șoareci căprui. Inserarea IAP în amonte de promotorul de tip sălbatic conduce la expresia constitutivă a Agouti de la promotorul criptic IAP și șoareci galbeni. Metilarea stochastică a siturilor CpG în amonte de promotorul criptic se corelează invers cu expresia A vy. (B) Șoareci cu vârsta de cincisprezece săptămâni, identici din punct de vedere genetic, cu culori diferite ale hainei. Șoarecii galbeni (stânga) sunt hipometilați în amonte de promotorul A vy în timp ce șoarecii pseudoagouti (dreapta) sunt hipermetilați la aceste situri CpG, recapitulând expresia normală Agouti. Creșterea nivelului de expresie ectopică a Agouti la șoarecii A vy de 15 săptămâni (de la dreapta la stânga) duce la obezitate, tumorigeneză și diabet.
La șoarecii A vy, un promotor criptic în capătul proximal al IAP induce transcrierea constitutivă Agouti în toate celulele și pe tot parcursul vieții șoarecelui (Waterland și Jirtle, 2003). Această expresie ectopică duce la blana galbenă și la legarea proteinei agouti de receptorul melanocortinei 4 în toate țesuturile, inclusiv în centrul de saturație din hipotalamus (Miltenberger și alții, 1999). Semnalizarea rezultată crește obezitatea, diabetul și cancerul la șoarecii galbeni (Morgan și alții, 1999). Metilarea CpG la IAP este stabilită în timpul dezvoltării embrionare și nivelurile se corelează invers cu expresia ectopică Agouti. Nivelurile de metilare variază în rândul șoarecilor izogeni, determinând fenotipurile să varieze de la galben și obez (nemetilat) la pseudoagouti și sănătos (metilat) (Figura 2B). Acest spectru de potențiale fenotipuri face ca șoricelul A vy să fie un model unic de biosenzor pentru determinarea efectelor epigenetice ale expunerilor de mediu și nutriționale (Dolinoy, 2008; Waterland și Jirtle, 2003).
La fel ca A vy, alela Axin Fu conține o inserție IAP în gena Axin murină. Proteina axină este implicată în formarea axei embrionare a mamiferelor. Inserarea IAP are ca rezultat exprimarea unui transcript axin trunchiat, dar biologic activ, rezultând duplicări axiale și îndoituri de coadă care se formează în timpul dezvoltării (Rakyan și alții, 2003). Șoarecii Axin Fu au cozi îndoite de severitate variabilă; extinderea cotului cozii este invers legată de gradul de metilare IAP la locusul Axin Fu (Rakyan și alții, 2003). La fel ca în modelul A vy, modelul Axin Fu oferă, de asemenea, un instrument puternic pentru analiza capacității expunerilor de dezvoltare de a afecta metilarea și fenotipul genomic (Waterland și Jirtle, 2003).
O altă epiallele metastabile este Cabp IAP. Șoarecii A vy și Axin Fu poartă, de asemenea, gena Cabp IAP datorită prezenței sale în tulpina de șoarece de fundal C57BL/6. Gena proteinei de legare a activatorului CDK5 (Cabp) este localizată pe cromozomul de șoarece 2. Interesant este faptul că Cabp IAP conține un retrotransposon IAP (Druker și alții, 2004), iar expresia genică este invers corelată cu metilarea citozinei la 5 ′ LTR a elementului IAP . Insertul Cabp IAP este specific tulpinii de șoarece C57BL/6, indicând o retrotranspunere recentă. Datorită prezenței Cabp IAP atât la șoarecii A vy cât și la șoarecii Axin Fu, efectele expunerilor la mediu pot fi examinate la mai mult de un locus metastabil într-un singur animal.
MODELUL DE MOUSE ȘI BISFENOL A: DETECTAREA EPIGENOTOXICANȚILOR
Efectul bisfenolului A (BPA) și al suplimentelor alimentare materne asupra fenotipului și epigenotipului descendenților Avy/a. (A) Șoarecii de sex feminin au fost expuși la o dietă de control modificată cu ulei de porumb substituit cu ulei de boabe de soia, o dietă modificată conținând 50 mg/kg BPA sau diete modificate care conțin 50 mg/kg BPA și suplimentate cu donatori de genisteină sau metil 250 mg/kg. (B) Descendenții expuși la BPA in utero și în timpul alăptării au fost hipometilați la alela A vy și cu o proporție mai mare de culoare galbenă decât șoarecii martor. Descendenții care au fost expuși la BPA și suplimentați cu donatori de metil și genisteină s-au întors la nivelurile de metilare și la proporțiile de culoare ale stratului de control.
Deși mecanismele biochimice prin care BPA modifică programarea epigenetică rămân neclare, rezultatele altor studii susțin constatarea că BPA modifică programarea epigenetică. De exemplu, expunerea neonatală a șobolanilor la doze mici de BPA (10 μg/kg greutate corporală) reglează epigenetic expresia fosfodiesterazei tip 4 varianta 4 (PDE4D4) și crește susceptibilitatea la cancerul de prostată (Ho și alții, 2006; Prins și alții, 2008). Cel mai recent, expunerea in utero a șoarecilor la o doză mare de BPA (5 mg/kg) s-a arătat că hipometilează gena Hoxa10 în uter, ducând la o expresie anormală și la o legare crescută a ER∂ de genă (Bromer și alții, 2010). BPA crește, de asemenea, expresia proteinelor histonice în timpul proliferării celulare mediată de estrogen (Zhu și alții, 2009). Indiferent dacă această creștere este corelativă sau cauzală a proliferării celulare, este necesară o investigație suplimentară. În plus, doze mici de BPA (20 μg/kg greutate corporală) administrate șoarecilor însărcinați de-a lungul gestației au modificat epigenomul din creierul anterior al descendenților (Yaoi și alții, 2008). Expunerea la substanța chimică a dus la hipometilare la loci NotI și la dereglarea expresiei genelor. Aceste modificări ar putea ajuta la explicarea defectelor în dezvoltarea creierului și comportamentul observat ca răspuns la expunerea la BPA la șoareci (Tando și alții, 2007).
Programarea epigenetică este un obiectiv final neexaminat încă în testele standard de toxicitate. Mai multe perturbatoare endocrine, pe lângă BPA, pot modifica programarea epigenetică. Dietilstilbestrolul (DES) a fost primul EDC care a arătat că perturbă modelele normale de metilare (Li și alții, 1997). De atunci, DDT, arsenic, ftalați, metoxiclor și vinclozolin au dovedit, de asemenea, că induc modificări epigenetice (Anway și alții, 2005; Kang și Lee, 2005; Nilsson și alții, 2008; Shutoh și alții, 2009; Wahter, 2008). Natura omniprezentă a perturbatorilor endocrini și a altor toxici de mediu care modifică epigenomul provoacă îngrijorare mare pentru expunerile precoce ale dezvoltării și demonstrează necesitatea unor strategii preventive sau terapeutice pentru a combate efectele lor epigenetice negative. În plus, efectele mai multor expuneri mixte și suplimentări asupra epigenomului nu au fost încă pe deplin determinate. Rezultatele acestui studiu BPA indică faptul că suplimentarea nutrițională poate îmbunătăți efectul epigenetic net la alelele metastabile; cu toate acestea, alte amestecuri ar putea foarte bine să prezinte efecte negative aditive sau sinergice. Modelul A vy oferă o modalitate unică de a examina efectele potențiale ale EDC și ale altor expuneri.
EFECTE TRANSGENERAȚIONALE ale ECD
CONCLUZIE
Sensibilitatea epigenomului uman la niveluri scăzute de EDC va afecta în mod direct sănătatea populațiilor actuale și viitoare. Dacă se demonstrează că EDC interferează cu programarea epigenetică la nivelurile actuale de expunere, cercetătorii speculează că, pe lângă modificarea susceptibilității bolii, ar putea contribui și la creșterea documentată a infertilității umane (Price și alții, 2007). Astfel, pe măsură ce organismele de reglementare se luptă pentru a determina cea mai bună modalitate de a încorpora punctele finale epigenetice în evaluarea riscului toxicologic, oamenii de știință trebuie să continue să dezvolte modalități mai bune de a crește lățimea dozelor care pot fi studiate și scala epigenomului interogat în încercarea noastră de a identifica agenți epigenotoxici care ne dăunează nu prin mutarea genomului, ci prin modificarea epigenomului.
MULȚUMIRI
Această lucrare a fost susținută de grantul NIH 5R01-> ES008823, DOE DE-FG02-05ER64101 și un premiu Esther B. O'Keeffe Charitable Foundation.
- Efectele aportului de ouă materne în timpul lactației timpurii asupra concentrației de ovalbumină din laptele uman
- Efectele diferențiale ale plasticității termice de dezvoltare pe trei generații de guppi (
- Efectele nutriției enterale timpurii asupra motilității gastrointestinale și a barierei mucoasei intestinale
- Tableta Demol S 50mg10mg Vizualizați utilizările, efectele secundare, prețul și înlocuitorii 1mg
- Efecte dietetice fructifere, beneficii, scădere în greutate, valori maxime și minime ale consumului de fructe