Departamentul de farmacologie, Școala de științe medicale, Universitatea din New South Wales, Sydney, New South Wales, Australia
Departamentul de farmacologie, Școala de științe medicale, Universitatea din New South Wales, Sydney, New South Wales, Australia
Departamentul de farmacologie, Școala de științe medicale, Universitatea din New South Wales, Sydney, New South Wales, Australia
Departamentul de farmacologie, Școala de științe medicale, Universitatea din New South Wales, Sydney, New South Wales, Australia
Abstract
Introducere
Apetitul este reglementat de o rețea homeostatică complexă care cuprinde componente centrale și periferice pentru a menține echilibrul energetic ((1), (2)). Hipotalamusul este considerat principalul integrator și procesor al informațiilor metabolice periferice. Fluxul de semnale care reglementează metabolismul în creier se bazează pe interacțiuni neuronale care afectează producția sau eliberarea neurotransmițătorilor (3). Nucleul arcuit hipotalamic (Arc) conține neuroni care exprimă peptide orexigenice neuropeptidă Y (NPY) și proteină asociată agouti (AgRP), precum și cei care exprimă peptidă anorexigenică proopiomelanocortină (POMC) și transcriptă reglementată de cocaină și amfetamină, care interacționează cu (1) ). Intrarea de la hormoni care reflectă adipozitatea și echilibrul energetic (leptina derivată din adipoză și insulina pancreatică) este integrată în hipotalamus pentru a regla hrănirea.
Studiile efectuate pe șoareci mutanți indică faptul că supraexprimarea neuropeptidelor orexigenice contribuie la obezitate sau la un fenotip hiperfagic. Expresia hipotalamică a puternicului stimulator alimentar NPY este crescută de câteva ori în deficit de leptină ob/ob și deficit de receptor de leptină db/db șoareci și există, de asemenea, o supraexpresie marcată a AgRP la ambii ob/ob și șoareci db/db ((4), (5)). Cu toate acestea, la modelele de rozătoare obeze cu debut la adulți, în special la cele care utilizează diete gustoase, există o discrepanță aparentă între un fenotip hiperfagic și nivelurile atât ale regulatorilor apetitului orexigenic, cât și al celor anorexigenici. Atât la șobolani, cât și la șoareci, dieta pe termen lung cu conținut ridicat de grăsimi (HFD) indusă de hrănire creșteri marcate a nivelului plasmatic de leptină, cu concentrații reduse de NPY hipotalamic și creșterea produsului de scindare a peptidelor din POMC, hormonul de stimulare a melanocitelor α )) ((6), (7), (8)). Se pare că hiperfagia la aceste animale nu a fost reglementată de acești regulatori centrali esențiali.
Foamea invocă un răspuns hormonal și neuronal complex. Expresia mARN-ului NPY este crescută ca răspuns la restrângerea alimentelor sau la restricția cronică a alimentelor și scade în decurs de 6-24 ore de ad libitum alimentarea (9), (10), (11), (12), (13)). Expresia AgRP este, de asemenea, crescută la obezi ob/ob și db/db șoareci în timpul postului ((4), (5), (12)). Nivelurile de ARNm POMC sunt reduse semnificativ la animalele postite și restaurate prin realimentare sau crescute prin administrarea exogenă de leptină (12), (14)).
Epidemia de obezitate afectează următoarea generație ((15)). S-a demonstrat că obezitatea maternă predispune persoanele la supraalimentare, adipozitate crescută și intoleranță la glucoză (16), (17)). Cu toate acestea, mecanismele neuronale subiacente nu sunt clare. Anterior, am găsit NPY hipotalamic redus și niveluri crescute de ARNm POMC la descendenții de la barajele obeze în ziua 20 postnatală în starea de hrănire liberă ((18)), care este similară cu modificările obezității din dieta cu debut la adulți (6), (7), (8)). Foamea este principalul motiv pentru comportamentul de hrănire. Prin urmare, este important să înțelegem modul în care obezitatea maternă afectează răspunsul acestor regulatori ai apetitului și hormoni la post. Am emis ipoteza că creșterea neuropeptidelor hipotalamice orexigenice ca răspuns la postul peste noapte ar fi mai mare la descendenții barajelor obeze decât barajele slabe, ducând la hiperfagie.
Metode și proceduri
Obezitate maternă
Șobolanii Femei Sprague - Dawley (8 săptămâni, Animal Resources Center, Canning Vale, Australia) au fost găzduiți la 20 ± 2 ° C și menținuți pe un ciclu de lumină/întuneric 12:12 h (luminile aprinse la 0600 ore). Șobolanii au fost repartizați la două grupuri cu greutate corporală egală. Grupul de control a fost hrănit cu chow de laborator (Gordon's Specialty Stockfeeds, NSW, Australia; 11 kJ/g energie, 14% grăsimi, 21% proteine, 65% carbohidrați), iar al doilea grup plăcut - HFD (15,33 kJ/g, energie medie 34% grăsimi (grăsimi saturate 17%), 18% proteine, 50% carbohidrați). HFD a constat din chow modificat cu conținut ridicat de grăsimi (chow de laborator, lapte praf, lapte condensat îndulcit și grăsimi animale saturate) și alimente foarte gustabile în stil cafenea, cum ar fi plăcinte cu carne, prăjituri și biscuiți (4-5 tipuri diferite/zi) de conținut caloric cunoscut ((6), (7), (18)). Șobolanii femele au fost hrăniți fie cu chow, fie cu HFD timp de 5 săptămâni înainte de împerechere cu bărbați adulți obținuți din aceeași sursă. Barajele au continuat aceeași dietă în timpul alăptării. Studiul a fost aprobat de Comitetul de etică a animalelor de la Universitatea din New South Wales.
Post și colectarea probelor
Barajele sunt așezate normal. În ziua 19 postnatală, jumătate din puii de sex masculin din fiecare așternut erau separați de mame la 1700 de ore și adăpostiți cu colegii lor lângă cușca inițială de acasă. Li sa permis accesul gratuit la apă fără alimente. Ceilalți șobolani au rămas cu barajele. În dimineața următoare, puii posteau peste noapte erau recoltați între orele 0800-0900, iar cei care nu erau post între orele 0930 și 1030. Șobolanii au fost anesteziați profund (ketamină/xilazină 180/32 mg/kg, intraperitoneală). După măsurarea lungimii nazo-anale (N-A), sângele a fost îndepărtat prin puncție cardiacă și măsurarea glicemiei (Accu - Check meter; Roche Diagnostics, Nutley, NJ); plasma a fost depozitată la -20 ° C. Puii au fost uciși prin decapitare și întreg hipotalamusul îndepărtat pentru măsurarea ARNm în urma secțiunilor coronale la chiasma optică și sulcusul hipotalamic caudal. Zona hipotalamică a fost disecată prin tăiere la sulci hipotalamici, apoi chiar deasupra celui de-al treilea ventricul. Au fost disecate și cântărite diverse paturi de țesut adipos, precum și organe (inimă, ficat, rinichi) și mușchi scheletici (extensor digitorum longus, soleus și tibial). Lungimea tibiei a fost măsurată ca un indicator al creșterii.
Măsurarea aportului de lapte și a consumului de chow postînțărcare
Aportul de lapte a fost măsurat într-o cohortă separată, deoarece separarea puilor de mamele lor poate afecta atât barajele, cât și puilor. În ziua 10 postnatală, greutățile corporale ale puilor au fost înregistrate după 2 ore de separare de mame și au fost ținute cu colegii lor la 31 ° C. Creșterea în greutate înregistrată la 2 ore după întoarcerea la mame a servit drept măsură indirectă a ingestiei de lapte, reprezentată ca mililitru beat. Consumul de chow postînțărcare a fost măsurat într-o altă cohortă de animale în vârstă de 22 de zile (2 zile după înțărcare) prin cântărirea atentă a tuturor alimentelor rămase după o perioadă de 24 de ore.
Măsurători ale hormonului plasmatic
Concentrațiile plasmatice de leptină și insulină au fost măsurate folosind kituri de radioimunologie disponibile în comerț (Linco, St Charles, MO). S-a calculat parametrul de evaluare a modelului de homeostazie (HOMA): HOMA = insulină plasmatică în repaus alimentar (ng/ml) × glucoză plasmatică în repaus alimentar (mmol/l)/(22,5 × 0,0417); cu cât este mai mare valoarea HOMA, cu atât este mai mare nivelul de rezistență la insulină (19).
PCR cantitativ în timp real
ARNm hipotalamic total a fost izolat folosind reactiv TRIzol (Invitrogen Australia, Melbourne, Australia) conform instrucțiunilor producătorului. ARN-ul total purificat a fost utilizat ca model pentru a genera sinteza complementară a ADN-ului cu prima catenă utilizând M-MLV Reverse Transcriptase, RNase H Minus, Kitul Mutant Point (Promega, Madison, WI). Sondele/primerii Applied Biosystem preoptimizați (Foster City, CA) au fost folosiți pentru PCR cantitativă în timp real (Eppendorf Realplex 2; Eppendorf AG, Hamburg, Germania). ARNm țintă a fost marcat cu FAM și 18S rARN a fost marcat cu VIC. Expresia genică a fost cuantificată într-o singură reacție de multiplexare, unde gena de interes a fost standardizată la 18S rARN. O probă individuală din grupul de control a fost apoi atribuită în mod arbitrar ca un calibrator împotriva căruia toate celelalte probe sunt exprimate ca diferență de pliere.
metode statistice
Rezultatele sunt exprimate ca medie ± s.e.m. Greutatea corporală a barajelor și HOMA a puilor au fost analizate de către studenții nepereche tTest. Alte date au fost analizate folosind ANOVA bidirecțională urmată de post hoc Testele Diferenței celei mai mici ale lui Fisher.
Rezultate
Efect matern
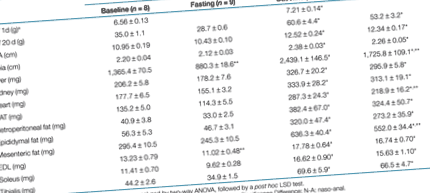
În ziua 1 a vieții, puii născuți din baraje obeze erau cu 10% mai grei decât cei din barajele slabe (tabelul 1, P De 9 și 5 ori mai mare la puii din barajele obeze. Atunci când sunt standardizate în funcție de greutatea corporală, toate aceste diferențe au rămas semnificative. Obezitatea maternă a avut un impact redus asupra nivelului de glucoză din sânge și insulină plasmatică la descendenți (Figura 1a, b), în timp ce nivelurile plasmatice de leptină au fost mai mult decât triplate la puilor de la barajele obeze (Figura 1c).
 |
Glucoza din sânge și insulina plasmatică și leptina la pui de la barajele slabe și obeze la momentul inițial (bare deschise, n = 8) și după post peste noapte, n = 8). Rezultatele sunt exprimate ca medie ± s.e.m. Datele au fost analizate de către ANOVA bidirecțională, urmată de o post hoc Test LSD. *P
Când animalele erau în stare hrănită, expresia ARNp hipotalamic NPY și AgRP la puii de la barajele obeze au fost ușor mai mici decât la puilor de la barajele slabe, fără a atinge semnificație statistică (NPY P = 0,07, Figura 2a, b), în timp ce expresia ARNm POMC a fost semnificativ crescută la puilor de la barajele obeze comparativ cu barajele slabe (Figura 2c). Expresia receptorului NPY Y1 (Figura 3a) a crescut la puii de la barajele obeze, fără modificări semnificative în expresia ARNm a receptorului α-MSH, receptorul melanocortinei-4 (MC4R) (P = 0,07, Figura 3b). Cu toate acestea, expresia ARNm a țintei din aval a MC4R, gena 1 cu o singură minte (Sim1), a fost redusă semnificativ cu 45% la puii de la barajele obeze (P
expresia ARNm a hipotalamicului (A) NPY, (b) AgRP și (c) POMC la pui din baraje slabe și obeze la momentul inițial (bare deschise, n = 8) și după post peste noapte, n = 8). Rezultatele sunt exprimate ca medie ± s.e.m. Datele au fost analizate de către ANOVA bidirecțională, urmată de o post hoc Test LSD. *P
Expresia ARNm a receptorului hipotalamic NPY Y1, MC4R și Sim1 la pui de la baraje slabe și obeze la momentul inițial (bare deschise, n = 8) și după post peste noapte, n = 8). Rezultatele sunt exprimate ca medie ± s.e.m. Datele au fost analizate de către ANOVA bidirecțională, urmată de o post hoc Test LSD. *P
Expresia ARNm a hipotalamicului Ob - Rb și STAT3 la pui de la baraje slabe și obeze la momentul inițial (bare deschise, n = 8) și după post peste noapte, n = 8). Rezultatele sunt exprimate ca medie ± s.e.m. Datele au fost analizate de către ANOVA bidirecțională, urmată de o post hoc Test LSD. *P
Efect de post
Postul peste noapte a condus la reduceri cu 18 și 12% a greutății corporale la pui de la barajele slabe și, respectiv, obezi (tabelul 1). Dintre organele prelevate, doar ficatul a fost afectat de post, cu reduceri de 35 și 30% la pui din barajele slabe și, respectiv, obezi (P
Discuţie
Obezitatea maternă este un factor de risc semnificativ pentru obezitatea infantilă. Studiile la om sugerează că factorii intrauterini pot fi mai importanți decât factorii genetici în schimbarea expresiei genelor ca răspuns la HFD, care pot avea o influență de lungă durată postnatală. Foamea este principalul motiv pentru comportamentul alimentar atât la oameni, cât și la animale. Acest studiu a investigat impactul obezității materne preexistente asupra regulatorilor apetitului central al descendenților și răspunsul la postul peste noapte.
Obezitatea maternă pe termen lung a dus la o greutate corporală mai mare, la dimensiunea corpului și la o adipozitate mai severă la descendenți la înțărcare, ceea ce este în concordanță cu observațiile noastre anterioare (18). În acest studiu, aportul mai mare de lapte după 2 ore de separare este probabil din cauza creșterii foametei, mai degrabă decât a oricărui efect legat de stres, deoarece în ziua 8 postnatală, separarea maternă a provocat modificări semnificative ale corticosteronului după 8, dar nu de 4 ore ((20 )). Astfel, creșterea mai rapidă în greutate la puilor de la descendenți obezi ar putea fi parțial datorată hiperfagiei. Ca urmare, leptina plasmatică a crescut semnificativ. NPY, AgRP și POMC sunt exprimate mai sever în Arcul hipotalamusului. Ca o adaptare la creșterea adipozității și a concentrației plasmatice de leptină, atunci când animalele erau într-o stare sățioasă, numai anorexigenul POMC a fost semnificativ reglat în descendenți de la barajele obeze, ceea ce este similar cu modificările observate la animalele obeze cu debut la adulți )). Cu toate acestea, mARN-ul receptorului Y1 a fost, de asemenea, reglat în sus în starea non-fasted. Deoarece receptorul NPY Y1 nu numai că mediază efectele de hrănire a NPY, ci și reglează cheltuielile de energie ((22)), acest lucru poate duce la reducerea cheltuielilor de energie în starea de saturație.
La descendenții din barajele obeze, modificările regulatorilor apetitului în starea de saturație nu sunt suficiente pentru a explica consumul crescut de lapte în perioada de alăptare și aportul de energie la scurt timp după înțărcare. La șobolanii adulți, concentrațiile de NPY sunt crescute înainte de masă și scad semnificativ pe parcursul consumului, în timp ce α-MSH contracarează NPY pentru a inhiba hrănirea (28). Astfel, este necesar să se compare schimbările în regulatorii apetitului în starea de foame între puii din barajele slabe și obezi.
Șobolanii sunt animale nocturne, consumând majoritatea aportului zilnic în timpul nopții. După post peste noapte, greutatea corporală, ficatul și mase musculare, împreună cu glicemia și nivelurile plasmatice de leptină și insulină au fost reduse semnificativ la toți puii. Efectul postului asupra greutății corporale este legat de rata de creștere la vârsta de înțărcare și de întreruperea hrănirii nocturne. Deoarece excesul de glucoză este stocat ca glicogen în ficat și mușchi și utilizat ca combustibil în perioadele cu deficit de energie, masa hepatică și musculară redusă ar putea reflecta mobilizarea glicogenului stocat pentru a menține nivelurile minime de glucoză.
Receptorul Y1 este exprimat în Arc, PVN, nucleu hipotalamic lateral, nucleu hipotalamic dorsomedial și ventromedial ((33)). Puține studii au măsurat expresia receptorului Y1, cu un raport despre numărul redus al receptorului Y1, distribuția și expresia ARNm în arc în timpul postului (34). Acest lucru poate reflecta diferențele regionale. În acest studiu, am măsurat expresia totală a ARNm a receptorului hipotalamic Y1, inclusiv PVN în care NPY exercită efecte puternice asupra hrănirii.
Ob-Rb de bază redus și STAT3 în aval pot fi un pas inițial către rezistența la leptină observată frecvent la animale obeze și la oameni. Într-adevăr, s-a demonstrat că obezitatea maternă a dus la rezistența la leptină la descendenți chiar înainte de a fi expuși la HFD (38). Acest lucru explică de ce, în stare sățioasă, nivelurile ridicate de leptină la descendenții de la barajele obeze nu au inhibat semnificativ atât NPY, cât și AgRP. Deși Ob-Rb și STAT3 nu au fost modificate semnificativ după post, a existat o reducere chiar mai accentuată a nivelului plasmatic de leptină în timpul postului. După cum sa menționat mai sus, acest lucru poate contribui la creșterea expresiei ARNm NPY și AgRP.
La înțărcare, obezitatea maternă preexistentă a dus la creșteri mai mari ale regulatorilor hipotalamici orexigenici, cu un răspuns redus al regulatorilor anorexigenici la postul peste noapte, în comparație cu descendenții barajelor slabe. Aceste modificări ar putea contribui direct la hiperfagie și la creșterea mai rapidă a descendenților din barajele obeze.
Mulțumiri
Această lucrare a primit finanțare subvenționată de proiect de la Consiliul Național de Sănătate și Cercetare Medicală din Australia către Margaret Morris.
Dezvăluire
Autorii nu au declarat niciun conflict de interese.
- C-peptida C de post un instrument util pentru diagnosticarea diabetului zaharat de tip II la obezii supraponderali
- Frecvența afectării glucozei la jeun la rudele de gradul I ale pacienților cu diabet zaharat de tip II și
- Servicii de alimentație dietetică în tratamentul pacienților obezi cu diabet zaharat - MedCrave online
- Ciclism în post Există vreun beneficiu Ciclistului în post
- Dieta, activitatea fizică și intervențiile comportamentale pentru tratamentul persoanelor supraponderale sau obeze
