Kara L. Kliewer
un Departament de Științe Umane, Colegiul de Educație și Ecologie Umană, Universitatea de Stat din Ohio, Columbus, OH, SUA
Jia-Yu Ke
un Departament de Științe Umane, Colegiul de Educație și Ecologie Umană, Universitatea de Stat din Ohio, Columbus, OH, SUA
Michael B. Stout
un Departament de Științe Umane, Colegiul de Educație și Ecologie Umană, Universitatea de Stat din Ohio, Columbus, OH, SUA
Rachel Cole
un Departament de Științe Umane, Colegiul de Educație și Ecologie Umană, Universitatea de Stat din Ohio, Columbus, OH, SUA
Varman T. Samuel
b Departamentul de Medicină Internă, Școala de Medicină a Universității Yale, New Haven, CT, SUA
Gerald I. Shulman
b Departamentul de Medicină Internă, Școala de Medicină a Universității Yale, New Haven, CT, SUA
c Departamentul de Fiziologie Celulară și Moleculară, Școala de Medicină a Universității Yale, New Haven, CT, SUA
d Institutul Medical Howard Hughes, Școala de Medicină a Universității Yale, New Haven, CT, SUA
Martha A. Belury
un Departament de Științe Umane, Colegiul de Educație și Ecologie Umană, Universitatea de Stat din Ohio, Columbus, OH, SUA
Abstract
1. Introducere
Majoritatea persoanelor care pierd în greutate nu sunt în măsură să mențină pierderea în greutate în timp [1]. Depozitele de lipide ale țesutului adipos sunt completate eficient cu recâștigarea greutății [2] și a fost observată o recăpătare disproporționată a masei grase în raport cu țesutul slab la femeile aflate în postmenopauză [3] și la persoanele în vârstă [4]. În mod similar, s-a observat acumularea preferențială de grăsime în timpul creșterii recuperării la sugarii cu greutate mică la naștere [5] și după înfometare [6].
Modelele de rozătoare sunt utilizate în mod obișnuit pentru a elucida mecanismele biologice care promovează restabilirea țesutului adipos după pierderea în greutate și depunerea accelerată a grăsimilor după oprirea creșterii [7-17]. În aceste studii de „realimentare”, rozătoarele sunt restricționate caloriile/alimentele pentru a induce pierderea în greutate sau pentru a stopa creșterea și, ulterior, se refera la niveluri echivalente cu aporturile de controale potrivite sau cu acces ad-libitum la alimente. Utilizarea energiei sau expresia și activitatea genelor și proteinelor implicate în metabolismul lipidic sunt apoi examinate pentru a caracteriza mecanismele care promovează acumularea de grăsime după încetarea restricției alimentare.
Un potențial factor de confuzie în studiile de realimentare a rozătoarelor este efectul comportamentului hrănirii asupra exprimării genelor și proteinelor, metabolismul întregului corp și depozitele de lipide. Atunci când rațiile zilnice de alimente sunt limitate sub ceea ce ar fi consumat ad-libitum (de exemplu, restricție alimentară) sau raționat la nivelurile consumate prin controale potrivite (de exemplu, reîncărcarea), rozătoarele pot prezenta un model de consum de alimente în care toate alimentele alocate sunt ingerate la scurt timp după este prezentat [18-20]. Acest comportament de hrănire contrastează cu tiparul de ronțăit al consumului de alimente la rozătoarele hrănite ad-libitum, în care alimentele sunt consumate intermitent mai ales în timpul orelor întunecate și în perioade scurte în timpul orelor de lumină [18]. Ca rezultat al acestor modele de alimentație, stările metabolice zilnice ale rozătoarelor care consumă o dietă rațională includ o stare scurtă de hrănire și o stare de post extinsă până la repartizarea alimentară a zilei următoare [18], care contrastează cu rozătoarele care ronțăesc, care rămân efectiv într-o hrănire constantă. stat. În consecință, nivelurile de exprimare a genelor și proteinelor legate de metabolism, răspunsurile metabolice și depozitele de lipide la rozătoarele gorging pot varia considerabil într-un ciclu zilnic de hrănire și pot fi la extreme imediat înainte și după hrănire.
După cunoștințele noastre, niciun studiu nu a examinat modificările legate de metabolismul zilnic, ca urmare a înghițirii induse de restricții în timpul redobândirii greutății. În consecință, în studiile actuale, șoarecii au fost supuși unei restricții alimentare pe termen scurt care a declanșat gorging și, ulterior, au alimentat rații similare cu aporturile zilnice de șoareci de control hrăniți ad-libitum. Depozitele de lipide, metaboliții și hormonii, precum și expresia genelor implicate în metabolismul și inflamația țesutului adipos au fost apoi măsurate la șoarecii gorging în timpul perioadei lor zilnice de hrănire (gorging) și la sfârșitul perioadei lor zilnice de post. În plus, utilizând cleme hiperinsulinemice-euglicemice, sensibilitatea la insulină a fost investigată la șoarecii gorging supuși unor restricții/rații alimentare similare. Obiectivele noastre au fost de a captura oscilațiile intraday în depozitele de lipide și expresia genei țesutului adipos la șoarecii gorging și de a identifica consecințele metabolice ale gorging precipitat de restricția alimentară în timpul recuperării greutății.
2. Materiale și metode
2.1 Animale și proiectarea studiului
Două studii, aproape identice ca design, au fost utilizate pentru a îndeplini obiectivele acestei lucrări. Diferențele primare dintre studii au fost localizarea locuințelor și datele colectate (a se vedea paragrafele următoare). Studiul 1 a fost realizat la Universitatea de Stat din Ohio (OSU) și Studiul 2 la Universitatea Yale. Toate procedurile de studiu au fost aprobate de Comitetele instituționale de îngrijire și utilizare a animalelor din instituțiile respective.
În studiul 1, șoarecii masculi CD2F1 de cinci săptămâni (BALB/cx DBA/2, Charles River Laboratories, Wilmington, MA, SUA) au fost randomizați în funcție de greutate în două grupuri: Control (n = 10) și Restricted (n = 20) ).). Șoarecii au fost adăpostiți individual la o temperatură de 22 ± 0,5 ° C pe un ciclu de lumină-întuneric de 12: 12 ore și au oferit acces gratuit la apă. Șoarecii martori au fost hrăniți ad-libitum cu dietă AIN-93G cu granule semi-purificate (Research Diets, New Brunswick, NJ, SUA). Șoarecii restricționați au fost raționați cu dieta AIN-93G la începutul ciclului de lumină (0830 - 1000). Rațiile alimentare au fost restricționate cu 30 - 75% (în medie
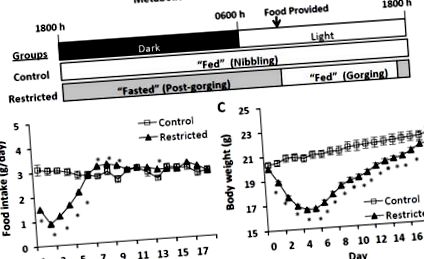
50%) comparativ cu șoarecii martor în primele 5 zile ale studiului și aportul aproximativ al grupului martor în restul de 13 zile. Acest regim de hrănire s-a bazat pe un program de hrănire în perechi care seamănă cu proviziile alimentare în studiile de hrănire și se știe că declanșează gorging la șoareci (observare nepublicată). Toți șoarecii au fost sacrificați după 18 zile la aceeași oră a zilei (0900 - 1200). Șoarecii martori au fost hrăniți ad-libitum până la sacrificiu. Șoarecii cu restricție Refed alimentează hrana repartizată la scurt timp după prezentare și, prin urmare, suferă o scurtă perioadă de hrănire și o perioadă extinsă de post la fiecare 24 de ore de ciclu de hrănire (Fig. 1A). În ziua sacrificiului, jumătate din șoarecii restricționați au fost hrăniți la 0730 și apoi sacrificați
3-4 ore după aprovizionarea cu alimente (în timpul gorging). Cealaltă jumătate a șoarecilor restricționați nu au fost hrăniți și au fost sacrificați la sfârșitul postului zilnic obișnuit extins. Aceste grupuri au fost desemnate Restricted (Gorging) și respectiv Restricted (Post-gorging). Șoarecii au fost anesteziați cu izofluran și sângele a fost colectat prin puncție cardiacă în tuburi tratate cu EDTA. Tuburile au fost centrifugate la 1500 x g timp de 20 minute la 4 ° C și plasma a fost colectată și congelată la -80 ° C până la analiză. Țesuturile au fost excizate, cântărite, congelate în azot lichid și depozitate la -80 ° C până la analiză, cu excepția secțiunilor de țesut adipos alb epididimal (eWAT) care au fost fixate în paraformaldehidă 4% pentru încorporarea parafinei.
Stările metabolice, aportul alimentar și diferențele de greutate corporală între șoareci restricționați și controale hrănite ad-libitum (A) Stări metabolice de șoareci de control și șoareci restricționați în ciclul de hrănire de 24 de ore. Șoarecii restricționați acoperă toate rațiile alimentare la scurt timp după prezentare și, prin urmare, experimentează o scurtă perioadă „hrănită” și o perioadă extinsă „de post” până când hrana este furnizată a doua zi. Șoarecii de control ciugulesc în timpul orelor întunecate și în perioadele scurte în timpul orelor de lumină și, prin urmare, rămân efectiv într-o stare constantă „hrănită”. (B) Aporturile de alimente și (C) Greutățile corporale în timpul restricționării alimentelor (primele 5 zile) și al alimentării. Valorile reprezintă media ± s.e.m. (Control, n = 10; Restricționat, n = 20). Aporturile de alimente au fost evaluate prin testul Mann-Whitney și greutățile corporale prin testul t Student. Asteriscurile indică diferențe semnificative statistic, p-ΔΔCT în raport cu grupul de control [21].
2.4 Histologie
Secțiuni de eWAT (5 μm) de la fiecare șoarece din studiul 1 au fost montate pe diapozitive de sticlă și colorate cu hematoxilină și eozină (H&E) de către Laboratorul de Histologie Core, Colegiul de Stat de Medicină Veterinară din Ohio. Imaginile au fost capturate cu ajutorul unui microscop cu lumină (Olympus, Center Valley, PA, SUA) echipat cu o cameră digitală Pixera Pro 150ES (Pixera, Los Gatos, CA, SUA). Trei până la cinci câmpuri per diapozitiv au fost alese aleatoriu de un evaluator orbit pentru imagistică. Imaginile au fost analizate folosind software-ul ImageJ (NIH, Bethesda, MD, SUA) pentru a măsura aria secțiunii transversale a 150 de adipocite alese aleatoriu pe șoarece [22].
2.5 Lipide hepatice
Lipidele totale au fost extrase din
Secțiuni de 50 mg de ficat de la fiecare șoarece în studiul 1 folosind metoda Folch [23]. Extracția lipidelor a fost realizată folosind o soluție 2: 1 v/v de cloroform și metanol și o soluție de spălare KCl 0,88%. Pentru a facilita separarea fazelor, probele au fost centrifugate la 1000 x g. Faza inferioară (organică) a fost transferată într-un tub pre-cântărit și ulterior uscat sub azot. După uscare, tuburile au fost cântărite din nou pentru a calcula greutatea totală a lipidelor pe probă.
2.6 Măsurători plasmatice
Leptina plasmatică și adiponectina au fost măsurate de ELISA (Millipore, Billerica, MA, SUA) conform instrucțiunilor producătorului. Β-hidroxibutiratul plasmatic a fost cuantificat prin test colorimetric (Sigma Aldrich, St. Louis, MO, SUA).
2.7 Clemă hiperinsulinemică-euglicemică
În studiul 2, catetere care locuiesc au fost plasate în vena jugulară internă a șoarecilor cu 7-8 zile înainte de experimentele cu clamp. Șoarecii au fost postiti peste noapte (alimentele au fost îndepărtate la 1 oră după ce s-au stins luminile), o procedură standard pentru evaluarea utilizării glucozei în timpul experimentelor cu cleme [24]. Șoarecii restricționați, totuși, consumaseră toate rațiile zilnice înainte de îndepărtarea alimentelor pentru post. Astfel, modelul de alimentație și rapiditatea extinsă a șoarecilor restricționați nu au fost deranjați de experimentele cu clemă. Rotația bazală a glucozei la nivelul întregului corp a fost măsurată prin infuzarea [3-3 H] -glucozei la o rată de 0,05 μCi/min timp de 120 min. După măsurători bazale, clema hiperinsulinemică-euglicemică a fost efectuată timp de 140 de minute cu o perfuzie amorsată de 4 minute (20 mU/kg) urmată de perfuzie continuă (3 mU/kg/min) de insulină umană (Novolin R, Novo Nordisk, Princeton, NJ, SUA). [3-3 H] glucoză a fost perfuzată continuu la 0,1 μCi/min și s-a folosit o infuzie variabilă de 20% dextroză pentru a menține euglicemia (
120 mg/dl). Probele de plasmă au fost obținute din coadă la punctele de timp stabilite. 2-deoxi-d- [1-14 C] glucoză a fost injectată sub formă de bolus (10 μCi) la 85 min pentru a măsura absorbția de glucoză specifică țesutului. La finalizarea studiului, șoarecii au fost anesteziați cu injecție de sodiu pentobarbital (150 mg/kg), iar țesuturile au fost excizate, congelate rapid în azot lichid și depozitate la -80 ° C până la analiză.
2.8 Analiza și calcule biochimice cu cleme
Glucoza plasmatică a fost măsurată utilizând un analizor de glucoză YSI 2700D (YSI Life Sciences, Yellow Springs, OH, SUA). Insulina plasmatică a fost determinată prin trusa radioimunologică (Millipore). Pentru a măsura 3 H-glucoză și 2-deoxi-d- [1-14C] -glucoză din plasmă, plasma a fost deproteinizată cu ZnSO4 și Ba (OH) 2, uscată pentru îndepărtarea 3 H2O, resuspendată în apă și numărată în lichid de scintilație folosind un contor de scintilație Beckman Coulter (Brea, CA, SUA). Viteza de rotație a glucozei a fost calculată ca raportul dintre rata de perfuzie a [3-3 H] -glucozei și activitatea specifică a glucozei plasmatice la sfârșitul perioadei bazale și în timpul ultimului (în medie) 30 de minute de stare de echilibru a clemei . Producția endogenă de glucoză a fost determinată prin scăderea ratei de perfuzie a glucozei din eliminarea glucozei stimulată de insulină pe tot corpul. Indicele bazal de rezistență la insulină hepatică a fost calculat ca producție bazală de glucoză endogenă × insulină plasmatică în repaus alimentar [25]. Pentru a măsura eliminarea glucozei specifice țesuturilor, probele de țesut au fost omogenizate și supernatanții au fost supuși unei coloane de schimb ionic (Bio-Rad, Hercules, CA, SUA) pentru a separa țesutul 2-deoxi-d- [1- 14 C] -glucoză- 6-fosfat din 2-deoxi-d- [1-14 C] -glucoză. Absorbția de glucoză tisulară a fost calculată din zona de sub curba conținutului de 2-deoxi-d- [1-14 C] -glucoză și 2-deoxi-d- [1-14C] -glucoză-6-fosfat din țesut [26 ].
2.9 Statistici
3.2 Masa țesutului adipos și dimensiunea adipocitelor
Pentru a determina măsura în care depozitarea lipidelor adipoase este afectată de o restricție temporară a hranei și de modificări ale zilei în starea metabolică, ca urmare a înghițirii în timpul alimentării, am comparat depozitele adipoase de șoareci restricționați în timpul înghițirii și la sfârșitul postului extins. Masa eWAT a șoarecilor restricționați (Gorging) și Restricted (Post-gorging) a fost semnificativ mai mare, cu 21 și respectiv 31%, decât la șoarecii martor și nu au fost diferiți între ei (Fig. 2A). Un grafic de masă eWAT în funcție de greutatea corporală pentru șoareci individuali este prezentat în Figura 2B. În concordanță cu greutățile eWAT, aria secțiunii transversale a adipocitelor epididimale a șoarecilor restricționați (Gorging) și Restricted (Post-gorging) au fost, de asemenea, semnificativ mai mari, cu 31 și respectiv 27%, decât la șoarecii martor și nu au fost diferite între ele ( Fig. 2C, D). Greutățile tamponului de grăsime inghinală nu au fost semnificativ diferite între grupuri (Fig. 2A).
- Aplicația OMG Art of Real Food este aici în limba engleză
- Lanțul alimentar al somonului
- Într-un termen limită, împușcați rapid alimente cu echipament limitat la locația Fstoppers
- Rețetă pentru tarte hamburgeri cu carne de vită măcinată - Delicios - Mâncare și băutură
- Rețetă pentru succes 7 sfaturi pentru vânzarea de alimente online