Date asociate
Datele brute raportate în această lucrare au fost depuse în Dryad: http://dx.doi.org/10.5061/dryad.3jm4q.
Abstract
1. Introducere
Modelul de lungă durată al coevoluției susține că adaptarea reciprocă în interacțiunile speciilor poate duce la o cursă a înarmărilor de fenotipuri în creștere [1,2]. În consecință, adaptările insectelor erbivore pentru a găzdui toxinele plantelor sunt de obicei interpretate ca un răspuns evolutiv la apărarea plantelor, crucial pentru utilizarea anumitor specii de plante ca resursă dietetică [3-8]. În schimb, evoluția adaptărilor specifice pentru a facilita sechestrarea toxinelor plantelor (adică absorbția toxinelor prin intestin și reținerea lor în organism [9]) implică prădători și parazitoizi (al treilea nivel trofic) sau control de sus în jos, ca forță motrice în coevoluția plantă - erbivor. În ciuda aprecierii pe scară largă a sechestrării ca componentă extremă a specializării și adaptării plantelor gazdă împotriva prădării [9,10], mecanismele modului în care sechestrarea se integrează în teoria coevolutivă [3,11] sunt abia înțelese. Pentru a testa importanța relativă de a face față unei diete toxice față de sechestrarea toxinelor în modelarea adaptărilor insectelor, aici evaluăm consecințele funcționale ale unei caracteristici de rezistență care escaladează evolutiv pe fluturii de lapte [12,13].
Cardenolidele (glicozide cardiace) sunt toxine vegetale foarte puternice care inhibă în mod specific Na +/K + -ATPaza, un transportator esențial de cationi animale [14,15]. În mod remarcabil, adaptarea moleculară la cardenolide prin Na +/K + -ATPaze modificate (insensibilitate la ținta țintă) a evoluat convergent în cel puțin cinci ordine de insecte erbivore [16-18]. Rezistența insectelor la Na +/K + -ATPaza se bazează pe substituții specifice de aminoacizi care modifică proprietățile de legare a cardenolidelor Na +/K + -ATPaza și a fost descrisă pentru prima dată în fluturele monarh (Danaus plexippus) [19,20].
Fluturele monarh reprezintă, de asemenea, un caz clasic de apărare dobândită, în care omizele nu numai că tolerează, ci și sechestrează cardenolidele din plantele lor gazdă de lapte (Asclepias spp., Apocynaceae) și transferă aceste toxine în stadiul de fluture pentru propria lor apărare împotriva prădătorilor și paraziților. [21-23]. Practic, toți cei 60160 de fluturi de lapte din tribul Danaini (Nymphalidae) sunt specializați pe plantele gazdă din Apocynaceae, care deseori produc cardenolide [15], sugerând o istorie evolutivă lungă și comună. Cu toate acestea, în Danaini, rezistența la Na +/K + -ATPază a evoluat treptat, rezultând trei forme de Na +/K + -ATPază cu creșterea rezistenței cardenolidelor. Dintre cele 16 specii de Danaini ale căror gene Na +/K + -ATPase au fost secvențiate și testate fiziologic Na +/K + -ATPase, rezistența la cardenolide a fost determinată de trei forme moleculare discrete [12].
În ciuda acceptării generale a interacțiunilor tritrofice ca un important contribuitor la interacțiunile plante - insecte [25,26], nu se știe cum al treilea nivel trofic poate influența adaptarea reciprocă între plante și insecte [3]. Este bine stabilit că cardenolidele protejează fluturii monarhi de atacurile păsărilor [21], iar fluturii monarhi și regina sunt modele de mimică pentru vicerege (Limenitis archippus) [27,28], subliniind eficacitatea sechestrării cardenolidelor ca apărare. Mai mult decât atât, s-a arătat că, între speciile de fluturi de lapte (D. plexippus, tigrul simplu, D. chrysippus și E. core), puterea emetică care acționează asupra prădătorilor este legată de cantitatea de cardenolide stocate [29]. Studiul nostru sugerează astfel un mecanism al modului în care cel de-al treilea nivel trofic se poate implica în coevoluția dintre plante și plante, favorizând toleranța modificată și utilizarea toxinelor de către erbivori. Într-adevăr, fluturii de lapte sunt un model pentru a ne avansa cunoștințele despre modul în care interacțiunile comunitare complexe au modelat evoluția speciilor la nivel molecular și fiziologic.
2. Material și metode
(a) Insecte
Miezul Euploea a fost menținut într-o cușcă de plasă într-o seră pentru a obține ouă. Ouăle Danaus gilippus și D. plexippus au fost achiziționate de la crescătorii comerciali. Lucrul cu E. core și D. gilippus a fost permis sub permisul USDA numărul P526P-12-05106. Ouăle de fluture au fost igienizate la suprafață cu o soluție de oxină de 100 ppm (Bio-Cide, International Inc., Norman, OK, SUA) în apă (0,01% ClO2) timp de 10 minute pentru a preveni transferul potențial de paraziți [30].
(b) Plante
Semințele de Asclepias (asperula, curassavica, cordifolia, hallii, linaria, incarnata, syriaca și viridis) au fost obținute comercial sau colectate în câmp. Semințele au fost tratate cu înălbitor de uz casnic (5%) timp de 5 minute, tăiate și stratificate la rece timp de 7 zile. După germinare la 28 ° C, răsadurile au fost plantate în ghivece de 500 ml umplute cu sol de ghiveci (Metro-Mix; Sun Gro Horticulture, Canada CM Ltd, Vancouver, Canada). Plantele au fost fertilizate (NPK 21: 5: 20, 150 ppm N) după 10 și după 20 de zile și udate după cum este necesar. Plantele (fără înflorire) au fost folosite pentru experimente după patru până la șapte săptămâni de creștere într-o cameră de intrare în mediu controlat (14: 10 h ciclu zi/noapte, 400 microeineine m −2 s −1 de lumină, 27 ° C/24 ° C). Locațiile spațiale ale plantelor au fost randomizate în cameră.
(c) Experiment de creștere Caterpillar
Pentru a testa efectele cardenolidelor asupra creșterii omidelor, omizi nou-născuți din cele trei specii au fost transferate individual către plantele Asclepias (adică o plantă a primit o singură omidă). După 3 și 5 zile în camera de mediu în aceleași condiții ca și cele utilizate pentru creșterea plantelor, greutățile corpului omidă au fost înregistrate folosind un microechilibru (AT21 Comparator, Mettler Toledo, Columbus, OH, SUA). După cântărire, omizile au fost reaplicate la plantele originale. De asemenea, în ziua a cincea, au fost prelevate probe de frunze pentru analiza cardenolidelor și omizi de pe plante au fost plasate în cuști într-un manșon de plasă. Omizile au rămas pe plante până când au ajuns la a patra sau a cincea etapă. Pentru evaluarea creșterii omidelor (5 zile), omizile au fost ținute pe o singură plantă și în niciun caz nu s-a consumat mai mult de 50% din frunziș. Ulterior, plantele au fost înlocuite cu plante proaspete din aceeași specie, dacă este necesar. În total, au fost efectuate cinci blocuri ale experimentului de creștere a omidelor. În fiecare bloc, au fost utilizate toate cele opt specii de Asclepias. Consultați materialul suplimentar electronic, tabelul S1, pentru numărul de greutăți pe șenile obținute pe bloc. Mărimile probelor pentru fiecare combinație de specii de insecte și plante sunt enumerate în materialul suplimentar electronic, tabelul S2.
(d) Prelevarea de hemolimfe
Pentru a evalua sechestrarea cardenolidelor în cavitatea corpului, am examinat hemolimfa larvară de la toate cele trei specii de omizi, obținute din hrănirea larvelor de 4 sau 5 (ultim) instar prin tăierea unuia sau a două tentacule (prima pereche). Un volum definit de hemolimfă (5–80 µl, cu 77% din probe între 20 și 70 (l) a fost pipetat în 200 µl de metanol în 1,5 ml tuburi Eppendorf, probele au fost amestecate (vortex) și ulterior centrifugate la 20 000 g timp de 3 min pentru a precipita proteina hemolimfă. Supernatantele au fost transferate în flacoane cu capac cu șurub de 2 ml și depozitate la -20 ° C până la prelucrarea ulterioară. După prelevarea de hemolimfe, omizile au fost înghețate, depozitate la -80 ° C și în cele din urmă liofilizate.
(e) Pregătirea probelor de hemolimfă pentru aplicare pe Na +/K + -ATPaza
Supernatantele (vezi mai sus) au fost uscate într-un concentrator sub vid și reziduurile au fost dizolvate în 200 (l de metanol. După tratarea probelor timp de 10 min într-o baie cu ultrasunete și centrifugare (3 min la 5000g) supernatanții au fost transferați în tuburi proaspete. Un echivalent de 10 µl (D. gilippus și D. plexippus) sau 5 µl (E. core) hemolimfă a fost îndepărtat și uscat într-un tub proaspăt (restul probei originale a fost, de asemenea, uscat pentru analiza cromatografiei lichide de înaltă performanță ). Reziduul uscat a fost dizolvat în 20 ui (D. gilippus și D. plexippus) sau 10 ui (E. core) DMSO (dimetil sulfoxid) prin vortexare și tratare timp de 10 minute într-o baie cu ultrasunete. Ulterior, probele au fost amestecate cu 180 pl sau 90 pl H2O pentru a obține o concentrație finală de 10% DMSO. Probele au fost depozitate la -20 ° C până la aplicarea pe Na +/K + -ATPase.
(f) Analize Na +/K + -ATPase
Testele Na +/K + -ATPase au fost efectuate așa cum este descris în [12]. În loc de soluții de ouabain [12], s-au aplicat probe de hemolimfă omidă pe Na +/K + -ATPaza nucleului E. și pe Na +/K + -ATPaza speciei donatoare (de exemplu, hemolimfa D. gilippus pe D. gilippus Na +/K + -ATPase) și paralel (pe aceeași placă cu 96 de godeuri). Eșantioanele de hemolimfă obținute de la omizi E. core au fost aplicate numai pe Na +/K + -ATPase E. core. Pentru detalii despre testele Na +/K + -ATPase, consultați materialul suplimentar electronic. Numărul de probe de hemolimfă care au fost aplicate pe Na +/K + -ATPase sunt enumerate în materialul suplimentar electronic, tabelul S2.
(g) Pregătirea probelor de hemolimfă pentru cromatografie lichidă de înaltă performanță
Extractele de hemolimfă din metanol (vezi mai sus) au fost uscate într-un concentrator sub vid; S-au adăugat 60 pl sau 80 pl metanol conținând 0,1 mg ml -1 digitoxină (Sigma, St Louis, MO, SUA) ca standard intern și probele au fost incubate timp de 10 minute într-o baie cu ultrasunete. Probele au fost centrifugate pentru îndepărtarea materiei nedizolvate și transferate în inserții de sticlă cu flacoane de 1,8 ml cromatografie lichidă de înaltă performanță (HPLC) și supuse analizei HPLC. Vezi materialul suplimentar electronic, tabelul S2, pentru numărul de probe de hemolimfă analizate.
(h) Pregătirea bolusului alimentar și a probelor de corp de omidă pentru cromatografie lichidă de înaltă performanță
Țesuturile corpului plus tegumentul, epiteliul intestinului mediu (inclusiv musculatura subiacentă) și bolusul alimentar (conținutul intestinal) au fost colectate de la omizi liofilizate (un subset de omizi care au fost folosite pentru prelevarea de hemolimfe anterior, vezi mai sus) și disecate sub un stereomicroscop (vezi materialul suplimentar electronic, figura S1). Probele au fost omogenizate, extrase în metanol conținând digitoxină ca standard intern și supuse analizei HPLC. Detalii despre dimensiunile și pregătirea eșantionului sunt date în materialul suplimentar electronic.
(i) Pregătirea probelor de plante pentru analiza cardenolidelor
Probele de frunze (de obicei două frunze complet expandate pe plantă, mai multe frunze asemănătoare acelor de A. linaria) prelevate în a cincea zi a experimentului au fost uscate la cuptor (50 ° C) în plicuri de monede timp de câteva zile și depozitate ulterior sub conditii ambientale. După măcinare, probele au fost extrase cu metanol (conținând digitoxină ca standard intern) și analizate prin HPLC. Detalii despre prelucrarea eșantionului sunt descrise în materialul suplimentar electronic. Numărul total de replici a fost A. incarnata = 13, A. syriaca = 13, A. hallii = 14, A. cordifolia = 15, A. viridis = 13, A. curassavica = 14, A. linaria = 9 și A. asperula = 12.
(j) Analiza cromatografiei lichide de înaltă performanță a probelor
Cincisprezece microlitri de extract au fost injectați într-o HPLC din seria Agilent 1100 și compușii au fost separați pe o coloană de fază inversă Gemini C18 (3 μm, 150 × 4,6 mm, Phenomenex, Torrance, CA, SUA). Cardenolidele au fost eluate pe un debit constant de 0,7 ml min -1 cu un gradient acetonitril - H2O după cum urmează: 0-2 min 16% acetonitril, 25 min 70% acetonitril, 30 min 95% acetonitril, 35 min 95% acetonitril, 10 min recondiționarea la 16% acetonitril. Spectrele de absorbție UV au fost înregistrate de la 200 la 400 nm printr-un detector cu diode. Vârfurile cu absorbție maximă simetrică între 216 și 222 nm au fost înregistrate ca cardenolide și cuantificate la 218 nm [31]. Concentrațiile au fost calculate pe baza zonei de vârf a concentrației cunoscute de digitoxină. Detalii despre evaluarea probelor de plante, hemolimfă și bolus alimentar sunt date în materialul electronic suplimentar.
(k) Experimente de disc frunze
(l) Experiment de injecție
Pentru a testa efectele fiziologice ale introducerii cardenolidelor în cavitatea corpului, omizile din stadiul 3 sau 4 din E. core și D. plexippus au fost injectate cu ouabain de cardenolidă dizolvat în apă (10 -2 M) sau cu apă pură ca martor. Numărul de replici a fost: E. miez injectat cu H2O (n = 8) sau ouabain (n = 13); D. plexippus injectat cu H2O (n = 7) sau ouabain (n = 11). Înainte de injectare, omizile au fost anesteziate pe gheață timp de aproximativ 5 minute. Ulterior, fie 2 Hl H2O, fie soluție de ouabain au fost injectate în vasul dorsal abdominal sub un stereomicroscop folosind un ac de calibru 34 atașat la o seringă de 25 pl (Hamilton, Reno, NV, SUA). După injectare, omizile au fost ținute în cupe de plastic cu o bucată de țesut și furnizate cu o bucată dintr-o frunză de Asclepias. A doua zi, omizile au fost inspectate pentru recuperare, măsurate prin activitatea de hrănire.
(m) Analiza statistică
Toate datele au fost analizate folosind o abordare generalizată a celor mai mici pătrate în JMP P ro, v. 10.0 (Institutul SAS, Cary, NC, SUA). Datele au fost verificate pentru normalitatea reziduurilor pentru analize ale varianței și corelațiilor. Datele din experimentul cu disc frunze au fost analizate folosind o abordare ANCOVA (JMP) sugerată de Raubenheimer & Simpson [32]; masa inițială de omidă și biomasa vegetală consumată au fost folosite ca covariabile cu tratamentul cu cardenolide ca variabilă independentă. Nu am găsit interacțiuni între tratament și covariabile și, prin urmare, am eliminat termenii de interacțiune din analiză. Montarea curbei neliniare pentru testul activității Na +/K + -ATPase a fost efectuată cu O rigin -P ro 9.1.0 (Originlab Corporation, Northampton, MA, SUA) utilizând o funcție logistică cu patru parametri (asimptotă de sus setată la 100, jos asimptotă setată la 0).
3. Rezultate si discutii
(a) Creșterea omidelor fluture de lapte nu este afectată de cardenolide
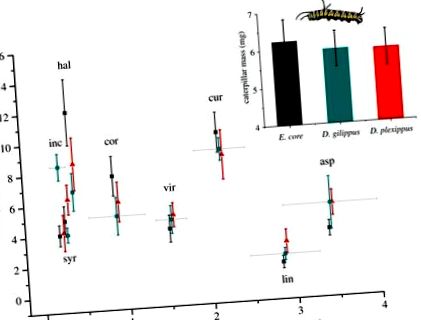
Greutatea omidă după 3 zile pe opt specii de lapte. Omizi de miez Euploea (gri, pătrate), Danaus gilippus (albastru, cercuri) și D. plexippus (roșu, triunghiuri) au fost crescuți din eclozare pe opt specii de Asclepias. Concentrațiile medii de cardenolide (± s.e.) În frunze sunt prezentate pe axa x. Coduri specii: inc, Asclepias incarnata; brânză, A. syriaca; hal, A. hallii; cor, A. cordifolia; vir, A. viridis; cur, A. curassavica; lin, A. linaria; asp, A. asperula. Inserție: masa medie de omidă (± s.e.) nu a fost diferită între cele trei specii de omide. (Versiune online color.)
În al doilea rând, masa omidă nu a diferit între cele trei specii de omide (F2,18 = 0,028, p = 0,973; figura 1, inserată), indicând faptul că diferențele de rezistență la Na +/K + -ATPază nu au fost reflectate în creșterea omidelor, chiar și la plantele cu cele mai mari concentrații de cardenolide (termen de interacțiune între conținutul de cardenolide de plante și speciile de omizi: F2,18 = 0,169, p = 0,846). Când se iau în considerare fiecare specie de plantă separat, omizile au avut mase diferite doar pe A. incarnata, care a fost cea mai mică specie de plante cardenolide (F2,19 = 7.525, p = 0.004); masele larvare la toate celelalte specii de plante nu au fost semnificativ diferite. În cele din urmă, nu am găsit nici o toxicitate a cardenolidelor izolate atunci când au fost alimentate cu nucleul E. (tratament: F2,34 = 0,952, p = 0,396; masa inițială a omidiei: F1,35 = 15,743, p figura 2), demonstrând că Na +/K + -Nu sunt necesare substituții ATPase pentru a proteja omizile de efectele toxice ale cardenolidelor dietetice.
- Cum să crească și să aibă grijă de planta de lapte comun
- Dieta Plant Paradox ne face să ne speriem de mâncarea sănătoasă Bine Bine
- Zona de sănătate - Profesioniști în sănătate pe bază de plante din Marea Britanie
- Veganismul este legat de tulburările alimentare The Washington Post
- Healthful Fats The Skinny on Unrefined Plant Ules - Today s Dietitian Magazine