Abstract
Introducere
În domeniul medicinii, termenul de dependență se aplică numai drogurilor abuzive, cum ar fi alcoolul și cocaina. Deși conceptul de dependență de alimente a primit o atenție considerabilă din partea mass-media populare în ultimii ani, nu există de fapt un diagnostic pentru dependența de alimente în știința medicală. Spre deosebire de dependența de droguri de abuz, se știe mult mai puțin despre consecințele comportamentale și neurobiologice ale expunerii repetate la alimente foarte gustabile. Având în vedere cerința de hrană pentru viață, multe dezbateri s-au concentrat pe definirea termenului de dependență alimentară. În scopul acestei discuții, folosim o definiție simplificată, dar utilă a dependenței de alimente ca „o pierdere a controlului asupra consumului de alimente”. [Pentru o discuție completă despre definiția dependenței de alimente, cititorul este îndreptat către o revizuire excelentă de către Rogers și Smit (1).] Folosind drogurile abuzului ca model, comparăm reglarea neuronală a consumului de alimente cu consumul de droguri și discutăm potențialul ca alimentele să fie considerate dependente.
Aspecte hedonice ale dependenței de substanțe și ale consumului de alimente
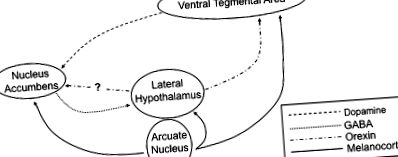
Dovezi considerabile la rozătoare și la oameni susțin acum teoria că atât drogurile abuzive, cât și consumul de alimente foarte gustabile converg pe o cale comună în cadrul sistemului limbic pentru a media comportamente motivate (2,3). O mare parte din această lucrare s-a concentrat pe calea dopaminei mezolimbice, deoarece toate medicamentele obișnuite de abuz cresc semnalizarea dopaminei de la terminalele nervoase originare din zona tegmentală ventrală (VTA) 5 către neuronii din nucleul accumbens (numit și striatul ventral) ( FIG. 1 ). Se crede că creșterea transmisiei dopaminergice are loc fie prin acțiune directă asupra neuronilor dopaminergici (stimulente, nicotină), fie indirect prin inhibarea interneuronilor GABAergici în VTA (alcool, opiacee) (2,3). De asemenea, implicat în activarea mediatorului activării neuronilor dopaminergici VTA este neurotransmițătorul peptidic orexin, care este exprimat de o populație de neuroni hipotalamici laterali care inervează în mare parte creierul, inclusiv VTA (4-6).
Reprezentarea schematică a circuitelor neuronale care reglează hrănirea. Neuronii dopaminergici originari din proiectul VTA către neuroni din nucleul accumbens al striatului ventral. Hipotalamusul lateral primește intrări din proiecțiile GABAergic din nucleul accumbens, precum și din neuronii melanocortinergici din Arcul hipotalamusului. În plus, receptorii melanocortinei se găsesc și pe neuronii din VTA și din nucleul accumbens.
Recompensele naturale, cum ar fi alimentele, stimulează răspunsuri similare în calea dopaminei mezolimbice. Prezentarea alimentelor foarte gustabile induce eliberarea puternică de dopamină în nucleul accumbens (3). Se consideră că această eliberare de dopamină coordonează multe aspecte ale încercărilor unui animal de a obține recompense alimentare, inclusiv excitare crescută, activare psihomotorie și învățare condiționată (amintind de stimuli asociați alimentelor). Mecanismul prin care alimentele stimulează semnalizarea dopaminei este neclar; cu toate acestea, se pare că receptorii gustativi nu sunt necesari, deoarece șoarecii lipsiți de receptori dulci sunt încă capabili să dezvolte o preferință puternică pentru soluțiile de zaharoză (7). O posibilitate este că neuronii orexin pot fi activați în timpul hrănirii, cu eliberarea consecventă de orexin stimulând direct neuronii dopaminergici VTA (8).
S-a confirmat recent importanța căii dopaminei mezolimbice în bolile umane. Stoeckel și colab. a raportat că la femeile cu greutate normală, imaginile cu alimente dense în energie au stimulat o creștere semnificativă a activității caudatului dorsal, o regiune a striatului dorsal. În schimb, femeile obeze care au prezentat imagini cu alimente cu conținut ridicat de energie au demonstrat o activare crescută în mai multe regiuni limbice, inclusiv cortexurile orbitofrontale și prefrontale, amigdala, striatul dorsal și ventral, insula, cortexul cingulat anterior și hipocampul (9). Această diferență de activare sugerează că indivizii obezi pot avea o evaluare modificată a recompensei alimentare, rezultând o motivație aberantă de a consuma alimente cu conținut ridicat de energie.
Așa cum ar fi de așteptat, activarea prelungită a sistemului limbic de către droguri de abuz duce la adaptări celulare și moleculare care servesc parțial la menținerea homeostaziei în semnalizarea dopaminei (2). În cadrul neuronilor dopaminergici ai VTA, utilizarea cronică a medicamentelor este asociată cu scăderea secreției bazale de dopamină, scăderea dimensiunii neuronale și a activității crescute a tirozinei hidroxilazei (enzima care limitează rata în biosinteza dopaminei) și a factorului de transcripție, proteina de legare a elementului de răspuns AMP ciclic (CREB) (2.10). În cadrul neuronilor țintă din striat, consumul cronic de droguri crește nivelurile de CREB, precum și cele ale unui alt factor de transcripție, deltaFosB, ambele modificând răspunsul neuronal la semnalizarea dopaminei (2). Se consideră că aceste adaptări sunt importante pentru motivația aberantă de a obține droguri de abuz observate la pacienții dependenți. De exemplu, creșterea nivelului deltaFosB în striat crește sensibilitatea la efectele satisfăcătoare ale drogurilor abuzive, cum ar fi cocaina și morfina și crește motivația stimulativă pentru a le obține (2).
Modificări celulare și moleculare similare au fost descrise la rozătoarele expuse la alimente foarte gustabile. Șoarecii expuși la o dietă bogată în grăsimi timp de 4 săptămâni și apoi retrași brusc la o dietă semipurificată mai puțin plăcută au prezentat niveluri scăzute de CREB activ în striat până la 1 săptămână după schimbare (11). Aceste descoperiri sunt în concordanță cu lucrările lui Barrot și colab. (12) care au raportat că scăderea activității CREB în striatul ventral crește preferința atât pentru o soluție de zaharoză (o recompensă naturală), cât și pentru morfină, un medicament de abuz bine caracterizat. În plus, șoarecii expuși la 4 săptămâni de dietă bogată în grăsimi au prezentat o creștere semnificativă a nivelului de deltaFosB în nucleul accumbens (11), similar cu modificările observate după expunerea la droguri de abuz (2). În plus, expresia crescută a deltaFosB în această regiune a creierului îmbunătățește răspunsul operantului întărit alimentar, demonstrând un rol clar pentru deltaFosB în creșterea motivației de a obține recompense alimentare (13). Luate împreună, aceste studii demonstrează că regiunile limbice experimentează neuroadaptări similare după expunerea atât la recompense alimentare, cât și la medicamente și că aceste adaptări modifică motivația pentru a obține ambele tipuri de recompense.
Aspecte homeostatice ale consumului de alimente
Spre deosebire de aspectele hedonice ale hrănirii, care se concentrează pe recompensa asociată consumului de alimente, controlul homeostatic al hrănirii se referă în primul rând la reglarea echilibrului energetic. Cea mai mare parte a acestei lucrări s-a concentrat pe hormoni circulanți care transmit informații despre nivelurile de energie periferică către creier. Doi dintre cei mai importanți hormoni periferici sunt leptina și grelina. Leptina este sintetizată de țesutul adipos alb, iar nivelul său crește proporțional cu masa grasă. Printre numeroasele sale acțiuni, nivelurile ridicate de leptină suprimă puternic consumul de alimente și stimulează procesele metabolice pentru a disipa depozitele excesive de energie (14). În schimb, grelina este o peptidă derivată din stomac al cărei nivel crește ca răspuns la echilibrul energetic negativ și stimulează aportul de alimente și stocarea de energie (14).
Deși receptorii pentru leptină și grelină sunt exprimați pe scară largă în tot corpul și sistemul nervos central, nucleul arcuit (Arc) al hipotalamusului este un loc de o importanță deosebită, având în vedere rolul său bine cunoscut în reglarea hrănirii și a metabolismului (15). În cadrul Arcului, receptorii leptinei sunt exprimați pe 2 subseturi distincte de neuroni (Fig. 1). Primul exprimă neurotransmițătorul peptidic pro-opiomelanocortină (POMC) și transcriptul reglementat de cocaină-amfetamină (CART). Semnalizarea receptorilor de leptină stimulează activitatea neuronilor POMC/CART și suprimă hrănirea în timp ce crește rata metabolică. În al doilea rând, activarea receptorului de leptină inhibă un al doilea set de neuroni, care exprimă neuropeptida Y (NPY) și peptida legată de agouti (AgRP); acești neuroni cresc în mod normal aportul alimentar. Astfel, neuronii POMC/CART și neuronii NPY/AgRP exercită efecte opuse asupra consumului de alimente și consumului de energie. În acest mod, leptina este un puternic supresor al hrănirii prin stimularea neuronilor anorexigenici POMC/CART, în timp ce inhibă reciproc acțiunea neuronilor proappetite NPY/AgRP (15). În contrast, receptorii de grelină sunt exprimați în principal pe neuronii NPY/AgRP din Arc; activarea semnalizării cu grelină stimulează acești neuroni și promovează comportamentul de hrănire (14).
Efectul stresului asupra hrănirii
- Impactul poftei de mâncare și al aportului de calorii asupra indicelui de masă corporală (IMC) se modifică în decurs de 18 luni
- Cunoașterea aportului recomandat de calorii și influența caloriilor asupra selecției alimentelor în rândul canadienilor
- Strategiile de hrănire maternă și aportul alimentar al copilului având în vedere greutatea și influențele demografice
- Cum să vă înregistrați consumul de alimente cu MyFitnessPal - Partajarea elementelor de bază Cetățean digital
- Junk Food Aproape jumătate din copii; Aport de calorii - ABC News