Date asociate
Abstract
Interacțiunea funcțională raportată recent între canalul anionic dependent de tensiune al membranei mitocondriale externe, VDAC și tubulina dimerică a fost observată ca un blocaj al canalului reversibil. Folosind partiționarea poli- (etilen glicolului) de diferite greutăți moleculare și măsurători de inversare a potențialului, vom testa dimensiunea și selectivitatea ionică a stărilor complet deschise și blocate de tubulină ale VDAC reconstituite în straturi de lipide planare. În timp ce raza efectivă a canalului scade doar cu un factor de 1,34 ± 0,15, selectivitatea se inversează de la inițial anionic la cationic. Măsurând direct partiționarea ATP, demonstrăm că aceste modificări interzic accesul ATP în canal în starea sa blocată cu tubulină.
1. Introducere
Una dintre cele mai abundente proteine din citosolul majorității celulelor eucariote, tubulina dimerică, sa dovedit recent a fi un inhibitor puternic al canalului anionic dependent de tensiune al membranei mitocondriale exterioare, VDAC [1, 2]. Interacțiunea tubulină-VDAC este văzută ca tranziții reversibile ale canalului, reconstituite în membrane lipidice plane, între stările sale deschise și blocate de tubulină. Inhibarea este foarte sensibilă la tensiune și, în funcție de potențialul membranei externe mitocondriale, ar putea necesita concentrații micro-molare până la nano-molare de tubulină. Experimentele cu mitocondrii izolate sugerează că interacțiunea VDAC-tubulină este importantă din punct de vedere funcțional în reglarea respirației mitocondriale [2, 3]. Starea blocată cu tubulină este încă extrem de conductivă la ioni (aproximativ 40% din conductanța în stare deschisă în 1 M KCl), ceea ce poate implica faptul că inhibarea VDAC de către tubulină este limitată de valoarea acestei conductanțe reziduale. Cu toate acestea, se crede că rolul major al VDAC este reglarea schimbului de ATP/ADP [4-6] și nu fluxul de ioni mici, deci ceea ce este cu adevărat important este efectul blocării tubulinei asupra transportului nucleotidic.
Există o listă lungă de diferiți compuși care afectează tensiunea VDAC (vezi [4, 5, 7]) în care polianionii, cum ar fi polianionul Konig și sulfatul de dextran, sunt cei mai puternici inhibitori ai VDAC [8, 9]. În special, s-a demonstrat că polianionul lui Konig inhibă transportul de nucleotide adeninice în mitocondriile izolate [8] și celule [10]. Cu toate acestea, acțiunea de reglementare a tubulinei a fost recunoscută doar foarte recent [2, 11]. Pentru a înțelege semnificația funcțională a interacțiunii VDAC-tubulină, investigăm proprietățile biofizice majore ale stării blocate de tubulină.
În prezentul studiu aplicăm trei abordări pentru a evalua caracteristicile funcționale ale stării blocate. Mai întâi estimăm schimbarea razei caracteristice a VDAC la blocarea acestuia de către tubulină folosind partiționarea polimerului în canal [12, 13] în ambele state. O listă exhaustivă de referință referitoare la această abordare poate fi găsită într-o publicație recentă din laboratorul nostru [14]. Esența abordării este de a analiza pătrunderea poli (etilen glicolului) de dimensiuni diferite, PEG, în canalul porilor umpluți cu apă prin măsurarea conductanței sale în prezența acestor polimeri. Conductanța canalului răspunde diferit la PEG-uri cu greutate moleculară diferită, cu polimeri care sunt suficient de mici pentru a se împărți în por, reducându-i conductanța într-un mod dependent de greutate. Pe baza greutății moleculare caracteristice a polimerului care separă partiția de excludere, concluzionăm că aria secțiunii transversale efective a canalului este redusă cu un factor de doi ca urmare a blocării.
În al doilea rând, analizăm schimbarea indusă de blocaj în selectivitatea canalului de ioni mici la concentrații de sare apropiate de fiziologice. Arătăm că selectivitatea canalului își inversează semnul: de la selectivitatea predominant anionică în stare deschisă trece la selectivitatea cationică în cea blocată cu tubulină.
În al treilea rând, estimăm partiția ATP atât în canal deschis, cât și în canalul blocat cu tubulină. Constatăm că, în timp ce în stare deschisă, adăugarea de ATP reduce conductanța canalului, nu schimbă conductanța stării blocate cu tubulină. Concluzionăm că ATP electrostatic și, cel puțin parțial steric, este exclus din starea blocată de tubulină a VDAC.
2. Materiale și metode
A fost descrisă anterior procedura de reconstituire a VDAC în straturi bistrat lipidice [2, 15]. Straturile biliare s-au format din difitanil fosfatidilcolină (Avanti Polar Lipids, Inc. Alabaster, AL). Dacă nu se specifică altfel, s-au utilizat soluții apoase 1 M de KCl tamponate cu 5 mM Hepes la pH 7,4. Potențialul este definit ca pozitiv atunci când este mai mare la partea adiției VDAC (partea cis). După introducerea canalelor VDAC, tubulina a fost adăugată pe ambele părți ale membranei sub agitare constantă timp de 2 minute. Consecutiv, poli (etilen glicol) de diferite greutăți moleculare (Sigma) au fost adăugați la concentrația finală de 15% (greutate/greutate). Soluția de ATP (Sigma) în KM 1 M și pH ajustat la 7,4 au fost introduse în compartimentele camerei prin perfuzie. Curenții au fost înregistrați și analizați conform descrierii anterioare [2] (a se vedea, de asemenea, Material suplimentar).
3. Rezultate si discutii
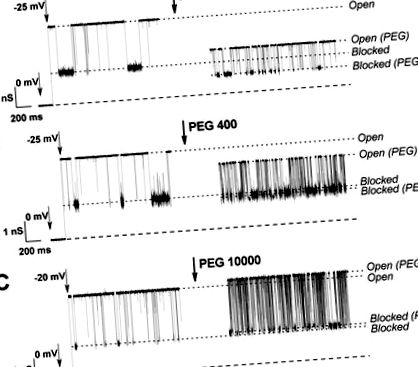
Efectul PEG a trei greutăți moleculare diferite asupra stărilor deschise și blocate de tubulină VDAC este prezentat în Figura 1. În prezența PEG 106 (Fig. 1A), conductanțele ambelor stări sunt reduse prin adăugarea polimerului. Acest lucru este legat de partiționarea polimerului în canalul porilor, care deplasează ionii și crește vâscozitatea soluției (Fig. 1, linii punctate Deschis și Deschis (PEG)). Conductanța stării blocate cu tubulină este, de asemenea, scăzută în mod semnificativ în prezența PEG 106, dar într-un grad mult mai mic de PEG 400 (Fig. 1A, B, linii punctate Blocate și Blocate (PEG)), sugerând că este prea îngust pentru ca moleculele PEG 400 să se împartă semnificativ. În cazul PEG 10000 (Fig. 1C), stările deschise și blocate cu tubulină arată o oarecare creștere a conductanței, ceea ce înseamnă că acest polimer este efectiv exclus din ambele stări ale canalului. De asemenea, este de remarcat faptul că PEG crește interacțiunea dintre tubulină și VDAC, ducând la evenimente de blocaj mai frecvente.
Urme de curent de ioni prin canale VDAC unice în prezența tubulinei de 10 nM modificate prin adăugarea de PEG 106, PEG 400 și PEG 10000. Urme din stânga: blocarea canalelor de către tubulină în soluție fără polimeri; urmele corecte: efectul adaosului PEG asupra stărilor conductoare ale canalului. Soluția de scăldat cu membrană conține KCl 1 M cu 5 mM HEPES, pH 7,4. Liniile întrerupte din partea de jos indică curent zero. Înregistrările au fost filtrate digital la 1 kHz folosind algoritmul Bessel.
Figura 2 rezumă experimentele de partiționare a polimerului interpolate la tensiune zero. În ambele stări, deschise și blocate cu tubulină, raportul crește de la o valoare apropiată de raportul conductivităților soluției modificate prin adăugarea polimerului (linia dreaptă întreruptă la aproximativ 0,6) la o valoare care este puțin peste 1,0. Punctele de date pentru starea blocată cu tubulină sunt deplasate spre stânga, în direcția unor greutăți moleculare polimerice mai mici. Acest lucru sugerează că dimensiunea caracteristică a stării blocate este mai mică, deoarece este capabilă să excludă polimerii mai eficient.
Modificările relative ale conductanței VDAC induse prin adăugarea de 15% (greutate/greutate) PEG cu greutate moleculară diferită. Raportul dintre conductanța canalului în prezența unui PEG particular și conductanța acestuia în soluție fără polimeri este reprezentat grafic în funcție de greutatea moleculară PEG. Triunghiurile și cercurile corespund stărilor deschise și respectiv blocate cu tubulină ale VDAC. Linia punctată la 0,6 corespunde raportului dintre conductivitățile solutiei în vrac cu și fără polimeri. Liniile solide prin datele experimentale reprezintă cele mai bune potriviri folosind ecuația. (1).
Pentru a cuantifica partiționarea, folosim abordarea [13] prezentată în detaliu suficient într-o publicație recentă [14]. Aplicăm următoarea formulă empirică pentru a se potrivi datelor:
unde g (w)/gnoPEG este raportul dintre conductanța canalului în prezența PEG cu greutate moleculară w și conductanța sa în soluție fără polimeri și χ este parametrul care caracterizează amplitudinea relativă a schimbării conductanței canalului între regimuri de excludere completă, g (w) max și penetrare completă, g (w) min:
Alegând g (w) max/gno PEG = 1,07 și g (w) min/gno PEG = 0,54 pentru a ține cont de comportamentul conductanței la cele mai mari și mai mici greutăți moleculare ale polimerului, ne potrivim ecuației. (1) la datele experimentale pentru a obține greutatea caracteristică a polimerului w0 care separă regimurile de penetrare și excludere a polimerului și parametrul α care caracterizează claritatea tranziției dintre cele două regimuri.
Se crede că reglarea fluxurilor de ATP/ADP este funcția majoră a VDAC [4, 5]. Deoarece la concentrații fiziologice de sare ATP este un anion cu mai multe încărcări, este important să se caracterizeze selectivitatea ionică a stării blocate VDAC în condiții de sare apropiate de cele de relevanță fiziologică. Aici am folosit 150 mM vs. Gradient de 50 mM de KCl pentru a determina potențialele de inversare ale stărilor deschise și blocate ale canalului (Figura 3). Așa cum era de așteptat, tensiunile corespunzătoare curentului zero la acest gradient de concentrație KCl, așa-numitele potențiale de inversare, sunt diferite pentru stările deschise și blocate de tubulină. Ele sunt 15,5 mV și −13,7 mV, în mod corespunzător, ceea ce înseamnă că selectivitatea canalului este inversată de la t + = 0,2, t - = 0,8 (unde t + și t - sunt numere de transport cationice și anionice, vezi Material suplimentar) în stare deschisă favorizând anioni, până la t + = 0,75, t - = 0,25 în starea blocată cu tubulină favorizând cationii.
Relațiile curent-tensiune pentru un singur canal în stările deschise (triunghiuri) și tubuline blocate (cercuri) într-o membrană care separă soluțiile KCl de 150 mM (cis) și 50 mM (trans) (2 mM HEPES, pH 7,4). Blocarea VDAC de către tubulină inversează selectivitatea anionică originală a canalului către cel cationic, după cum se dovedește prin schimbarea semnului potențialului de inversare.
Conform modelului propus [1, 2], blocarea VDAC de către tubulină este interpretată ca penetrarea uneia dintre cozile C-terminale încărcate negativ (CTT) în porul net pozitiv VDAC. Dovezi experimentale care susțin acest model sunt că tubulina cu CTT trunchiat nu blochează VDAC [2]. Coada încărcată negativ deplasează echilibrul sarcinilor din porul VDAC către sarcina netă negativă, ceea ce explică ușoara selectivitate cationică a stării blocate de tubulină. Trebuie remarcat faptul că această inversare a selectivității este analogă cu cea observată la tranziția canalului la stările închise induse de tensiune [9, 21], dar, similar cu conductanța, este bine definită și nu arată variabilitatea inerentă pentru închisele induse de tensiune. stări. Comparația acestor proprietăți ale stărilor închise induse de tensiune și a stării blocate cu tubulină favorizează modelul de bloc de permeație CTT peste porțiunea de tensiune îmbunătățită a tubulinei.
O mare parte din cercetările recente privind canalele „largi” (vezi Ref. [22-24] și referințele de aici) demonstrează că selectivitatea lor ionică este în mare parte de origine electrostatică. Prin urmare, schimbarea selectivității canalului ar trebui să fie mult mai pronunțată pentru ATP cu mai multe sarcini decât pentru anionul clorură încărcat individual. Luate împreună cu obstacolul steric suplimentar în starea blocată, descoperirile noastre sugerează că starea blocată cu tubulină ar trebui să fie practic impermeabilă pentru ATP.
Pentru a susține această afirmație, am efectuat măsurători directe ale partiționării ATP în VDAC, urmând abordarea descrisă anterior [15, 25]. S-a arătat că ATP adăugat la soluția de scăldat cu membrană de NaCl 1 M a scăzut conductivitatea sa specifică, dar, datorită legării ATP la porul VDAC, a redus conductanța canalului într-un grad mai mare [15]. Pentru a verifica dacă acest lucru ar fi cazul cu starea blocată de tubulină, am măsurat conductanța canalului în prezența atât a tubulinei, cât și a ATP. Rezultatele prezentate în Figura 4 demonstrează că o scădere măsurabilă a conductanței este observată numai pentru starea deschisă a canalului. Efectul este oarecum mai mic decât cel raportat anterior pentru VDAC de altă origine (Neurospora crassa) [15], dar este într-un acord calitativ cu constatările anterioare. Adăugarea simetrică de 100 mM ATP scade conductanța canalului în stare deschisă cu aproximativ 10%, dar, în acuratețea măsurătorilor noastre, nu modifică conductanța stării blocate de tubulină. Acest lucru sugerează că ATP este exclus din starea blocată, susținând astfel argumentele noastre bazate pe modificări ale razei canalului și selectivității ionilor mici.
Efectul adăugării de 100 mM ATP asupra conductanței VDAC în stări deschise și blocate cu tubulină. Cele trei grupuri superioare de puncte de date arată că adăugarea la ATP reduce conductanța stării deschise datorită partiționării ATP în canal [15, 25]. Trei grupuri inferioare de puncte de date demonstrează că starea blocată de tubulină a VDAC nu este afectată de ATP, sugerând că această stare este impermeabilă pentru ATP.
4. Concluzii
Găsim că blocarea VDAC de către tubulină îi scade deschiderea aproximativ cu un factor de doi, astfel cum este probat de PEG de dimensiuni diferite (Fig. (Fig. 1 1 și 2). 2). Și mai important, blocajul inversează selectivitatea anionică a canalului pentru ioni mici cu încărcare individuală în cationic (Fig. 3). Pentru molecula ATP mai încărcată și mai voluminoasă, evaluarea directă a efectului acesteia asupra conductanței canalului în cele două stări (Fig. 4) arată că, în acuratețea măsurătorilor noastre, ATP nu se împarte în starea blocată. Combinate împreună, aceste argumente ne permit să concluzionăm că starea blocată de tubulină a VDAC este practic impermeabilă pentru ATP.
Material suplimentar
Confirmare
Autorii îi mulțumesc lui Kely Sheldon pentru purificarea VDAC. Acest studiu a fost susținut de Programul de cercetare intramurală al Institutului Național de Sănătate și Dezvoltare Umană a Copilului Eunice Kennedy Shriver, NIH.
Lista de abrevieri
| VDAC | canal anionic dependent de tensiune |
| CUIER | polietilen glicol) |
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Program de instruire vizat - Consiliul de achiziții de stat de generația următoare
- Arhivele evreiești din statul Washington - Colecție digitală
- Starea securității alimentare și nutriției în lume 2020 - DATE UNICEF
- Tunderea anvelopei de rezervă Uleiul de canola poate reduce grăsimea abdominală Penn State University
- Dr. Cursul lui Buteyko din 1969 la Universitatea de Stat din Moscova (carte PDF)