Samantha E. Jacobs
1 Divizia de Boli Infecțioase, Weill Cornell Medicine, New York, New York
Deborah Saez-Lacy
2 Brielle obstetrică și ginecologie, Manasquan
Walter Wynkoop
3 Ocean Pulmonary Associates, Brick, New Jersey
Thomas J. Walsh
1 Divizia de Boli Infecțioase, Weill Cornell Medicine, New York, New York
Abstract
Isavuconazolul este un nou triazol care este aprobat pentru terapia primară a aspergilozei invazive. Oferim primul raport al unui pacient cu aspergiloză bronhopulmonară alergică (ABPA) care a fost tratat cu succes cu isavuconazol cu îmbunătățire marcată și efecte adverse minime. Revizuim în continuare literatura cu privire la gestionarea antifungică a ABPA.
Aspergiloza bronhopulmonară alergică (ABPA) rezultă dintr-un răspuns imun local și sistemic anormal exagerat la conidiile și hifele care colonizează tractul sinopulmonar. Aspergiloza bronhopulmonară alergică complică astmul și fibroza chistică la 1% –2% și respectiv 5% –15% dintre pacienți [1]. La pacienții astmatici, ABPA prezintă astm bronsic slab controlat cu respirație șuierătoare, tuse, producție de spută, febră de grad scăzut, scădere în greutate și stare de rău.
Gestionarea aspergilozei bronhopulmonare alergice include corticosteroizi pentru a controla răspunsul imun al gazdei și agenți antifungici pentru a reduce povara organismului. Itraconazolul este în prezent agentul de primă linie pentru pacienții ABPA simptomatici pe baza studiilor clinice randomizate, controlate [2, 3]. Voriconazolul este o alternativă bazată pe date observaționale [4]. Cu toate acestea, atât itraconazolul, cât și voriconazolul sunt asociate cu efecte adverse semnificative.
Isavuconazolul este un triazol antifungic cu spectru larg cu activitate puternică împotriva speciilor Aspergillus. Se recomandă ca terapie primară alternativă pentru sindroamele invazive de aspergiloză în Ghidul Societății Americane pentru Boli Infecțioase din 2016 [5]. Oferim primul raport al unui pacient cu ABPA care a fost tratat cu succes cu isavuconazol după ce a avut simptome persistente și efecte secundare semnificative cu itraconazol și voriconazol.
METODE
Am încercat mai întâi să înțelegem impactul managementului sistemic antifungic asupra ABPA. Prin urmare, am căutat în mod sistematic baza de date PubMed pentru literatura în limba engleză a terapiei antifungice pentru ABPA la pacienții cu astm de bază. Au fost folosiți următorii termeni de căutare: „itraconazol”, „voriconazol”, „posaconazol”, „isavuconazol”, „amfotericină nebulizată B” și „aspergiloză bronhopulmonară alergică”. Raportăm apoi în detaliu cazul indexului nostru.
RAPORT DE CAZ
O femeie de 56 de ani, medic cu astm, a fost văzută într-o consultație în mai 2015 pentru managementul ABPA. Simptomele ei au început în septembrie 2009, când a dezvoltat o boală asemănătoare gripei, cu febră, stare generală de rău, tuse neproductivă și toleranță scăzută la efort. Ea a participat în mod regulat la cursuri de exerciții aerobice, dar a constatat că orice activitate care i-a crescut frecvența respiratorie duce la tuse care „împiedică” exercițiile suplimentare.
În primăvara anului 2010, tusea și respirația șuierătoare s-au înrăutățit și a avut o nouă producție de spută. Un nivel seric al imunoglobulinei (Ig) E a fost de 813 UI/ml, au fost detectați anticorpi IgG serici precipitați la Aspergillus fumigatus, testarea cutanată a Aspergillus a fost pozitivă și o cultură de spută a crescut A fumigatus. O scanare tomografică computerizată (CT) de înaltă rezoluție a toracelui a demonstrat o hiperinflație ușoară a plămânilor bilateral și modificări inflamatorii minime în câmpul pulmonar central stâng. Testele funcției pulmonare (PFT) au evidențiat o boală obstructivă a căilor respiratorii (volum expirator forțat [FEV] 1 2.08L, capacitate vitală forțată [FVC] 3.02L, FEV1/FVC 69%) care nu s-au îmbunătățit după terapia bronhodilatatoare. Pacientul a fost diagnosticat cu ABPA. În octombrie 2010, i s-a prescris prednison 0,5 mg/kg pe zi pe cale orală timp de 1 săptămână, urmată de o conicitate de peste 3 luni. Simptomele ei respiratorii s-au îmbunătățit astfel încât să poată participa la cursuri de gimnastică aerobă. Serul IgE a scăzut la 326 UI/ml. Cu toate acestea, ea nu a putut întrerupe complet corticosteroizii. Culturile de spută au continuat să crească specii de Aspergillus până în iulie 2011. Testele funcției pulmonare au arătat o obstrucție ușoară stabilă.
În anul următor, producția ei cronică de tuse și spută a continuat și a slăbit neintenționat 15 kilograme. A reluat prednisonul cu aproximativ 1 mg/kg în octombrie 2011. În decembrie 2011, a început itraconazolul; cu toate acestea, a dezvoltat urticarie, iar medicamentul a fost întrerupt. A fost apoi tratată cu voriconazol 200 mg pe cale orală de două ori pe zi, iar producția de tuse și spută s-a îmbunătățit semnificativ. Prednisonul a fost apoi conicat și întrerupt. Serul IgE a scăzut de la 663 UI/ml la 384 UI/ml. În martie 2012, a oprit voriconazolul din cauza unei creșteri asimptomatice a alaninei aminotransferazei serice (ALT) la 247 UI/L.
În toamna anului 2012 și iarna 2013, a avut bronșită recurentă și pneumonie din cauza Pseudomonas aeruginosa. O scanare CT de înaltă rezoluție a pieptului a arătat bronșiectazii cilindrice atât în lobii inferiori, cât și în noduli pulmonari bilaterali, multipli și mici. În cadrul segmentului bazal posterior al lobului inferior stâng, s-a observat o opacitate de 5,1 × 4,5 × 2,0 cm. În timpul bronhoscopiei s-a observat spută albă și groasă pe toate căile respiratorii. Cultura lichidului de lavaj bronhoalveolar a crescut speciile Aspergillus, speciile Cladosporium și maltofilia Stenotrophomonas. Datele privind susceptibilitatea antifungică nu au fost disponibile. Pacientul a reluat voriconazol în septembrie 2014 și a avut din nou o îmbunătățire clinică. Nivelurile de IgE au scăzut de la 1583 UI/ml la 787 UI/ml. Testele funcției pulmonare au arătat o obstrucție moderată (FEV1 1,61L, FEV1/FVC 68%). Cu toate acestea, a experimentat fotopsie, iar ALT seric a crescut la peste două ori limita superioară a normalului. Voriconazolul a fost întrerupt în martie 2015. Având în vedere că pacientul nu a putut tolera voriconazolul și a fost îngrijorat de efectele adverse ale corticosteroizilor, ea a prezentat la New York-Presbyterian Hospital/Weill Cornell Medicine pentru un control ulterior.
Antecedente medicale anterioare suplimentare au inclus diabetul indus de corticosteroizi (controlat de dietă), osteopenia și alergiile sezoniere. Medicamentele includ nebulizatoare de N-acetilcisteină, inhalator de sulfat de albuterol, spray nazal de azelastină-fluticazonă, inhalator de beclometazonă, inhalator de budesonidă-formoterol, fexofenadină și montelukast.
La examinarea fizică, semnele vitale nu erau remarcabile. Saturația de oxigen a fost de 96% în timp ce respirați aerul ambiant. Indicele de masă corporală a fost de 17,4 kg/m 2. Șuieratul inspirator și expirator mediu a fost auscultat în câmpurile pulmonare. Restul examenului a fost normal. Nivelul IgE seric a fost de 676 UI/ml. Viteza de sedimentare a eritrocitelor a fost de 20 mm/oră (0-40 mm/oră normală), iar proteina C reactivă a fost de 0,5 mg/L (normală 0,0-4,9 mg/L).
Având în vedere toleranța slabă a pacientului la corticosteroizi (osteopenie și hiperglicemie), voriconazol (fotopsie și aspartat aminotransferază crescută [AST] și ALT) și itraconazol (reacție de hipersensibilitate), i s-a prescris isavuconazol oral 200 mg la fiecare 8 ore × 2 zile, urmat de 200 mg o dată pe zi. Ea a fost instruită să ia isavuconazol în „pulsuri” de 4 luni, astfel încât să atenueze simptomele în timpul exacerbărilor ABPA, reducând în același timp riscul apariției rezistenței. De-a lungul mai multor săptămâni, a observat o îmbunătățire semnificativă a producției sale de expectorație și respirație șuierătoare și a reușit chiar să facă rucsac de 16 mile în iulie 2015. A întrerupt beclometazona și a continuat doar cu budesonid-formoterol. Nivelul IgE seric a rămas crescut la 732 UI/ml. În august 2015, după 10 săptămâni de terapie, a întrerupt izavuconazolul, menționând că toleranța ei la efort a fost cea mai bună din ultimii ani. În general, a tolerat bine izavuconazolul, cu excepția diareei apoase pe care a atribuit-o medicamentului și care a persistat câteva săptămâni după oprirea terapiei. AST și ALT serice au rămas în limite normale.
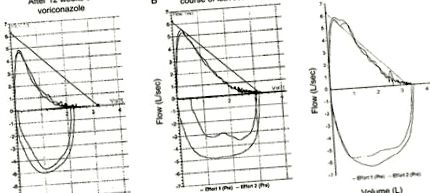
Pacientul a continuat să se simtă bine pe toamna anului 2015 și a fost menținut pe budesonidă-formoterol. La PFT-uri repetate, FEV1 s-a îmbunătățit la 2,42 L, iar FEV1/FVC a fost de 68%. În ianuarie 2016, producția de spută și respirația șuierătoare au crescut, în concordanță cu o exacerbare a ABPA. Pacientul a reluat izavuconazolul în martie 2016 cu aceeași doză de încărcare. Din nou, ea a avut o îmbunătățire simptomatică semnificativă și a participat la 5 excursii de drumeții în primăvară și vară. Ea a oprit isavuconazolul în mai 2016. Testele funcției pulmonare au fost repetate în iulie 2016 și s-au încadrat în limite normale (FEV1 2,43 L, FVC 3,39 L, FEV1/FVC 72%) (Figura 1). Începând cu ianuarie 2017, ea continuă să aibă simptome respiratorii minime și a rămas în afara corticosteroizilor sistemici și a înțărcat corticosteroizii inhalatori la 1 puf de budesonid/formoterol zilnic.
Curbele volumului debitului. (A) Obstrucție moderată a căilor respiratorii în timpul tratamentului cu voriconazol în decembrie 2014 (volum expirator forțat [FEV] 1 1,61L, capacitate vitală forțată [FVC] 2,38 L, FEV1/FVC 68%). (B) Obstrucție ușoară a căilor respiratorii după primul curs de izavuconazol în iulie 2015 (FEV1 2.12L, FVC 3.09L, FEV1/FVC 69%). (C) Curba volumului debitului normal după al doilea curs de izavuconazol în iulie 2016 (FEV1 2,43 L, FVC 3,39 L, FEV1/FVC 72%).
TRECERE ÎN REVISTĂ A LITERATURII DE SPECIALITATE
Am identificat 3 studii clinice randomizate și 16 studii observaționale (7 studii de cohortă observaționale, 1 serie de cazuri și 8 rapoarte de caz) de itraconazol, voriconazol, posaconazol și amfotericină B nebulizată pentru tratamentul ABPA la pacienții cu astm (Tabelul 1).
tabelul 1.
Revizuirea literară selectivă a terapiilor antifungice pentru tratamentul ABPA la pacienții cu astm a
| Jacobs și colab | Raportul de caz actual | N = 1 | Isavuconazol 200 mg 3 ×/zi × 2 zile, apoi 200 mg zilnic | Simptome PFT-uri Biomarkeri Corticosteroizi | o Ameliorare simptomatică o Îmbunătățirea FEV1 și FVC o Reducerea IgE totale o Reducerea corticosteroizilor inhalatori | Diaree |
| De Beule și colab. [11] | Studiu de cohortă observațional prospectiv | N = 5 (din 137 de pacienți cu diferite forme de aspergiloză) | Itraconazol | Simptome Microbiologie | o Ameliorare simptomatică la 4 din 5 pacienți o Sterilizarea culturilor de spută la 3 din 4 pacienți cu creștere a speciilor Aspergillus la momentul inițial | Dintre cohorta totală (N = 137), 18% au avut efecte adverse. Dispepsie, dureri abdominale, greață, diaree, amețeli au fost cele mai frecvente. |
| Denning și colab. [12] | Seria de cazuri | N = 6 (N = 3 cu astm) | Itraconazol 200 mg de două ori pe zi | Simptome Biomarkeri Corticosteroizi | o Ameliorare simptomatică la 3 din 3 pacienți o Reducerea IgE serică cu ≥50% la 2 din 3 pacienți o Reducerea necesității de corticosteroizi la 1 din 3 pacienți | Scăderea libidoului |
| Pacheco și colab. [13] | Raport de caz | N = 1 | Itraconazol 200 mg/zi | Biomarkeri PFT-uri Corticosteroizi | o Reducerea nivelului IgG seric specific Aspergillus o Îmbunătățirea cu FEV1 cu 19% și cu FVC cu 28% o Reducerea necesității de corticosteroizi | Nu este specificat |
| Germaud și Tuchais [14] | Studiu de cohortă observațional | N = 12 (N = 9 cu astm) | Itraconazol 200 mg/zi | Simptome Biomarkeri Corticosteroizi | o Răspuns global (clinic, de laborator, radiografic) la 11 pacienți o Reducerea eozinofiliei medii |
50%
o Reducerea IgE serice medii
Abrevieri: ABPA, aspergiloză bronhopulmonară alergică; FEF, flux expirator forțat; FEV1, volum expirator forțat; FVC, capacitate vitală forțată; Ig, imunoglobulină; NAB, amfotericină B nebulizată; NEB, budesonidă nebulizată; PEF, debitul expirator de vârf; PFT, teste ale funcției pulmonare; RCT, studiu clinic randomizat; SAFS, astm sever cu sensibilizare fungică.
a Agenții antifungici includ itraconazol, voriconazol, posaconazol, isavuconazol, NAB.
b Rezultatele includ doar cei 20 de pacienți cu ABPA.
DISCUŢIE
Din câte știm, acesta este primul raport privind utilizarea isavuconazolului pentru tratamentul ABPA. Pe baza răspunsului clinic și fiziologic favorabil al acestui pacient la isavuconazol, credem că isavuconazolul este o opțiune de tratament viabilă pentru pacienții cu ABPA.
Sulfatul de isavuconazoniu este un promedicament al fragmentului triazol activ, isavuconazol. Similar cu alți triazoli, izavuconazolul previne sinteza fungică a membranei celulare prin inhibarea lanosterol-14α-demetilazei. Isavuconazolul are activitate in vitro împotriva multor drojdii și mucegaiuri, inclusiv specii Aspergillus, Mucorales, specii Fusarium și mucegaiuri demaciacee.
Isavuconazolul reduce sarcina fungică și îmbunătățește rezultatele clinice la modelele experimentale de candidoză diseminată și aspergiloză [6, 7]. La om, un studiu clinic randomizat și controlat al pacienților cu aspergiloză invazivă și alte infecții fungice filamentoase (studiu SECURE) a demonstrat că isavuconazolul a avut rate de supraviețuire comparabile cu cele ale voriconazolului și a fost mai sigur și mai bine tolerat [8]. Acest studiu, combinat cu date preclinice, a condus la aprobarea izavuconazolului pentru terapia primară a aspergilozei invazive în Statele Unite și în Europa în 2015.
Pacientul raportat aici a tolerat bine izavuconazolul, a avut o ameliorare simptomatică marcată și a demonstrat un răspuns fiziologic izbitor prin faptul că raportul FEV1/FVC sa normalizat pentru prima dată în 7 ani după diagnosticul ABPA. Acest impact asupra PFT după administrarea isavuconazolului sugerează că a fost mai eficient decât voriconazolul, deși nu putem exclude posibilitatea ca cursurile anterioare de voriconazol sau îmbunătățirea gestionării simptomelor astmului să contribuie, de asemenea, la diferență. De remarcat, izavuconazolul a avut, de asemenea, un efect de economisire a corticosteroizilor pentru pacient, reducând astfel riscul de efecte adverse pe termen scurt și pe termen lung.
O explicație potențială pentru răspunsul relativ mai mare la tratamentul cu isavuconazol versus voriconazol este că isavuconazolul a obținut o expunere mai mare la medicamente și un clearance mai rapid al organismului în comparație cu voriconazol, pentru care nu a fost efectuată monitorizarea terapeutică a medicamentului. O explicație alternativă pentru concentrațiile subterapeutice de voriconazol poate fi fenomenul autoinducției [9]. Un avantaj al isavuconazolului este farmacocinetica liniară previzibilă.
Tratamentul cu isavuconazol este în general sigur și bine tolerat, o caracteristică cheie distinctivă a medicamentului în comparație cu alte terapii ABPA. Reacțiile adverse unice în rândul pacienților cărora li se administrează voriconazol includ modificări tranzitorii ale vederii, halucinații vizuale și fotosensibilitate [4]. Printre pacienții tratați pe termen lung, sunt preocupate periostita și carcinomul cu celule scuamoase. Itraconazolul este asociat cu tulburări gastro-intestinale, insuficiență cardiacă congestivă, erupții cutanate și creșterea enzimelor hepatice. Posaconazolul este asociat cu tulburări gastro-intestinale în funcție de formulare și există date rare care susțin utilizarea acestuia pentru ABPA. Amfotericina B nebulizată provoacă tuse și bronhospasm în timpul inhalării [10].
CONCLUZII
Pe scurt, prezentăm primul raport al unui pacient cu astm bronșic și ABPA care urmează să fie tratat cu succes cu isavuconazol cu efecte adverse minime. Pe baza acestui raport de caz, sugerăm luarea în considerare a unui studiu deschis sau randomizat al isavuconazolului versus voriconazolului pentru tratamentul ABPA la pacienții cu astm de bază.
Mulțumiri
T. J. W. este bursier al Fundației Salvați copiii noștri bolnavi și un bursier al Fundației Sharp Family în Boli infecțioase emergente pediatrice.
Sprijin financiar. Această lucrare a fost finanțată parțial de Fundația Save Our Sick Children (către T. J. W.).
Potențiale conflicte de interese. T. J. W. a primit subvenții de cercetare pentru farmacoterapie experimentală și clinică antimicrobiană de la Astellas, Cubist, Novartis, Merck, Pfizer, Allergan și Theravance. De asemenea, a fost consultant la Astellas, ContraFect, Cubist, Drais, iCo, Novartis, Pfizer, Methylgene, SigmaTau și Trius. Toți autorii au trimis formularul ICMJE pentru dezvăluirea potențialelor conflicte de interese. Au fost dezvăluite conflicte pe care editorii le consideră relevante pentru conținutul manuscrisului.
- Tratamentul de succes la un copil cu artrită asociată entezitei care implică sternoclaviculara
- Programul NIOSH FACE Raport de caz Michigan 01MI006 CDCNIOSH
- Neurita optică ca manifestare izolată a carcinomatozei leptomeningiene Un raport de caz și
- Tiosulfat de sodiu: un tratament emergent pentru calcifilaxie la pacienții cu dializă - FullText - Caz
- OSTEOCHONDRITIS DISECANI ALE CAPULUI RADIAL ÎN TINERUL ATLETE UN RAPORT DE CAZ