Este disponibilă o corecție la acest articol
Acest articol a fost actualizat
Abstract
Introducere
Sindromul ovarului polichistic (SOP) este o endocrinopatie reproductivă cu prevalență estimată la 6%
20% (în funcție de diferitele criterii de diagnostic utilizate), făcându-l cea mai frecventă afecțiune endocrină la femeile în vârstă de reproducere [1]. Caracteristicile de diagnostic ale SOP includ excesul de androgeni, disfuncția ovulatorie și ovarele polichistice [1]. Obezitatea este prezentă la 30-60% dintre pacienții cu PCOS, în funcție de țara de origine [2, 3]. Cea mai consistentă anomalie biochimică la femeile cu SOP este hiper-secreția de androgen, niveluri crescute ale hormonului luteinizant seric (LH) și niveluri scăzute până la normale ale hormonului foliculostimulant seric (FSH) [4, 5]. Modelele animale care reflectă caracteristicile PCOS sunt resurse cruciale pentru investigarea acestui sindrom. Un model de șobolan tratat cronic cu 5α-dihidrotestosteron (DHT) imită îndeaproape fenotipul PCOS uman și este un model adecvat pentru investigații despre PCOS.
Axa hipotalamus-hipofiză-gonadă (HPG) joacă un rol central în reglarea neuroendocrină rafinată a reproducerii. Secreția hipotalamică a hormonului de eliberare a gonadotrofinei (GnRH) a fost stabilită în mod robust ca cale cheie care controlează funcția de reproducere [6]. Axonii neuronilor GnRH ies în eminența mediană și eliberează GnRH, care prin sistemul portal hipofizar, pătrunde în hipofiza anterioară. Hipofiza anterioară, ținta principală a GnRH, răspunde la stimulare prin creșterea secreției de LH și FSH, care la rândul său duce la producerea de steroizi din ovare și stimulează geneza și ovulația foliculului [7]. Astfel, GnRH este cunoscut ca hormonul principal și oferă ieșirea finală comună a rețelei care reglează funcția de reproducere.
GnRH este influențat de factori extrinseci, cum ar fi neurotransmițătorii și neuropeptidele, orice modificare a neurotransmițătorilor de reglare a GnRH, cum ar fi inhibitorii acidului gamma-aminobutiric (GABA) și stimulatorii glutamatului (Glu), pot duce la disfuncții endocrine ale reproducerii [8]. De fapt, anovulația cronică caracteristică SOP este atribuită creșterii impulsului central de GnRH și a aberațiilor gonadotrofinei rezultate, care probabil rezultă din efectul cumulativ al modificării inhibitorilor de stimulare și neurotransmițător GnRH din hipotalamus și glanda pituitară [9]. Kisspeptina și ulterior a descoperit neurkinina B (NKB), două neuropeptide de reglare a GnRH, care s-au dovedit a fi esențiale pentru secreția normală de GnRH la om, au intrat în centrul atenției în ultimul deceniu [10, 11]. Descoperirea aferentă a căii kisspeptin-/neurokinin B−/dinorfină- (KNDy) a consolidat în continuare înțelegerea modulației secreției GnRH [12]. Neuronii KNDy care locuiesc în regiunea nucleului arcuit al rozătoarelor co-exprimă kisspeptina, NKB și DYN [12, 13]. NKB și kisspeptina derivată din KNDy stimulează eliberarea GnRH prin legarea receptorului Kisspeptin 1 (Kiss1r) și receptorului neurokininei 3 (NK3r) exprimat pe neuronii GnRH [14, 15].
Materiale și metode
Administrarea animalelor și a troxerutinei
Prelevarea de sânge și țesuturi
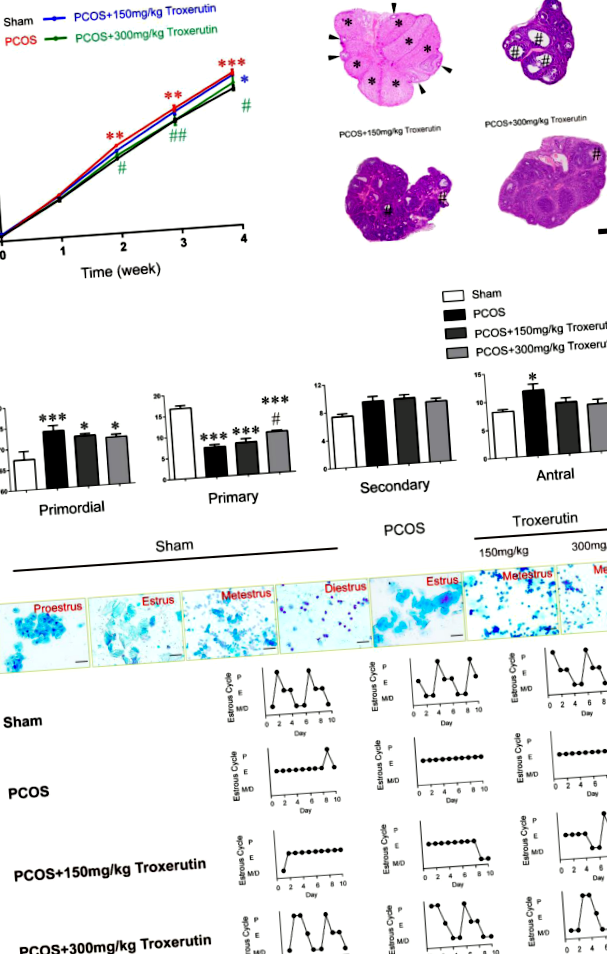
La terminalul studiului, șobolanii au fost decapitați și sângele din trunchi a fost colectat și centrifugat la 3000 rpm timp de 15 min. Plasma a fost separată și depozitată la - 80 ° C până când a fost analizată pentru analize biochimice și hormonale. Ovarele au fost curățate în soluție salină și administrate fără grăsimi. Ovarele au fost fixate în formalină tamponată 10% timp de 48 de ore și încorporate în parafină. Secțiunile de țesut încorporate în parafină au fost decerate, secționate (6 μm) și colorate cu hematoxilină și eozină (H&E). Numărul de foliculi a fost clasificat și numărat în fiecare secțiune a 40-a ovariană pentru 10 ovare per grup. Foliculii au fost numărați în conformitate cu următoarea definiție. Foliculul primordial a fost înconjurat de un singur strat de celule granuloase scuamoase. Foliculul primar conținea un singur strat de celule granuloase cuboidale. Foliculul secundar conținea două sau mai multe straturi de celule de granusola, dar niciun spațiu antral în stratul de granuloasă. Foliculul antral afișa mai multe straturi de celule de granusola cu prezența antrului folicular.
Vagin frotii și cicluri de est
Frotiurile vaginale au fost luate zilnic la 09:00 dimineața până în a 28-a zi după prima zi de tratament cu DHT, care au fost cele 10 zile finale ale studiului. Analiza microscopică (BX41, Olympus) a fost efectuată pentru a determina stadiul ciclului estru de tipurile celulare predominante în frotiurile vaginale după colorarea cu albastru de metilen (Solarbio, Beijing). Proestrul este format din celule epiteliale mărite, rotunde, nucleate; estul constă dintr-un număr mare de celule epiteliale scuamoase cornificate; metestrul este format din două tipuri de celule: celule epiteliale și leucocite cu aproximativ aceeași cantitate; iar diestrul se caracterizează printr-o cantitate mică de celule cu predominanță a leucocitelor.
Greutatea corporală, biochimică și analiza Western blot
Greutatea corporală a fost măsurată în fiecare săptămână după implantare pentru un total de 4 săptămâni.
Concentrația serică de LH, FSH și testosteron a fost măsurată prin testul enzimatic legat de imuno-sorbent (ELISA) cu ajutorul truselor comerciale (trusa ELISA, CUSABIO, Inc., Wuhan, China) și procedura a fost urmată așa cum este prezentat în catalogul de truse . Concentrația de LH, FSH și testosteron a fost estimată prin curba standard.
Pentru a identifica starea hipotalamică a GnRH, hipotalamusul a fost disecat. Creierul șobolanului a fost scos cu atenție și pus temporar pe gheață cu suprafața ventrală în sus. Talamusul este partea elipsoidală din centrul creierului ventral. Cu mijlocul tuberului cinereum și chiasma optică ca centru, marginea preechiasmală ca marginea anterioară, marginea postmamilară ca marginea posterioară, hipotalamusul (4x4x2mm) a fost disecat cu atenție. Țesutul hipotalamic a fost omogenizat pentru a obține probe de proteine. Apoi, proteina (25 μg) a fost separată prin SDS-PAGE și transferată în membrane. Membranele au fost incubate cu anticorp monoclonal anti-GnRH de șoarece (1: 1000, MAB5456-C, Millipore, Billerica, MA) și anticorp anti-GAPDH de șoarece (1: 20000, Proteintech, Chicago, SUA). După ce au fost spălate cu TBST de trei ori, membranele au fost incubate cu anticorpi secundari marca IRDye în TBST timp de 2 ore. Benzile de pe membrană au fost scanate cu un scaner cu infraroșu Odyssey (LI-COR Biosciences, Lincoln, NE, SUA) și densitatea benzilor a fost analizată cu software-ul ImageJ.
Analiza cromatografică
Colorarea imunofluorescentă
După perfuzie intracardiacă cu soluție salină normală urmată de fixare cu paraformaldehidă rece (PFA) 4%, creierele de șobolan au fost separate și postfixate în PFA 4% timp de 6 ore la 4 ° C. Apoi creierele au fost incubate în zahăr 30% - tampon fosfat de sodiu 100 mM (pH 7,4) timp de 48 de ore la 4 ° C. Secțiunile coronale seriale (20 μm) au fost realizate din bregma anterior-posterioară - 2,0 mm până la - 3,30 mm. Au fost colectate în total 60 de secțiuni pe creier. Au fost selectate cel puțin trei secțiuni pe creier pentru colorarea imunofluorescentă NKB, Kisspeptin, GnRH/NK3R și respectiv GnRH/Kiss1r.
Pentru imunofluorescență, anticorpii primari iepure anti-NKB (1: 1000, Novus biologic, NB300–201), iepure anti-kisspeptin (1: 1000, H-048-56, Phoenix Pharmaceuticals), iepure anti-Kiss-1r (1: 500, AKR-001, Alomone Labs), iepure anti-NK3r (1: 500, abx217136, Abbexa) și șoarece anti-GnRH (1: 1000, MAB5456-C, Millipore, Billerica, MA). După incubarea cu anticorpii timp de 24 de ore la 4 ° C, secțiunile au fost spălate cu PBS și apoi au fost tratate cu IgG de capră anti-șoarece IgG (H + L) Alexa Fluor®555 sau 488 -conjugat sau capră anti-iepure IgG (H + L) Alexa Fluor®488 (Invitrogen, Eugene, OR, SUA) anticorpi secundari. Conform instrucțiunilor producătorului, DAPI (Beyotime Biotechnology, Shanghai, China) a fost utilizat pentru etichetarea nucleului. Pentru martorii negativi, secțiunile au fost incubate cu PBS în locul anticorpilor primari. Imaginile cu fluorescență au fost capturate cu ajutorul unui microscop Zeiss Axioskop 40 (Carl Zeiss, Oberkochen, Germania). Software-ul Image Pro-Plus 6.0 a fost utilizat pentru măsurarea semi-cantitativă a densității imunofluorescente. Valorile (trei diapozitive pentru fiecare creier) ale densității optice integrale (IOD) în celule individuale au reprezentat cantitatea de proteină obiectivă și au fost calculate utilizând următoarea ecuație: OD IOD/Σ DAPI.
analize statistice
Toate analizele statistice au fost efectuate cu software-ul SPSS (versiunea 16.0), iar datele au fost analizate utilizând Analiza unică a varianței (ANOVA). Datele au fost exprimate ca medie ± s.e.m. Semnificația statistică a fost stabilită la P
Rezultate
Troxerutina a redus greutatea corporală, a îmbunătățit morfologia și funcția ovariană anormală la șobolanii PCOS
Am investigat mai întâi dacă administrarea de troxerutină are vreo influență asupra greutății corporale la modelele de șobolan PCOS induse de DHT. Cursul de timp al administrării troxerutinei și evaluarea fenotipurilor au fost ilustrate (Fig. 1). Greutatea corporală pentru fiecare animal a fost cântărită săptămânal după implantarea DHT timp de până la 4 săptămâni. Greutatea corporală la momentul inițial și prima săptămână nu a prezentat nicio diferență semnificativă între toate grupurile. Șobolanii tratați cu DHT au prezentat o greutate corporală semnificativ mai mare la al doilea (P FIG. 1
Troxerutina a inversat nivelurile serice anormale ale gonadotrofinei și testosteronului la șobolanii PCOS
Nivelurile serice de LH, FSH și testosteron au fost măsurate în a patra săptămână prin ELISA (Fig. 2). Șobolanii PCOS au prezentat o creștere semnificativă a nivelului seric de LH și de testosteron comparativ cu șobolanii fals (P FIG. 2
Troxerutina a inhibat nivelurile crescute de GnRH la șobolanii PCOS
Originea alterării LH și FSH se află adesea la nivelul GnRH hipotalamic, care joacă un rol esențial în stimularea eliberării hipofizare a gonadotrofinei, astfel am detectat în continuare starea serică și hipotalamo-hipofizară a GnRH. Așa cum se arată în FIG. 3, rezultatele Western blot au arătat GnRH crescut în hipotalamo-hipofiză la șobolanii PCOS (P FIG. 3
Troxerutina a modificat neurotransmițătorii de reglare a GnRH în hipotalamusul șobolanilor PCOS
GnRH ar putea fi influențat de neurotransmițători de reglementare, cum ar fi inhibitorii majori ai GABA și stimulatorii Glu. Așa cum este prezentat în Fig. 4, nivelurile neurotransmițătorilor din hipotalamus au arătat o diferență semnificativă între anumite grupuri. Pentru a fi specific, șobolanii PCOS au prezentat GABA semnificativ scăzut (P FIG. 4
Troxerutin a redus expresia Kisspepetin1/Kiss1r și Neurokinin B/NK3r în hipotalamus
Kisspeptina și NKB secretate de neuronii KNDy din ARC sunt considerate noi neurotransmițători stimulatori ai GnRH și stimulează expresia receptorului kisspeptinei (kiss1r) și receptorului neurokininei B (NK3r) al neuronilor GnRH în eminența mediană (ME). Aici, am efectuat colorarea imunofluorescentă pentru a observa dacă administrarea de troxerutină modifică expresia kisspeptin/kiss1r și NKB/NK3r în regiunile lor respective (Fig. 5 și Fig. 6). IOD-ul celulelor pozitive din ARC a fost semnificativ crescut la șobolanii PCOS comparativ cu șobolanii fals (P FIG. 5
Discuţie
Impulsurile GnRH stimulează sinteza și secreția LH și FSH din hipofiza anterioară. Este binecunoscut faptul că, deși produs în aceeași celulă denumită gonadotrof, sinteza LH și FSH este reglată de frecvența diferită a impulsurilor GnRH, cu LH favorizat de frecvențe rapide de impuls (> 1 impuls pe oră) și FSH favorizat de frecvențe de impuls lent
Concluzii
Luate mai sus, aceste rezultate au indicat că protecția troxerutinei împotriva PCOS s-ar putea datora parțial capacității sale de a regla hipotalamic GABA, Glu, kisspeptin/kiss1r și NKB/NK3r. Deși rămâne stabilit dacă această inversare cauzată de troxerutină este permanentă, prezentul studiu a evidențiat potențialul său terapeutic pentru SOP. Va fi necesară o cercetare mai aprofundată pentru a determina dacă troxerutina vizată doar de neurotransmițători hipotalamici este o abordare terapeutică promițătoare pentru tratamentul SOP.
Disponibilitatea datelor și a materialelor
Seturile de date utilizate și/sau analizate în prezentul studiu sunt disponibile de la autorul corespunzător, la cerere rezonabilă.
- Actualizare în sindromul ovarului polichistic noi criterii de diagnostic și tratament în Japonia
- SINDROMUL WILKIE S O CAUZĂ RARĂ A OBSTRUCȚIEI INTESTINALE
- Tectonica subțire a pielii SpringerLink
- Varice în fese - Întrebări despre tratamentul sindromului congestiei pelvine; Răspunsuri
- Sindromul arici Wobbly Sindromul de animale VCA