Lucy A. Perrone
Direcția imunologie și patogenie, divizia de gripă, Centrul național pentru imunizare și boli respiratorii, centre colaboratoare pentru boli infecțioase, centre pentru controlul și prevenirea bolilor, Atlanta, Georgia, 1 Novavax, Inc., Rockville, Maryland 2
Attiya Ahmad
Direcția imunologie și patogenie, divizia de gripă, Centrul național pentru imunizare și boli respiratorii, centre colaboratoare pentru boli infecțioase, centre pentru controlul și prevenirea bolilor, Atlanta, Georgia, 1 Novavax, Inc., Rockville, Maryland 2
Vic Veguilla
Direcția imunologie și patogenie, divizia de gripă, Centrul național pentru imunizare și boli respiratorii, centre colaboratoare pentru boli infecțioase, centre pentru controlul și prevenirea bolilor, Atlanta, Georgia, 1 Novavax, Inc., Rockville, Maryland 2
Xiuhua Lu
Direcția imunologie și patogenie, divizia de gripă, Centrul național pentru imunizare și boli respiratorii, centre colaboratoare pentru boli infecțioase, centre pentru controlul și prevenirea bolilor, Atlanta, Georgia, 1 Novavax, Inc., Rockville, Maryland 2
Gale Smith
Direcția imunologie și patogenie, divizia de gripă, Centrul național pentru imunizare și boli respiratorii, centre colaboratoare pentru boli infecțioase, centre pentru controlul și prevenirea bolilor, Atlanta, Georgia, 1 Novavax, Inc., Rockville, Maryland 2
Jacqueline M. Katz
Direcția imunologie și patogenie, divizia de gripă, Centrul național pentru imunizare și boli respiratorii, centre colaboratoare pentru boli infecțioase, centre pentru controlul și prevenirea bolilor, Atlanta, Georgia, 1 Novavax, Inc., Rockville, Maryland 2
Peter Pushko
Direcția imunologie și patogenie, divizia de gripă, Centrul național pentru imunizare și boli respiratorii, centre colaboratoare pentru boli infecțioase, centre pentru controlul și prevenirea bolilor, Atlanta, Georgia, 1 Novavax, Inc., Rockville, Maryland 2
Terrence M. Tumpey
Direcția imunologie și patogenie, divizia de gripă, Centrul național pentru imunizare și boli respiratorii, centre colaboratoare pentru boli infecțioase, centre pentru controlul și prevenirea bolilor, Atlanta, Georgia, 1 Novavax, Inc., Rockville, Maryland 2
Abstract
Vaccinurile tradiționale antigripale oferă o protecție optimă împotriva virusurilor care sunt antigenic strâns asemănătoare cu cele conținute în vaccin, dar care au fost mai puțin eficiente împotriva variantelor antigenice dintr-un subtip și oferă în mod istoric doar o protecție minimă împotriva virusurilor cu subtipuri HA noi (1). Astfel, a existat interes în dezvoltarea unui vaccin sau a unei strategii de vaccinare care poate induce o imunitate mai largă a reactivității încrucișate împotriva mai multor subtipuri de virusuri gripale care conțin combinații multiple de proteine de suprafață, cunoscute și sub numele de imunitate heterosubtipică. În plus față de o scădere a morbidității globale după infecție, animalele imun heterosubtipic prezintă scăderea titrurilor virale și durata scurgerii virale în tractul respirator (23, 27, 36, 54, 65, 70, 75).
MATERIALE ȘI METODE
Viruși și celule.
Virusurile gripale competente pentru replicare utilizate în aceste experimente au inclus (i) virusul reconstruit 1918 H1N1 (prescurtat 1918) (72) care posedă A/Carolina de Sud/1/18 HA și (ii) A/Vietnam/1203/2004 H5N1 (prescurtat VN/1203) virusul anterior dovedit a fi extrem de virulent atât pentru șoareci, cât și pentru dihori (42, 74). Virusul din 1918 a fost generat cu sistemul de genetică inversă cu 12 plasmide într-un amestec de rinichi canin Madin-Darby (MDCK; ATCC, Manassas, VA) și celule 293T (ATCC) așa cum s-a descris anterior (72). Virusul VN/1203 a fost crescut în ouă de găină embrionatoare. Toate titrurile stocului de viruși au fost determinate prin testarea plăcii pe celulele MDCK, iar stocurile de viruși au fost menținute în cultura medie modificată Eagle a lui Dulbecco (Gibco, Grand Island, NY) suplimentată cu 10% ser fetal de vițel (HyClone, Logan, UT) și 1% penicilină/streptomicină (Gibco). Toate experimentele de provocare a virusului au fost efectuate sub îndrumarea S.U.A. Programul național pentru agenți selectivi în laboratoare îmbunătățite cu nivel de biosiguranță 3+ (BSL-3 +) filtrat prin presiune negativă HEPA cu utilizarea unui aparat de respirat cu filtru HEPA Racal alimentat cu baterii și conform procedurilor de laborator microbiologic și biomedical biomedical (58).
Generarea VLP.
Vaccinarea șoarecilor și provocarea virusului.
Vaccinarea dihorului și provocarea virusului.
Serologie.
REZULTATE
Vaccinarea mucoasă, dar nu parenterală, induce imunitate heterotipică la șoareci.
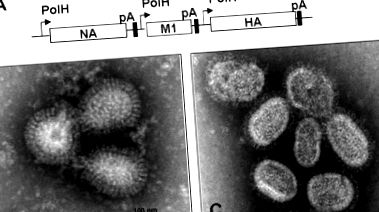
Generația VLP din 1918. VLP-urile au fost construite într-un fundal genetic al baculovirusului cu secvențele genelor pentru HA, NA și M1 ale virusului pandemic din 1918 și produse din celule Sf9. (A) Construcție de baculovirus pentru exprimarea VLP gripale din 1918. Sunt indicați promotorul poliedrinului (PolH), semnalul de poliadenilare (pA) și genele virusului gripal. VLP-urile din 1918 aveau un diametru mediu de 100 nm, așa cum este ilustrat în această micrografie cu electroni cu transmisie negativă. Deși nu sunt competenți pentru replicare, VLP-urile 1918 (B) seamănă morfologic cu virionii reconstruiți din 1918 care au fost colectați din supernatanții culturilor de celule MDCK (C) infectate cu virusul din 1918 Mag, mărire.
Eficacitatea vaccinului VLP din 1918 la șoareci în urma unei provocări letale de virus H1N1 sau H5N1. Șoarecii au fost vaccinați cu 5 μg/50 μl 1918 VLP sau au controlat VLPs HIV și au fost provocați cu 50 LD50 fie din virusul 1918 (H1N1) (coloana stângă), fie cu virusul VN/1203 (H5N1) (coloana dreaptă). Șoarecii au fost monitorizați zilnic timp de 14 zile p.c. Ratele de supraviețuire (A) după provocare au fost calculate în funcție de procentul de supraviețuire în cadrul fiecărui grup experimental (n = 6 șoareci per grup experimental; *, P (Fig. 2A, 2A, coloana din dreapta). Mai mult, șoarecii vaccinați parenteral au prezentat o pierdere dramatică în greutate de la 2 zile pc până la moarte, similar cu animalele vaccinate cu HIV VLP (Fig. (Fig. 2B, 2B, coloana din dreapta). În schimb, cinci din șase șoareci care au primit aceeași doză de vaccin VLP din 1918 au fost protejați împotriva o provocare a virusului heterotipic H5N1 (Fig. (Fig. 2A, 2A, coloana din dreapta). Șoarecii supraviețuitori au prezentat morbiditate care a atins o pierdere medie în greutate maximă de 17% în ziua 5 buc înainte de creșterea în greutate a fost observată din ziua 6 buc în continuare (Fig. (Fig. 2B, 2B, coloana din dreapta). Titrurile medii ale virusului pulmonar la șoareci cărora li s-a administrat vaccinul VLP 1918 pe cale au fost de aproximativ 300 de ori mai mici decât cele ale șoarecilor martor care au primit vaccin PBS sau HIV VLP (Fig. 2C, 2C, coloana din dreapta.) Șoarecii vaccinați im și c tulburat de virusul H5N1 a prezentat titruri de aproape 106 PFU/ml, doar de două ori mai mici decât cele ale șoarecilor martor. În mod colectiv, aceste rezultate demonstrează că imunizarea mucoasă H1N1 VLP asigură o imunitate heterotipică mai mare împotriva virusului H5N1 decât vaccinarea VLP parenterală.
Vaccinarea mucoasă cu 1918 VLP are ca rezultat titruri mai mari de anticorpi IgG și IgA la șoareci decât vaccinarea parenterală.
DISCUŢIE
În studiul de față, am testat capacitatea VLP-urilor 1918 neadjuvantate de a oferi protecție împotriva virusului pandemic reconstruit din 1918, precum și a provoca protecție încrucișată împotriva provocării letale a virusului H5N1. Au fost comparate două căi de vaccinare (mucoasă și parenterală) pentru a evalua efectul potențial al căii de administrare a VLP asupra eficacității vaccinului și s-au folosit două modele de mamifere ale bolii gripale puternic patogene (39, 42, 72, 74). Toți șoarecii vaccinați cu VLP din 1918 și provocați letal cu virusul din 1918 au supraviețuit și au fost bine protejați, indiferent de calea de vaccinare, susținând rezultatele studiilor anterioare de provocare a virusului omolog cu VLP gripale exprimate cu baculovirus (4, 41, 53, 55 ). Important, aceste studii au arătat că vaccinarea mucoasă VLP a fost superioară vaccinării parenterale pentru inducerea imunității heterotipice. Efectul de protecție încrucișată a vaccinării mucoasei a fost asociat cu o reducere a pierderii în greutate și reducerea replicării virusului H5N1 în mucoasa respiratorie.
Studiile noastre ridică întrebări importante cu privire la aplicarea acestei tehnologii de vaccinare, atât în situații sezoniere, cât și în situații de focar epidemic. Mai exact, ar putea administrarea mucoasei de vaccin gripal VLP care poartă proteine virale gripale sezoniere sau pandemice să reducă morbiditatea și letalitatea pe scară largă datorită unui subtip nou apărut înainte de producerea unui vaccin specific tulpină? Alte cercetări au indicat că acest lucru ar putea fi posibil (23, 29). Un vaccin care ar putea induce sau crește imunitatea heterotipică prin stimularea unui anticorp cu reactivitate încrucișată ar putea fi o măsură preventivă importantă împotriva unui subtip nou, permițând timp pentru dezvoltarea unui vaccin pandemic specific tulpină.
Mulțumiri
L.A.P. a fost susținut de o bursă din partea Societății Americane de Microbiologie și a Centrului de Coordonare CDC pentru Boli Infecțioase.
Mulțumim Ministerului Sănătății din Vietnam pentru utilizarea izolatului A/Vietnam/1203/04 și Jessica Belser pentru determinarea dihorului LD50 a acelui virus. Mulțumim Debrei Wadford, Neal Van Hoeven, Joshua DeVos și Ebonee Butler pentru furnizarea de reactivi și asistența cu testele serologice. Mulțumim, de asemenea, lui Ye Liu și Tom Kort pentru asistența de specialitate în purificarea VLP și Feng Lui pentru asistența sa în analiza statistică a datelor privind mortalitatea șoarecilor.
Constatările și concluziile din acest raport sunt ale noastre și nu reprezintă neapărat punctele de vedere ale agenției de finanțare.
- Postul intermitent poate ajuta la pierderea în greutate ... La șoareci de Gideon M-K; Health Nerd Medium
- Timpii zilnici mai lungi de post îmbunătățesc sănătatea și longevitatea la șoareci Institutul Național pentru Îmbătrânire
- MicroRNA2911 atipic codificat cu caprifoi vizează direct virusul gripei A Research Cell
- Mangan în apă potabilă Fișier HealthLinkBC 49g
- Modul în care extractele de plante naturale vă pot ajuta să slăbiți Comandați produsele TruVision