Candice Quin
1 Departamentul de biologie, campusul Okanagan, Universitatea din Columbia Britanică, Campusul Okanagan ASC 386, 3187 University Way, Kelowna, BC V1V 1V7, Canada
Deanna L. Gibson
1 Departamentul de biologie, campusul Okanagan, Universitatea din Columbia Britanică, Campusul Okanagan ASC 386, 3187 University Way, Kelowna, BC V1V 1V7, Canada
2 Departamentul de Medicină, Facultatea de Medicină, Universitatea Columbia Britanică, Kelowna, BC V1V 1V7, Canada
Abstract
Laptele uman este cea mai bună alegere nutrițională pentru sugari. Cu toate acestea, în cazurile în care alăptarea nu este posibilă, formulele pentru sugari sunt utilizate ca alternative. În timp ce producătorii de formule încearcă să imite performanța laptelui matern uman, bebelușii hrăniți cu formulă au în mod constant incidențe mai mari de infecție din boli diareice decât cei alăptați. Diferențele în sensibilitatea, progresia și severitatea bolii pot fi atribuite, în parte, diferențelor de acizi grași nutriționali dintre laptele matern și formula. În ciuda progreselor în ceea ce privește înțelegerea proprietăților laptelui matern, formulele prezintă încă diferențe majore în compoziția acidului gras în comparație cu laptele matern uman. În această revizuire, subliniem rolul diferitelor tipuri de acizi grași din dietă în modularea inflamației gazdei, atât direct, cât și prin legătura imunitară a microbiomului. Prezentăm dovezi că acizii grași din dietă influențează susceptibilitatea bolilor enterice și, prin urmare, modificarea compoziției acizilor grași din formulă poate fi o strategie potențială pentru îmbunătățirea rezultatelor infecțioase la sugarii hrăniți cu formule.
1. Introducere
2. Metode
2.1. Strategia de căutare a literaturii
Pentru această revizuire a literaturii, am căutat PubMed (1966-2019), Web of Science (1864–2019), Google Scholar și căutări manuale pentru studii primare care investighează efectele acizilor grași dietetici asupra microbiomului, funcției imune și infecțiilor enterice comune la sugari. Strategia de căutare s-a bazat pe o selecție clară și atentă a cuvintelor cheie, inclusiv combinații de: dietă * ȘI (acid gras * SAU grăsime * SAU polinesaturat * SAU mononesaturat * SAU saturat * SAU ulei de pește *) ȘI (imun * SAU inflamație * SAU înnăscut * SAU adaptativ *) ȘI (boală enterică * SAU rotavirus * SAU Escherichia coli * SAU Shigella * SAU Salmonella * SAU Vibrio cholerae * SAU Campylobacter jejuni * SAU Citrobacter rodentium *) ȘI (bacterii * SAU comensale * SAU microbiom * SAU bacteriom * SAU microorganisme * SAU floră *).
2.2. Criterii de incluziune și excludere
Studiile incluse au trebuit să raporteze efectele unei diete specifice cu acizi grași asupra microbiomului, a răspunsurilor imune sau a rezultatelor bolii enterice. Interacțiunile dintre acizii grași alimentari și bolile enterice au fost limitate la studii pe animale care raportează rezultatele morbidității și mortalității. Studiile au fost excluse dacă nu a fost specificat tipul de grăsime alimentară consumată. Studiile cu privire la microbiomi au fost, de asemenea, excluse dacă nu au raportat microbiomul gastro-intestinal.
3. Programarea microbiană a sistemului imunitar infantil
Oamenii au dezvoltat o relație simbiotică cu microbiomul intestinal, un ecosistem microbian vast și complex compus în primul rând din bacterii, dar conține și ciuperci, viruși și arhee. Microbiomul se află la interfața mediului intestinal și extern, formând o punte între celulele epiteliale intestinale și antigenele dietetice. Aici, bacteriile comensale joacă un rol crucial în absorbția nutrienților, reprezentând până la 10% din energia alimentară la mamifere [12]. Cu toate acestea, în ultimul deceniu cercetătorii au ajuns să aprecieze că această relație reciproc avantajoasă se extinde dincolo de digestia alimentelor. Un număr tot mai mare de dovezi indică faptul că expunerile la microorganisme comensale la începutul vieții sunt esențiale pentru buna dezvoltare și funcționarea sistemului imunitar al mucoasei. În timp ce interacțiunile dintre bacteriile comensale, morfologia intestinală și dezvoltarea imunitară au fost bine revizuite [13,14,15], aici oferim o prezentare generală pentru a evidenția modul în care acizii grași din dietă se sinergizează cu acest proces.
4. Microbiom și dezvoltare imună
5. Microbiota și acizii grași dietetici
Acizii grași pot normaliza microbiomul și alte aspecte ale dezvoltării imune intestinale la sugarii hrăniți cu formule. Membrana globulară a grăsimii din lapte, o componentă unică a grăsimii din laptele matern, hrănită puii de șobolan ca o formulă fortificată a afectat adâncimea criptei intestinale, subseturile de celule epiteliale, proliferarea celulelor epiteliale și comunitățile microbiene intestinale într-un mod similar cu puii crescuți cu laptele matern [45] . În schimb, grupul cu formula de control a avut deficite semnificative în dezvoltarea intestinală. Când a fost provocată cu toxine Clostridium difficile, formula fortificată a oferit o protecție semnificativă împotriva deteriorării mucoasei în comparație cu puii hrăniți cu formula de control. Acest studiu leagă astfel în mod direct microbiomul intestinal, acizii grași din dietă și susceptibilitatea bolii enterice și sugerează o strategie de îmbunătățire a rezultatelor infecțioase la sugarii hrăniți cu formule. Într-adevăr, un studiu controlat randomizat dublu-orb a constatat că proteina din membrană a globulei de grăsime din laptele bovin a scăzut incidența diareei la sugari [46]. Împreună, aceste studii arată că grăsimile dietetice pot modifica semnificativ condițiile pentru asamblarea microbiană intestinală.
6. Acizii grași și inflamația
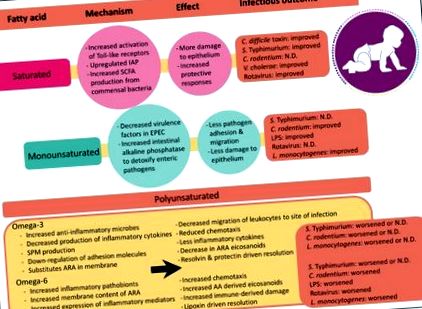
Deși se știe de zeci de ani că acizii grași din dietă pot modifica direct răspunsurile inflamatorii la mamifere [47], studiile recente abia au început să aprecieze că indicele de saturație dintre acizii grași are efecte profunde asupra inflamației (Figura 1). Așa cum s-a descris mai sus, celulele imune secretă o mare varietate de semnale chimice în timpul inflamației. Mulți dintre acești mediatori inflamatori, cum ar fi prostaglandinele, leucotrienele și tromboxanii sunt derivați din acidul gras polinesaturat omega-6, acidul arahidonic. Deși există dovezi puternice care susțin legătura dintre eicosanoidele derivate din acid arahidonic și inflamație, este important de reținut că nu toate eicosanoidele derivate din acid arahidonic sunt pro-inflamatorii. De exemplu, lipoxina A4 joacă un rol important în rezolvarea inflamației după infecție prin eliminarea neutrofilelor de la locul infecției și prin inhibarea activării NFκB [48,49]. Cu toate acestea, eicosanoidele derivate din acid arahidonic sunt centrale în răspunsurile inflamatorii.
Rezumatul perspectivelor mecaniciste, efectelor inflamatorii și rezultatelor bolii enterice determinate de acizi grași saturați, mononesaturați și polinesaturați. Ameliorarea, agravarea sau nicio diferență (ND) descrie severitatea rezultatelor infecțioase diareice în comparație cu alte diete testate. Dacă două studii au avut rezultate contradictorii, ambele rezultate sunt enumerate. Abrevieri: IAP, fosfatază alcalină intestinală; SPM, mediatori specializați în rezolvarea lipidelor; SCFA, acizi grași cu lanț scurt; LPS, lipopolizaharidă; ARA, acid arahidonic; EPEC, Escherichia coli enteropatogenă.
Spre deosebire de efectele acizilor grași polinesaturați asupra inflamației, mecanismul prin care acizii grași saturați sau mononesaturați influențează inflamația gazdei rămâne neclar. Studiile limitate sugerează că acizii grași saturați cresc inflamația gazdei. De exemplu, lauratul și palmitatul s-au arătat că activează receptorii de tip Toll 2 și 4. Acești receptori ai suprafeței celulelor imune activează căile de semnalizare imună înnăscute care sunt critice pentru apărarea gazdei împotriva agenților patogeni. Colectiv, aceste descoperiri evidențiază faptul că impactul acidului gras în contextul inflamației este complex și că este important să se ia în considerare tipul de grăsime atunci când se examinează răspunsurile gazdei la agenții patogeni enterici.
7. Acizii grași dietetici, microbiomul și boala enterică la sugari
8. Acizi grași saturați
Rotavirusul este principala cauză a diareei care pune viața în pericol la copii. În 2016, Organizația Mondială a Sănătății a estimat la nivel mondial 215.000 de decese la copiii cu vârsta sub cinci ani rezultate din infecția cu rotavirus [85]. Studiile timpurii privind interacțiunile dintre acizii grași și viruși au arătat că grăsimile din laptele uman au efecte antivirale [86], prin care acizii grași saturați cu lanț mediu erau foarte activi împotriva virusurilor herpes simplex. Pentru a vedea dacă acizii grași din dietă au avut efecte antivirale împotriva rotavirusului, șoarecii BABL/c de 3 săptămâni au fost hrăniți cu diete izocalorice bogate în grăsimi saturate din unt, grăsimi mononesaturate din ulei de măsline sau grăsimi polinesaturate omega-6 din ulei de porumb, timp de o săptămână. . Șoarecii neonatali în vârstă de șapte zile au fost apoi provocați oral cu diaree epidemică a șoarecilor sugari (EDIM) cu rotavirus. La 48 de ore după inoculare, 72,7% dintre cei cu ulei de porumb, 46% dintre cei cu ulei de măsline și 50% din controale, dar niciunul din grupul de unt, a dezvoltat diaree sugerând un efect protector împotriva grăsimilor saturate și că nesaturatul a determinat infecția virală [87].
Similar cu EPEC, unele tulpini de V. cholerae provoacă diaree severă la sugari. Deși există un vaccin pentru prevenirea infecției cu holeră, acesta nu este întotdeauna eficient și sunt necesare alte strategii preventive. Un studiu care a evaluat proprietățile antibacteriene ale monoacilgliceridelor cu lanț mediu și ale acizilor grași liberi a constatat că administrarea concomitentă de monocaprin, o monogliceridă a acidului capric acid gras saturat, cu V. cholerae poate reduce semnificativ V. cholerae viabil în tractul gastro-intestinal al șoarecilor. Cu toate acestea, în timp ce administrarea de monoacigliceride pare să reducă colonizarea V. cholerae, are un efect redus odată ce agentul patogen este stabilit [90]. Din păcate, șoarecii din acest studiu au fost tratați cu streptomicină pentru a-i predispune la colonizarea bacteriană. Deoarece acești șoareci au fost tratați cu streptomicină, orice rol sinergic al microbiomului ar fi eliminat. Prin urmare, sunt necesare noi modele pentru a înțelege diafragma dintre acizii grași din dietă, gazda și microbiomul în timpul infecțiilor cu V. cholerae.
Atributele de protecție ale dietelor pe bază de grăsimi saturate pot fi sporite prin adăugarea de culturi bacteriene vii. Un studiu care a investigat rolul dietelor pe bază de grăsimi saturate în infecțiile cu Salmonella Typhimurium a constatat că dietele pe bază de iaurt sunt mai protectoare decât dietele pe bază de grăsimi din lapte. În acest studiu, șoarecii au fost plasați pe o dietă pe bază de iaurt sau lapte timp de patru săptămâni și au provocat intragastric cu Salmonella în absența antibioticelor [95]. Autorii au descoperit că iaurtul a îmbunătățit atât imunitatea locală cât și cea sistemică și atribuie această protecție sporită bacteriilor din iaurt. Această idee a fost susținută de un studiu separat care a arătat că șoarecii care adăpostesc microbiota intestinală cu complexitate scăzută nu pot elimina Salmonella Typhimurium după administrarea cu streptomicină [96]. Prin transferul unui complex normal de microbiota la acești șoareci, se restabilește rezistența și clearance-ul colonizării. Aceste descoperiri subliniază importanța acizilor grași din dietă și a diafragmei gazdă-microbiene și subliniază necesitatea unor modele care nu necesită pre-tratament cu antibiotice.
Colectiv, aceste studii demonstrează că dietele pe bază de grăsimi saturate promovează răspunsuri inflamatorii solide la bolile enterice, contribuind la supraviețuire. În timp ce acest proces cauzează inițial daune inflamatorii induse epiteliului, acesta este urmat de răspunsuri protectoare compensatorii. Aceste răspunsuri de protecție sunt legate în mod complex cu microbiomul gazdă și evidențiază importanța înțelegerii acizilor grași și a interacțiunilor gazdă-microbiene.
9. Acizi grași mononesaturați
10. Acizi grași polinesaturați
11. Acizi grași polinesaturați Omega-6
12. Acizi grași polinesaturați Omega-3
Impactul acizilor grași polinesaturați omega-3 asupra răspunsurilor inflamatorii sau imune poate varia, de asemenea, în funcție de tipul de infecție. Acizii grași polinesaturați omega-3 nu au avut niciun impact asupra răspunsurilor inflamatorii intestinale locale la infecția cu parazitul Trichinella spiralis la șobolani, comparativ cu o dietă cu ulei de măsline bogată în acizi grași mononesaturați [110]. În general, există mai multe lucrări publicate care raportează efecte adverse sau fără efecte ale acizilor grași polinesaturați omega-3 asupra rezistenței gazdei la provocarea enterică decât cele care prezintă efecte benefice. Cu toate acestea, amploarea acestor efecte poate depinde de dieta de fond consumată alături de suplimentele de acizi grași polinesaturați omega-3. De exemplu, adăugarea de ulei de pește în dietele de grăsime din lapte induce răspunsuri de protecție în timpul infecției cu C. rodentium [11]. Teorizăm că acesta este motivul pentru care suplimentarea cu ulei de pește la sugarii care consumă lapte de vacă au modificat diversitatea microbiană intestinală, dar nu sugarii care consumă formula [111].
13. Direcții viitoare pentru formula pentru sugari
14. Concluzii
Contribuțiile autorului
Conceptualizare, C.Q. și D.L.G.; Procesul de revizuire, C.Q. și D.L.G.; Redactare-pregătire proiect original, C.Q.; Scriere-recenzie și editare, C.Q. și D.L.G.
Finanțarea
Această cercetare nu a primit finanțare externă.
- Explorarea dietelor de biban galben în Lacul Michigan prin conținut de stomac, acizi grași și stabil
- Dieta, brânza și acizii grași Omega-3 reprezintă un moment sănătos pentru brânză
- ACIDI NUCLEICI DIETETICI - DR
- Efectul tipului de grăsime dietetică asupra calității cărnii și a compoziției acizilor grași din diferite țesuturi din
- Acizi grași, obezitate și rezistență la insulină - FullText - Obezitate Fapte 2015, Vol