Abstract
fundal
Obezitatea și tulburările asociate acesteia devin o problemă majoră de sănătate în multe țări. Inflamația rezultată nu afectează doar periferia, ci și sistemul nervos central. Ne-am propus să studiem, într-o manieră dependentă de timp, efectele unei diete bogate în grăsimi asupra diferitelor regiuni ale sistemului nervos central în ceea ce privește tonusul inflamator.
Metode
Am folosit un model de obezitate indusă de dietă și am comparat în mai multe momente de timp (1, 2, 4, 6, 8 și 16 săptămâni) un grup de șoareci hrăniți cu o dietă bogată în grăsimi cu grupul de control respectiv hrănit cu o dietă standard. De asemenea, am efectuat o analiză la scară largă a lipidelor din sistemul nervos central utilizând HPLC-MS și apoi am testat lipidele de interes pe o co-cultură primară de astrocite și celule microgliene.
Rezultate
Am măsurat o creștere a tonusului inflamator în cerebel la diferitele puncte de timp. Cu toate acestea, în săptămâna 16, am demonstrat că tonusul inflamator a prezentat diferențe semnificative în două regiuni diferite ale sistemului nervos central, în special o creștere a cerebelului și nicio modificare a cortexului pentru șoarecii cu o dietă bogată în grăsimi în comparație cu șoarecii hrăniți cu chow. . Rezultatele noastre sugerează în mod clar adaptări atât ale regiunii, cât și ale timpului, ale sistemului nervos central la dieta bogată în grăsimi. Diferențele de tonus inflamator între cele două regiuni considerate par să implice astrocite, dar nu și celule microgliene. Mai mult, un screening la scară largă al lipidelor, cuplat cu testarea ex vivo, ne-a permis să identificăm trei clase de lipide - fosfatidilinozitoli, fosfatidiletanolamine și lizofosfatidilcoline - precum și palmitoiletanolamidă, ca potențial responsabil pentru diferența de tonus inflamator.
Concluzii
Acest studiu demonstrează că tonusul inflamator indus de o dietă bogată în grăsimi nu afectează în mod similar regiuni distincte ale sistemului nervos central. Mai mult, lipidele identificate și testate ex vivo au prezentat proprietăți antiinflamatorii interesante și ar putea fi studiate în continuare pentru a caracteriza mai bine activitatea și rolul lor în controlul inflamației din sistemul nervos central.
fundal
Obezitatea și tulburările asociate devin probleme de sănătate la nivel mondial [1-3]. Obezitatea este considerată o afecțiune inflamatorie datorită inflamației asociate de grad scăzut [4-6] care afectează periferia și crește incidența multor patologii, cum ar fi bolile cardiovasculare [7], astmul bronșic [8] sau chiar cancerul [9]. Unul dintre mecanismele propuse care conduc la inflamații periferice implică microbiota intestinului. Mai precis, o dietă bogată în grăsimi (HFD) va schimba echilibrul între diferite populații de bacterii din intestin [10, 11]. Acest lucru va duce la o perturbare a integrității epiteliului intestinal care, la rândul său, va duce la creșterea trecerii endotoxinelor (cum ar fi lipopolizaharidele (LPS)) în fluxul sanguin, care va alimenta apoi tonusul inflamator periferic [4, 12, 13]. Demonstrația că perturbarea semnalizării LPS (de exemplu, șoareci TLR4 -/- sau șoareci CD14 -/-) protejează de obezitatea indusă de dietă și de tulburările metabolice susține cu tărie rolul important jucat de LPS în fiziopatologia acestor tulburări [12-15].
Percepția lipidelor s-a schimbat dramatic de la simpla moleculă de substrat energetic la moleculele bioactive implicate în multe procese fiziologice, în special prin apariția abordării lipidomice [33]. Lipidele sunt recunoscute ca mediatori centrali implicați în apariția, dezvoltarea și rezolvarea proceselor inflamatorii [34, 35]. Obezitatea modifică nivelurile endogene ale mai multor familii de lipide bioactive, cum ar fi ceramide, fosfatidilcoline și endocannabinoizi [36-38]. La rândul lor, unele lipide bioactive exercită fie efecte pro-, fie anti-inflamatorii în timpul obezității. De exemplu, ceramidele vor exercita efecte pro-inflamatorii la nivelul ficatului și vor duce progresiv la rezistența la insulină prin modificarea semnalizării insulinei [6, 39, 40]. În schimb, acizii grași polinesaturați n - 3 prezintă efecte benefice prin contracararea inflamației țesutului adipos indusă de HFD [41]. Totuși, implicarea potențială a altor lipide trebuie abordată pentru a caracteriza mai bine tonusul inflamator derivat din obezitate.
În acest studiu, ne-am propus să caracterizăm, în mai multe momente de timp și în diferite regiuni ale SNC, tonusul inflamator indus de un HFD. Am constatat că, în funcție de regiunea SNC, un HFD afectează în mod diferit tonusul inflamator. Prin urmare, am investigat dacă modificările conținutului de lipide din SNC ar putea explica diferențele în tonul inflamator între regiunile SNC.
Metode
Animale și diete
Șoarecii masculi C57BL/6J de nouă săptămâni (Charles River) au fost găzduiți într-un mediu controlat (ciclu de lumină de 12 zile, luminile stinse la ora 18:00, temperatura și umiditatea controlate). La sosire, au fost împărțiți în mod aleatoriu în 12 grupuri de câte opt șoareci (patru șoareci/cușcă) și au fost climatizați timp de 1 săptămână. Apoi, șase dintre aceste grupuri au primit acces gratuit la o dietă standard (AIN 93-M, Research Diets, New Brunswick, SUA), iar restul de șase grupuri au primit acces gratuit la un HFD (D12492, Research Diets, New Brunswick, SUA ).). Pentru detalii despre compoziția ambelor diete, consultați fișierul suplimentar 1: Tabelul S1. Pentru acest experiment, am eutanasiat la fiecare moment selectat (adică, după 1, 2, 4, 6, 8 și 16 săptămâni) un grup sub dietă standard și un grup sub un HFD. Șoarecii au fost anesteziați cu izofluran după o perioadă de post de 6 ore și sacrificați prin luxație cervicală. Cortexul, cerebelul și trunchiul cerebral au fost recuperate cu atenție și rapid și congelate rapid în azot lichid. Au fost recoltate și cântărite diferitele depozite de țesut adipos (țesut adipos subcutanat (SAT), țesut adipos visceral (TVA), țesut adipos epididimal (EAT) și țesut adipos maro (BAT)). Toate țesuturile colectate au fost depozitate la -80 ° C până la o analiză ulterioară.
Am efectuat acest studiu în conformitate cu recomandarea europeană 2007/526/CE (care a fost transformată în Legea belgiană din 29 mai 2013), privind protecția animalelor de laborator. Comitetul local de etică a aprobat protocolul studiului (acordul de studiu 2010/UCL/MD/022; acordul de laborator LA1230314).
Cuantificarea colesterolului
Colesterolul total plasmatic a fost cuantificat, urmând instrucțiunile producătorului, în vena cavă folosind kitul Cholesterol FS10 (DiaSys Diagnostic and Systems, Holzheim, Germania), care se bazează pe o reacție enzimatică cuplată cu o detecție spectrofotometrică a produsului final.
Pregătirea ARN și analiza RT-qPCR
ARN-ul total din țesuturi a fost extras folosind reactivul TriPure (Roche, Basel, Elveția) conform instrucțiunilor producătorului. ADNc a fost sintetizat folosind un kit RT (Promega, GoScript ™ Reverse Transcription System) din 1 μg de ARN total. qPCR a fost efectuat cu un instrument și software StepOnePlus (Applied Biosystems, Foster City, CA, SUA). Reacțiile PCR au fost efectuate folosind un amestec SYBR Green (Promega, GoTaq® qPCR Master Mix). Am măsurat fiecare probă în duplicat în timpul aceleiași probe. Au fost utilizate următoarele condiții pentru amplificare: o etapă inițială de menținere de 10 min la 95 ° C, apoi 45 de cicluri constând în denaturare la 95 ° C timp de 3 s, recoacere la 60 ° C timp de 26 s și extindere la 72 ° C timp de 10 s. Produsele au fost analizate prin efectuarea unei curbe de topire la sfârșitul reacției PCR. Datele sunt normalizate la expresia ARN messenger (mARN) 60S proteină ribozomală L19 (RPL19) [42]. Secvențele primerilor utilizați sunt enumerate în Tabelul 1.
Cuantificarea lipidelor
Țesuturile (cerebel sau cortex) au fost omogenizate în apă (2,5 mL), iar apoi lipidele au fost extrase după acidificare, în prezența standardelor interne, prin adăugarea a 10 mL de cloroform (CHCl3) și 5 mL de metanol (MeOH). După amestecarea puternică și sonicare, probele au fost centrifugate și stratul organic a fost recuperat și uscat sub un curent de N2. Extractele lipidice rezultate au fost purificate prin extracție în fază solidă utilizând silice și eluate cu un amestec de CHCI3 și MeOH. Fracțiile lipidice rezultate au fost analizate prin HPLC-MS folosind un spectrometru de masă LTQ-Orbitrap (ThermoFisher Scientific) cuplat la un sistem HPLC Accela (ThermoFisher Scientific). Separarea analitelor a fost realizată folosind o precolumnă C-18 Phenomenex și o coloană Kinetex LC-18 (5 μm, 4,6 × 150 mm) (Phenomenex).
Pentru lizofosfosfatidilcoline, fosfatidilcoline și sfingomieline, fazele mobile A și B au fost compuse din MeOH-H2O 85:15 (v/v) și respectiv MeOH, cu 5 mM de CH3COONH4. Gradientul (0,25 ml/min) a fost conceput după cum urmează: tranziția de la 100% A la 100% B timp de 15 minute, urmată de 100% B liniar timp de 15 minute urmată de o reechilibrare ulterioară la 100% A. Analitele au fost ionizate folosind o sursă ESI acționată în modul pozitiv.
Pentru celelalte lizofosfosfolipide și pentru fosfolipide și sulfatide, fazele mobile A și B au fost compuse din MeOH-H2O-NH4OH 50: 50: 0,1 (v/v/v) și MeOH-NH4OH 100: 0,1 (v/v), respectiv. Gradientul (0,4 ml/min) a fost conceput după cum urmează: tranziția de la 100% A la 100% B timp de 30 de minute, urmată de 100% B liniar timp de 15 minute și urmată de o reechilibrare ulterioară la 100% A. Analite au fost ionizate folosind o sursă ESI acționată în modul negativ.
Pentru N-aciletanolamine și ceramide, fazele mobile A și B au fost compuse din acid MeOH-H2O-acetic 75: 25: 0,1 (v/v/v) și MeOH-acid acetic 100: 0,1 (v/v), respectiv. Gradientul (0,4 ml/min) a fost conceput după cum urmează: tranziția de la 100% A la 100% B timp de 15 minute, urmată de 100% B liniar timp de 45 minute, urmată de o reechilibrare ulterioară la 100% A. Analitele au fost ionizat utilizând o sursă APCI operată în modul pozitiv. Semnalele lipidelor au fost normalizate utilizând semnalul obținut pentru standardul intern corespunzător. Am folosit d4-PEA, 17: 1-lizofosfatidilinozitol, 17: 0-lizofosfatidilcolină, 17: 0-sulfatidă, 17: 0-ceramidă, 17: 0-sfingomielină și 17: 0/17: 0-PC. Datele sunt prezentate ca o creștere de ori în comparație cu nivelurile găsite la șoarecii martor.
Imunohistologie
Cultura și tratamentul celulelor gliale primare
Cuantificarea citokinelor plasmatice inflamatorii
Citokinele plasmatice IL-1β, IL-10 și factorul de necroză tumorală α (TNFα) au fost cuantificate utilizând un kit Bio-Plex Multiplex (Bio-Rad, Nazareth, Belgia) și măsurate utilizând tehnologia Luminex (Bio-Plex 200; Bio- Rad) urmând instrucțiunile producătorului.
analize statistice
Toate datele sunt prezentate ca medie ± s.e.m. Analiza statistică a fost efectuată folosind GraphPad Prism versiunea 5.0 pentru Windows (San Diego, CA). Am folosit Student’s cu două cozi t test pentru valori nepereche pentru a compara două grupuri și, atunci când este relevant, am folosit testul Mann-Whitney pentru evaluarea inflamației periferice. Am folosit ANOVA unidirecțional cu testul post al lui Bonferroni sau testul Kruskal-Wallis cu testul post al lui Dunn între grupul HFD și grupul său CTL respectiv (*P
rezultate si discutii
Caracterizarea fenotipului obez
Am monitorizat greutatea șoarecilor pentru diferitele grupuri de-a lungul studiului. Greutatea corporală a crescut deja după 4 zile de hrănire cu HFD și a crescut persistent în timp. În schimb, șoarecii grupurilor de control nu s-au îngrășat în mod semnificativ (Fișa suplimentară 2: Figura SI 1). De asemenea, am cântărit diferitele depozite de țesut adipos alb la fiecare moment selectat. Există o creștere susținută a țesuturilor adipoase subcutanate (SAT), epididimale (EAT) și viscerale (TVA) în timp (Fișier suplimentar 2: Figura SI 2). De asemenea, am măsurat colesterolemia șoarecilor la cele mai timpurii (1 săptămână) și cele mai recente (16 săptămâni). Am constatat o creștere clară pentru șoarecii hrăniți cu HFD în comparație cu controalele lor respective (fișier suplimentar 2: Figura SI 3a-b). Luate împreună, aceste date validează proprietățile obezogene ale dietei utilizate.
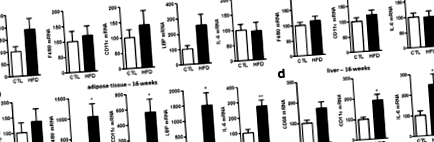
Inflamația periferică indusă de hrănirea HFD
Inflamația centrală indusă de hrănirea HFD
Obezitatea este un factor bine stabilit care contribuie la creșterea incidenței patologiilor periferice. De asemenea, este bine demonstrat că obezitatea induce inflamații în hipotalamus [21, 22, 27]. Cu toate acestea, se știe mult mai puțin despre efectele obezității asupra altor zone ale SNC. Am crezut că două regiuni, cerebelul și cortexul, prezintă un interes deosebit, deoarece obezitatea induce modificări morfologice în aceste două zone. Într-adevăr, pacienții obezi prezintă diferențe în densitatea materiei cenușii în aceste două regiuni specifice în comparație cu subiecții slabi [43, 44]. Obezitatea cu debut precoce este, de asemenea, asociată cu mai multe anomalii cerebeloase, cum ar fi leziunile neuronale, volumul mai mic și dezvoltarea compromisă [45, 46]. În ceea ce privește cortexul, acesta este un domeniu responsabil pentru controlul cognitiv al consumului de alimente [44, 47, 48]. Aceste modificări specifice ar putea fi fie o cauză, fie o consecință a obezității și să mențină în continuare disfuncționalități în comportamentele orientate spre alimentație.
Deoarece consecințele alimentării HFD asupra inflamației au fost clar diferite în cortex și cerebel, am căutat să stabilim dacă acest tonus inflamator redus a fost specific cortexului. Astfel, am măsurat tonusul inflamator din trunchiul cerebral, la săptămânile 1 și 16 și am găsit o expresie crescută a IL-1β, TNFα și MCP-1 la ambele puncte de timp (Fișier suplimentar 2: Figura SI 4), un profil similar cu cel observat în cerebel. Astfel, aceste rezultate sugerează în mod clar adaptări ale SNC dependente de regiune la HFD.
Pentru a explica aceste observații, am evaluat mai întâi expresia zonula occludens (ZO) -1, a claudinei 1 și 5 și a ocludinei, patru proteine care formează joncțiuni strânse ale barierei hematoencefalice [51, 52]. Într-adevăr, integritatea barierei hematoencefalice s-a dovedit a fi modificată în timpul obezității [53]. Nu am găsit nicio variație în expresia ZO-1 și a claudinei 5 în cortex sau cerebel în săptămâna 16. Cu toate acestea, expresia claudinei 1 și ocludină au fost semnificativ crescute în cerebel, în timp ce nicio variație nu a fost măsurată în cortex în săptămâna 16 (Adițional fișierul 2: Figura SI 5). De remarcat, s-a arătat că expresia ARNm a acestor proteine prezintă variații consistente cu proteinele detectate prin imunohistochimie [54].
Alimentarea cu HFD modifică nivelurile lipidelor din cerebel și cortex în săptămâna 16
După cum sa menționat în introducere, lipidele sunt implicate în controlul inflamației. Astfel, am decis să efectuăm o analiză largă a lipidelor prezente în cortex și cerebel concentrându-ne pe săptămâna 16, deoarece șoarecii au prezentat un ton inflamator distinct în acest moment specific. Am decis să ne concentrăm investigațiile asupra ceramidelor, dihidroceramidelor, sfingomielinelor, sulfatidelor și N-aciletanolaminele, precum și fosfolipidele și lizofosfolipidele, deoarece se știe că sunt implicate în inflamații [60-64]. La nivel global, speciile de ceramidă și dihidroceramidă măsurate aici nu au prezentat nicio variație în cortex sau în cerebel. În ceea ce privește speciile de sfingomielină, nivelurile acestora au fost crescute în cortex și nu au prezentat nicio variație a cerebelului. Dintre fosfolipidele și lizofosfolipidele studiate, am constatat că nivelurile de fosfatidilinozitoli, fosfatidiletanolamine și lizofosfatidilcoline au fost crescute în cortex la alimentarea cu HFD, în timp ce HFD a avut un efect mult mai redus asupra nivelurilor lor în cortex. De remarcat, am constatat, de asemenea, că nivelurile de palmitoiletanolamidă antiinflamatoare au crescut în cortex, dar nu și în cerebel, la alimentarea cu HFD (Fig. 4 și Fișa suplimentară 1: Tabelul S2-4).
Screening pe scară largă al lipidelor în cerebel (CBL) și cortex (CTX) în săptămâna 16. Fosfolipide, lizofosfolipide, ceramide, sfingomieline, N-aciletanolaminele, dihidroceramidele și sulfatidele au fost măsurate în cortexul și cerebelul șoarecilor CTL și HFD în săptămâna 16 prin HPLC-MS. Culoarea roșu reprezintă o creștere a nivelurilor de lipide la șoarecii HFD comparativ cu șoarecii CTL. Culoarea verde reprezintă o scădere a nivelurilor de lipide la șoarecii HFD în comparație cu șoarecii CTL. Datele numerice sunt raportate în fișierul suplimentar 1: Tabelul S2-4. ND nu a fost detectat. Pentru fosfolipide, este indicată suma lanțurilor acil R1 și R2, în timp ce pentru celelalte lipide este menționată lanțul R acil
Efectele lipidelor identificate asupra astrocitelor primare și microgliei co-cultivate
Concluzii
În acest studiu, am arătat că inflamația periferică de grad scăzut indusă de un HFD nu afectează diferitele regiuni ale SNC în același mod și că acest ton inflamator este, de asemenea, dependent de timp. În acest cadru special, am reușit să identificăm implicarea potențială a celulelor gliale și, mai precis, a astrocitelor. Interesant este faptul că aceste celule inflamatorii ale SNC sunt, de asemenea, implicate în controlul permeabilității barierei hematoencefalice. În cerebel, am găsit astrocite activate și o expresie crescută a claudinei 1 și a ocludinei. Această expresie crescută a proteinelor de joncțiune strânsă ar putea fi un mecanism potențial care vizează restabilirea integrității barierei hematoencefalice pentru a reduce insulta inflamatorie evidențiată în această zonă a SNC. Aceste modificări au fost absente în cortex, unde tonusul inflamator a fost similar cu cel al unuia dintre șoarecii hrăniți cu chow. Aceste constatări susțin în continuare că tonusul inflamator de grad scăzut care rezultă dintr-un HFD afectează diferențial cele două regiuni specifice ale SNC studiate.
Am caracterizat în continuare micro-mediul specific în aceste două zone ale SNC prin măsurarea nivelurilor de lipide bioactive. La testarea pe co-cultură primară a microgliei și astrocitelor, am identificat fosfatidilinozitolii, lizofosfatidilcolinele și PEA ca potențiali compuși antiinflamatori, deoarece au fost crescuți în cortexul șoarecilor HFD în săptămâna 16 și au putut, de asemenea, să scadă expresia markeri inflamatori ex vivo. Acest studiu demonstrează că nu toate regiunile SNC sunt egale atunci când se confruntă cu insulte inflamatorii determinate de obezitate. În cele din urmă, această lucrare deschide calea pentru cercetări suplimentare care se referă la efectele lipidelor identificate ca fiind compuși antiinflamatori în obezitate și în alte setări inflamatorii care influențează SNC.
- Dieta bogată în grăsimi s-a dovedit a alimenta metastaza cancerului prin hrănirea timpurilor tehnice de sănătate a proteinelor care răspândesc cancerul
- Dieta bogată în grăsimi perturbă compoziția microbiomului, provoacă inflamații în insuficiența cardiacă
- Dieta bogată în grăsimi cu utilizare de antibiotice legată de inflamația intestinală EurekAlert! Știri științifice
- Dieta pe termen lung, bogată în grăsimi, perturbă metabolismul lipidelor și provoacă inflamații la șobolanii masculi adulți
- Dieta maternă bogată în grăsimi a întrerupt procesul metabolic cu un singur carbon și reglarea epigenetică în