Perspective microscopice în metabolismul celular al lipidelor
Lipidele sunt pe buzele tuturor în zilele noastre, indiferent dacă sunt acizi grași ω-3/6, colesterol bun și rău sau doar grăsime simplă care are obiceiul enervant de a se acumula pe șolduri. Bolile grave precum obezitatea, arterioscleroza și diabetul zaharat de tip 2 sunt direct legate de tulburările metabolismului lipidic. Sistemul model drojdie („drojdia de panificație”) oferă posibilități excelente pentru explorarea bolilor asociate lipidelor, inclusiv utilizarea microscopiei de înaltă rezoluție.
Autori
Subiecte și etichete
Grăsimea ca factor de risc
În conformitate cu importanța sa centrală pentru organism, metabolismul lipidic este controlat de diverse mecanisme de reglare. Cu toate acestea, aceste mecanisme sunt suprasolicitate de stilul nostru de viață modern de prea multă mâncare și lipsa de exercițiu. Dezvoltarea dramatică a bolilor asociate lipidelor în țările industrializate a avut tendința de a propaga o imagine negativă a substanțelor lipidice. Cu toate acestea, grăsimea într-o mare varietate de forme este un ingredient indispensabil al tuturor celulelor. Chiar și trigliceridele mult maligne joacă un rol vital ca tampon pentru acizii grași în exces și potențial periculoși din circulația noastră sau ca depozit de energie.
Abia recent s-a găsit o principală enzimă degradantă a grăsimilor (ATGL, adipoză trigliceridă lipază) în țesutul adipos [1], demonstrând că cercetarea în materie de grăsimi este, acum ca oricând, o „mină de aur” pentru descoperirea de noi factori cheie relevanți din punct de vedere biomedical (vezi și: AUR - Genomica tulburărilor asociate lipidelor, un proiect realizat în cadrul programului austriac de cercetare a genomului GEN-AU și proiectul special de cercetare LIPOTOX, sponsorizat de FWF [Fondul științei austriece]).
O privire mare asupra celulelor mici
Pe lângă tehnicile molecular-biologice, genomice și proteomice, microscopia cu lumină de înaltă rezoluție este importantă pentru obținerea unor cunoștințe inovatoare în sinteza lipidelor celulare, dinamica lipidelor și a membranelor și modificările morfologice în legătură cu tulburările metabolismului lipidic.
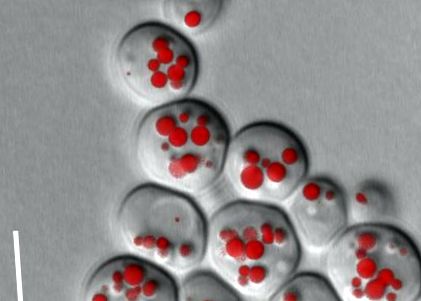
Cu diametrul său de 5-8 μm, celula de drojdie a fost considerată un specimen nepotrivit pentru examinarea microscopică ușoară. De fapt, progresul tehnologic realizat în microscopie în ultimii câțiva ani prin tehnici de imagistică îmbunătățite și obiective excelente poate rezolva acum structurile subcelulare ale celulelor de drojdie (Figura 1). Microscopia cu scanare laser confocală oferă avantaje speciale pentru analiza tridimensională a celulelor observate în condiții fiziologice pe parcursul mai multor generații [2]. Problemele de difracție și lumina vagabondă sunt minime datorită grosimii subțiri a celulei. Rezoluția tipică laterală și axială este de aprox. 150 nm și, respectiv, 350 nm. Reconstrucția tridimensională realizată prin înregistrarea unui număr mare de „secțiuni optice” și detectarea simultană a mai multor fluorofori oferă o perspectivă complet nouă asupra interacțiunilor spațiale și dinamice ale proteinelor și lipidelor din celulele vii.
Disponibilitatea variantelor de proteine fluorescente (de exemplu, GFP - proteină fluorescentă verde) în legătură cu tehnici de clonare extrem de simple a creat baza pentru studii de localizare și exprimare a tuturor proteinelor proteomei drojdiei (dintre care există aproximativ 6.000) [3]. Protocoalele de pregătire solide pentru microscopia celulelor vii și colorarea vitală permit observarea simultană a populațiilor mari de celule, o bază excelentă pentru colectarea datelor de microscopie cantitativă.
Prin grosime și subțire - drojdie în cercetarea metabolismului lipidelor
Grăsimile de depozitare se găsesc în celulă sub formă de picături de grăsime. Cu toate acestea, acestea nu sunt depozite de grăsime pasive, ci organite dinamice cu numeroase proteine și funcții biochimice specifice. Biogeneza picăturilor lipidice este strâns legată de sinteza grăsimilor de stocare: dacă sinteza este oprită din cauza mutației, nu se formează picături lipidice și se produc celule de drojdie „subțiri”. Acești mutanți reacționează deosebit de sensibil la excesul de acizi grași care nu mai pot fi încorporați în grăsimea de stocare. Această lipotoxicitate a acizilor grași este, de asemenea, observată într-o formă similară în celulele animale. Prin urmare, putem deduce că sinteza stocării grăsimilor este o supapă esențială pentru a face ca excesul de acizi grași să fie dăunător din punct de vedere metabolic. Biogeneza și dinamica acestor picături lipidice pot fi imaginate la microscopul de înaltă rezoluție prin colorare cu coloranți vitali sau proteine marcate cu GFP (Figura 2).
Dacă enzimele care împart grăsimea sunt oprite prin mutație, aceasta duce la o acumulare de trigliceride în celulă și se produc celule de drojdie „obeze”. Acest defect duce, de asemenea, la o creștere scăzută, sugerând că degradarea grăsimilor oferă produse metabolice importante pentru creșterea celulară [4]. Enzimele Tgl3 și Tgl4 care sunt implicate în procesul de divizare a grăsimii în drojdie sunt legate structural de ATGL și funcția lor poate fi parțial înlocuită cu ATGL de șoarece. Această constatare confirmă gradul ridicat de conservare funcțională și structurală a enzimelor metabolismului lipidic dintre drojdie și celulele animale.
Organizarea spațială a metabolismului lipidic
Metabolismul lipidic este răspândit pe diferite zone ale celulei și este supus unui proces complex de control. Pentru a caracteriza organizarea spațială, aproximativ 600 de proteine ale metabolismului lipidic au fost localizate ca fuziuni GFP la rezoluție înaltă [5]. Printre alte observații, acest studiu a condus la identificarea proteinelor necunoscute anterior ale picăturilor lipidice. În prezent, toate aprox. 6.000 de fuziuni GFP exprimate cromozomial sunt examinate cu ajutorul microscopiei confocale cu scanare laser și datele de localizare sunt puse la dispoziția comunității științifice în baza de date special localizată Yeast Protein Localization, YPL.db [6] (Figura 3). Se poate demonstra clar că localizarea proteinelor nu este statică, ci este influențată decisiv de starea de dezvoltare a celulelor și de tulburările metabolismului lipidic.
Ecrane cu conținut ridicat bazate pe microscopie
Disponibilitatea unor colecții extinse de mutanți de drojdie (aproximativ 4.500 de mutați viabili de deleție) și coloranți de fluorescență adecvați pentru depozitele de lipide determină utilizarea unor ecrane bazate pe microscopie pentru mutanții metabolismului lipidelor. Un ecran bazat pe microscopie efectuat recent a identificat de fapt un omolog cu drojdie de seipină care este defect la pacienții cu lipodistrofie congenitală Bernardinelli-Seip 2. Absența acestei proteine în drojdie duce la o morfologie a picăturilor lipidice tulburate [7, 8]. Aceasta implică faptul că identificarea și caracterizarea factorilor conservați de depozitare a lipidelor în drojdie are un potențial extraordinar de înțelegere a cauzelor moleculare ale tulburărilor metabolismului lipidic la om.
- Șoarecii masculi obezi produc mai multe celule imune care promovează boala decât femeile Michigan Medicine
- Femeile slabe au un risc mai mare de a dezvolta endometrioză decât studiază femeile obeze - ScienceDaily
- Hawaienii obezi învață de la strămoșii subțiri Dieta Nutriționiștii oferă un plan cu alimente antice
- Adulții obezi și supraponderali au slăbit semnificativ în dietele vegetariene, vegane MDedge Endocrinology
- Obezi la 25 de ani Pregătiți-vă să suferiți mai târziu Science Tech Times