Zheng Wang
1 Laborator cheie de nutriție și metabolism, Institutul de Științe Nutritive, Institutele de Științe Biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Ling Yang
1 Laborator cheie de nutriție și metabolism, Institutul de științe nutriționale, Institutele de științe biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Yuhui Jiang
1 Laborator cheie de nutriție și metabolism, Institutul de științe nutriționale, Institutele de științe biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Zhi-Qiang Ling
2 Institutul de cercetare a cancerului din Zhejiang, Spitalul de cancer din provincia Zhejiang, Centrul pentru cancer din Zhejiang, Hangzhou, China,
Zhigang Li
1 Laborator cheie de nutriție și metabolism, Institutul de științe nutriționale, Institutele de științe biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Yuan Cheng
1 Laborator cheie de nutriție și metabolism, Institutul de Științe Nutritive, Institutele de Științe Biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Heng Huang
1 Laborator cheie de nutriție și metabolism, Institutul de științe nutriționale, Institutele de științe biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Lingdi Wang
1 Laborator cheie de nutriție și metabolism, Institutul de Științe Nutritive, Institutele de Științe Biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Yi Pan
1 Laborator cheie de nutriție și metabolism, Institutul de Științe Nutritive, Institutele de Științe Biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Zhenzhen Wang
1 Laborator cheie de nutriție și metabolism, Institutul de Științe Nutritive, Institutele de Științe Biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Xiaoqiang Yan
3 Generon Corporation, Zhang Jiang Hi-Tech Park, Shanghai, China,
Yan Chen
1 Laborator cheie de nutriție și metabolism, Institutul de științe nutriționale, Institutele de științe biologice din Shanghai, Academia de Științe din China, Școala de absolvire a Academiei de Științe din China, Shanghai, China,
Conceput și proiectat experimentele: Y. Chen. Au efectuat experimentele: Zheng Wang LY YJ ZL Y. Cheng HH LW. Analizate datele: Z-QL YP Zhenzhen Wang Y. Chen. Reactivi/materiale/instrumente de analiză contribuite: XY. Am scris lucrarea: Zheng Wang Y. Chen.
Abstract
Interleukina 22 (IL-22) este o citokină secretată de celule T care modulează răspunsul inflamator în țesuturile nehematopoietice, cum ar fi epiteliul și ficatul. Funcția IL-22 în țesutul adipos este în prezent necunoscută. Am generat un model de șoarece transgenic cu supraexprimarea IL-22 în special în țesutul adipos. Șoarecii transgenici IL-22 nu au avut modificări aparente în obezitate și rezistență la insulină după hrănirea cu o dietă bogată în grăsimi (HFD). În mod neașteptat, toți șoarecii transgenici IL-22 hrăniți cu HFD timp de patru luni au dezvoltat tumori spontane în țesutul adipos epididimal. Analiza histologică a indicat faptul că tumorile au fost liposarcoame bine diferențiate cu infiltrarea celulelor inflamatorii. Supraexprimarea IL-22 promovează producerea de citokine inflamatorii precum IL-1β și IL-10 și stimulează fosforilarea ERK în țesutul adipos. Mai mult, tratamentul IL-22 în adipocite 3T3-L1 diferențiate ar putea induce expresia IL-1β și IL-10, împreună cu stimularea fosforilării ERK. Luat împreună, studiul nostru a stabilit nu numai un nou model de șoarece cu liposarcom spontan, dar a relevat, de asemenea, că supraexprimarea IL-22 poate colabora cu obezitatea indusă de dietă pentru a avea un impact asupra dezvoltării tumorii la șoarece.
Introducere
Pe lângă rolul său principal în modularea inflamației, IL-22 contribuie la creșterea celulelor tumorale și la apoptoză. S-a raportat că IL-22 poate promova creșterea și supraviețuirea celulelor în celulele HepG2 prin activarea STAT3 și inducerea expresiei unei varietăți de proteine anti-apoptotice și mitogene [11]. În carcinomul pulmonar cu celule mici (NSCLC), supraexprimarea IL-22 a protejat liniile celulare ale cancerului pulmonar de apoptoză, în timp ce reglarea descendentă a IL-22 a inhibat în mod semnificativ creșterea celulelor tumorale umane la șoarecii BALB/c nud [13]. În schimb, în celulele de cancer mamar, s-a constatat că IL-22 reduce efectiv creșterea celulelor tumorale, corelată cu o inhibare a fosforilării ERK și AKT și cu inducerea opririi ciclului celular [14]. Prin urmare, efectul IL-22 asupra dezvoltării cancerului pare să fie dependent de contextul celular.
Grupul nostru a descoperit recent că IL-22 joacă un rol protector în steatoza hepatică indusă de dieta bogată în grăsimi prin reglarea în jos a expresiei genelor legate de lipogeneză, inclusiv factori critici de transcripție și enzime pentru sinteza lipidelor [15]. În acest studiu, am investigat în continuare funcția potențială a IL-22 asupra țesutului adipos prin generarea unui model de șoarece transgenic cu expresie specifică adipoză a IL-22. Interesant este că șoarecii cu supraexprimare a IL-22 în țesutul adipos nu au avut nici un fenotip aparent și nici o modificare metabolică atunci când au fost hrăniți cu o dietă bogată în grăsimi. Cu toate acestea, șoarecii transgenici IL-22 au dezvoltat liposarcoame spontane în țesutul adipos după hrănirea pe termen lung cu dietă bogată în grăsimi, indicând faptul că dieta poate interacționa cu modificări inflamatorii asociate cu supraexprimarea IL-22 în tumorigeneză în țesutul adipos.
Materiale și metode
Generarea de șoarece transgenic IL-22
Toate animalele au fost ținute și utilizate în conformitate cu liniile directoare ale Comitetului instituțional pentru îngrijirea și utilizarea animalelor din cadrul Institutului pentru Științe Nutritive, Academia Chineză de Științe (CAS), cu acces gratuit la chow-ul standard al șoarecilor și la apa de la robinet. Toate procedurile experimentale au fost efectuate în conformitate cu comisia de etică CAS cu numărul de aprobare 2010-AN-8. ADNc-ul IL-22 de șoarece cu lungime completă a fost amplificat prin RT-PCR cu ADNc timus de șoarece. După confirmarea prin secvențierea ADN-ului, ADNc-ul șoarecelui a fost donat în vectorul pBS-aP2-sv40pA (de la Addgene, Cambridge, MA, SUA). Pentru a genera șoareci transgenici, caseta transgenică a fost excizată din plasmidă și utilizată în microinjecție în pronuclei de ovocite fertilizate ale tulpinii ICR de șoareci. Șoarecii transgenici au fost genotipați prin PCR cu ADN genomic cu primeri 5'-AAACATACAGGGTCTGGTCAT-3 'și 5'-GCATAAAGGTGCGGTTGA -3'. Toți șoarecii utilizați în acest studiu au fost de fond ICR.
Extracția ADN genomic, izolarea ARN-ului, transcrierea inversă și PCR (RT-PCR) și RT-PCR cantitativă în timp real (qRT-PCR)
Analiza aportului alimentar, testul de toleranță la glucoză (GTT) și testul de toleranță la insulină (ITT)
Șoarecii masculi de tip sălbatic masculin și IL-22 transgenici cu vârsta de 1 lună au fost hrăniți fie cu chow normal (SLACOM, Shanghai, China), fie cu o dietă bogată în grăsimi (conținând 60% calorii din grăsimi, de la Research Diets Inc. New Brunswick, NJ, STATELE UNITE ALE AMERICII). Aportul de alimente a fost înregistrat la fiecare două zile. Pentru GTT și ITT, șoarecii au fost postiti peste noapte, urmată de injecția intraperitoneală de glucoză (1 g/kg greutate corporală, pentru GTT) sau insulină (1 U/kg greutate corporală, respectiv pentru ITT). Nivelurile de glucoză din sânge în diferite momente după injectare au fost determinate de un glucometru electronic (Freestyle Freedom, Abbott Diabetes Care, Alameda, CA, SUA).
Colorarea hematoxilinei-eozină și imunohistochimie
Țesutul adipos alb epididimal proaspăt (eWAT) și tumorile au fost fixate în soluție salină tamponată cu formolă/fosfat 10% și apoi încorporate cu parafină. Secțiunile au fost supuse colorării hematoxilin-eozinei (HE) standard și imunohistochimiei așa cum s-a descris anterior [16].
Cultură de celule 3T3-L1, diferențiere, tratament IL-22 și imunoblotare
Celulele fibroblaste de șoarece 3T3-L1 au fost obținute de la Bank/Stem Cell Bank, Institutul de Științe Biologice din Shanghai, Academia Chineză de Științe. Celulele au fost crescute sub 5% CO2 în mediu standard care conțin Mediul modificat Eagles al Dulbecco (GIBCO, Carlsbad, CA, SUA), 10% ser fetal bovin (FBS) și 0,1% amestec de penicilină-streptomicină (GIBCO). Pentru diferențierea adipocitelor, celulelor 3T3-L1 li s-a permis să ajungă la confluență și la două zile după confluență (ziua 0), celulele au fost induse să se diferențieze în medii de 10% CO2 cu un mediu care conține 10% ser fetal bovin, 10 µg/ml insulină, 1 uM dexametazonă și 0,5 mM IBMX timp de 2 zile. Ulterior, s-a adăugat mediu post-diferențiere care conținea numai insulină și 10% FBS și celulele au fost cultivate încă 2 zile. De atunci, mediul de cultură a fost completat la fiecare 2 zile cu mediu standard. Celulele 3T3-L1 complet diferențiate au fost tratate timp de 48 de ore cu 500 ng/ml IL-22 recombinant așa cum s-a descris anterior [15]. Celulele tratate cu IL-22 au fost apoi utilizate pentru RT-PCR și imunoblotare așa cum s-a descris anterior [15]. Anticorpul fosfo-ERK1/2 a fost achiziționat de la Cell Signaling Technology (Danvers, MA, SUA). Anticorpul total ERK1/2 a fost de la Santa Cruz Biotechnology (Santa Cruz, CA, SUA). Anticorpul pentru tubulină a fost de la Sigma-Aldrich (St. Louis, MO, SUA).
Măsurarea concentrației serice de IL-22
Concentrația de proteine din serul de șoarece IL-22 a fost măsurată printr-un kit ELISA de la eBioscience (San Diego, CA, SUA) urmând instrucțiunile producătorului.
analize statistice
Toate datele au fost analizate prin testul t al Studentului cu două cozi nepereche și exprimate ca medie ± deviație standard.
Rezultate
Generarea și caracterizarea șoarecilor transgenici cu expresie IL-22 în țesuturile adipoase
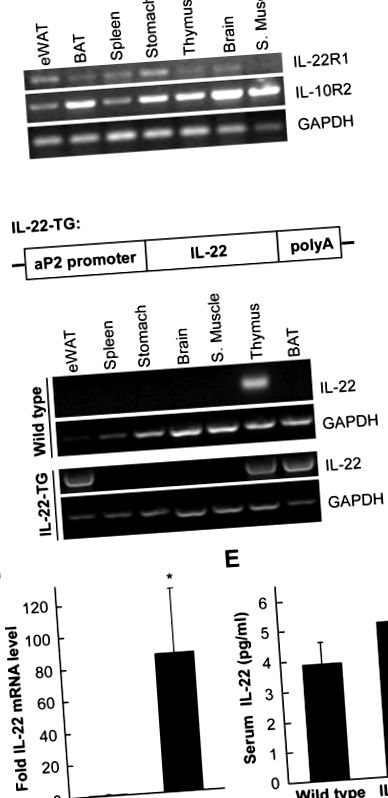
Studiul nostru anterior a indicat că IL-22 are un efect asupra lipogenezei hepatice [15]. Prin urmare, am speculat că IL-22 ar putea avea o funcție în țesutul adipos. IL-22 își exercită efectul prin interacțiunea cu doi receptori cu membrană, un receptor specific IL-22R1 și o componentă comună IL-10R2 [17]. Am analizat dacă țesuturile adipoase exprimă acești doi receptori. Diferite țesuturi de șoarece au fost utilizate pentru a izola ARN-ul total, urmat de analiza cu RT-PCR (Figura 1A). Am constatat că ambii receptori IL-22 au fost prezenți în multe țesuturi de șoarece, inclusiv țesutul adipos alb epididimal (eWAT) și țesutul adipos brun (BAT), indicând faptul că IL-22 poate juca un rol funcțional în aceste țesuturi.
(A) Receptorii IL-22 sunt prezenți în țesuturile adipoase. Diferite țesuturi au fost izolate de la șoareci ICR și utilizate în RT-PCR pentru a detecta nivelurile de expresie ale IL-22R1 și IL-10R2. GAPDH a fost folosit ca control de încărcare. eWAT înseamnă grăsime albă epididimă și BAT pentru grăsime brună. (B) O diagramă pentru a descrie constructul transgenic. ADNc-ul IL-22 de șoarece cu lungime completă a fost donat în aval de promotorul aP2. (C) Analiza nivelurilor de ARNm de IL-22 la șoareci de tip sălbatic și IL-22 transgenici (IL-22-TG). Diferite țesuturi de șoarece au fost utilizate în RT-PCR pentru a detecta nivelurile de ARNm de IL-22. Rețineți că, în comparație cu controlul de tip sălbatic, expresia IL-22 a fost semnificativ crescută la eWAT și BAT la șoarecii IL-22-TG. (D) Analiza nivelului IL-22 al eWAT de șoarece prin RT-PCR cantitativă în timp real (qRT-PCR). Nivelul relativ de expresie al IL-22 comparativ cu β-actina a fost prezentat ca medie ± SD (n = 7 pentru fiecare grup). * indică p Figura 1B). Caseta transgenică a fost microinjectată în pronuclei ouălor de șoarece ICR fertilizate pentru a genera șoareci transgenici IL-22 (IL-22-TG). Șoarecii IL-22-TG au fost apoi încrucișați cu șoareci ICR pentru a genera descendenți utilizați în studiu. La șoareci de tip sălbatic, ARNm IL-22 a fost prezent în principal în timus (Figura 1C). Cu toate acestea, la șoarecii IL-22-TG, IL-22 a fost extrem de exprimată în eWAT și BAT (Figura 1C), confirmând o supraexprimare cu succes a IL-22 în țesuturile adipoase sub promotorul aP2 la șoarecii transgenici. Am analizat în continuare expresia IL-22 în eWAT folosind metoda RT-PCR cantitativă în timp real. Am constatat că nivelul ARNm IL-22 la șoarecii IL-22-TG a fost semnificativ crescut în comparație cu animalele de tip sălbatic (Figura 1D). Cu toate acestea, nivelul proteinelor din sânge IL-22 nu a fost afectat în mod semnificativ de supraexprimarea IL-22 în țesuturile adipoase.
Supraexprimarea IL-22 în țesutul adipos nu are niciun efect aparent asupra metabolismului
(A până la C) Greutatea corporală, aportul alimentar și greutatea grăsimii albe epididimale (eWAT) de șoareci de tip sălbatic și șoareci IL-22-TG hrăniți fie cu chow normal (NC), fie cu dietă bogată în grăsimi (HFD) timp de 4 luni și respectiv două grupuri). (D, E) Testul de toleranță la glucoză (D) și testul de toleranță la insulină (E) au fost efectuate cu șoareci de tip sălbatic și IL-22-TG după ce au fost hrăniți cu HFD timp de 4 luni (n = 7 și respectiv 8 pentru cele două grupuri).
Dieta bogată în grăsimi a indus formarea liposarcoamelor spontane la șoareci IL-22-TG
În mod neașteptat, am constatat că hrănirea pe termen lung cu HFD a fost capabilă să inducă formarea de tumori spontane în țesutul adipos. Atât șoarecii de tip sălbatic, cât și șoarecii IL-22-TG au fost hrăniți cu chow normal sau HFD timp de 4 luni. În mod surprinzător, 100% dintre șoarecii IL-22-TG hrăniți cu HFD au dezvoltat tumori spontane în țesutul adipos epididimal (Figura 3A). Cu toate acestea, niciunul dintre șoarecii de tip sălbatic hrăniți cu șoareci HFD sau IL-22-TG hrăniți cu chow normal nu au avut tumori în țesutul adipos (Figura 3A). Toate tumorile formate la șoareci se aflau în epididim, majoritatea având necroză la mijloc (Figura 3B). Nu am observat metastaze ale tumorii la alte organe la șoareci (date neprezentate).
(A) Rezumatul incidenței tumorale spontane în țesutul adipos epididimal la șoarecii hrăniți cu chow normal (NC) sau dietă bogată în grăsimi (HFD) pentru o perioadă de timp diferită. HFD a fost început la șoareci la vârsta de 1 lună. Rețineți că formarea spontană a tumorii la 100% șoareci IL-22-TG după hrănire cu HFD timp de 4 luni. (B) Imagini reprezentative ale epididimului de tip sălbatic și al șoarecilor IL-22-TG. Săgeata indică tumori spontane formate la șoarecii IL-22-TG hrăniți cu HFD timp de 4 luni.
Analiza histologică cu colorarea hematoxilin-eozinei (HE) a arătat că țesutul adipos adiacent tumorii a fost similar cu cel de tip sălbatic (Figura 4A). Cu toate acestea, forma adipocitelor la șoarecii IL-22-TG nu a fost la fel de regulată ca cea a adipocitelor la șoarecii de tip sălbatic (Figura 4A). Colorarea HE cu probele tumorale a arătat că aceste tumori erau cel mai probabil liposarcoame de tip bine diferențiat (Figura 4B). Microscopic, tumoarea a fost compusă din foi largi și dungi de adipocite amestecate cu lipoblaste ocazionale, separate de septuri fibroase care conțin celule fusiforme cu nuclee hipercromatice și ușor pleomorfe. Au fost observate, de asemenea, celule cu inel semetric asemănător țesutului adipos normal și lipoblaste multivacuolare. Dimensiunea celulelor adipoase a fost variabilă, iar unele leziuni ale tumorii au fost infiltrate de un număr mic până la moderat de celule inflamatorii cronice. Au fost, de asemenea, observate nuclee mari și atipii minore ale celulelor. Prin urmare, s-a făcut un diagnostic de liposarcom "de tip lipom" bine diferențiat pe baza aspectului histopatologic al tumorilor (Figura 4B).
(A) Colorarea HE a țesutului adipos epididimal la șoarecele de tip sălbatic și a țesutului adiacent al tumorii la șoarece IL-22-TG. (B) Colorarea HE a probelor de liposarcom la șoareci IL-22-TG. Imaginile din panoul din dreapta sunt imagini amplificate ale inserției din interiorul imaginilor din panoul din stânga (marcate cu linie continuă albastră).
IL-22 promovează producerea de citokine inflamatorii și fosforilarea ERK în țesutul adipos și adipocite
S-a propus că inflamația contribuie la tumorigeneză [18], iar IL-22 are un rol funcțional în modularea răspunsului inflamator în țesuturile periferice [3], [4]. Am emis ipoteza că răspunsul inflamator mediat de IL-22 ar putea, cel puțin parțial, să contribuie la dezvoltarea tumorilor în țesutul adipos. Pentru a aborda această ipoteză, am analizat efectul supraexprimării IL-22 asupra expresiei unui set de citokine legate de inflamație în țesutul adipos. Interesant, am constatat că nivelurile de ARNm de IL-1β și IL-10 au fost semnificativ crescute de supraexprimarea IL-22 în țesutul adipos (Figura 5A). Nivelul ARNm al INF-γ nu a fost modificat în mod semnificativ prin supraexprimarea IL-22 (Figura 5A). Mai mult, nivelurile de mARN ale TNF-α și IL-6 au fost, de asemenea, semnificativ crescute de supraexprimarea IL-22 (Figura 5A). Aceste date indică faptul că supraexpresia IL-22 ar putea induce expresia unui subset de citokine inflamatorii în țesutul adipos, contribuind probabil la dezvoltarea liposarcoamelor spontane la șoarece la hrănirea cu HFD.
Am folosit apoi un model de celule pentru a analiza în continuare funcția IL-22 asupra inflamației și activării ERK în adipocite. Preadipocitele 3T3-L1 au fost induse la adipocite mature cu ajutorul protocolului de diferențiere clasic „cocktail”. Receptorii IL-22 IL-22R1 și IL-10R2 au fost amândoi prezenți în adipocite 3T3-L1 diferențiate (Figura 6A), indicând faptul că aceste celule sunt susceptibile să răspundă la IL-22. Interesant este că tratamentul celulelor pare să crească expresia IL-22R1 (Figura 6A). Similar cu descoperirile din țesutul adipos de șoarece (Figura 5A), tratamentul cu IL-22 a reușit să ridice semnificativ expresia IL-1β și IL-10 în adipocite diferențiate 3T3-L1 (Figura 6B). Cu toate acestea, IL-22 nu a avut niciun efect asupra expresiei INF-γ, TNF-α și IL-6 (Figura 6B). Mai mult, IL-22 ar putea stimula fosforilarea ERK într-o manieră dependentă de timp (Figura 6C). Colectiv, aceste descoperiri indică faptul că expresia citokinelor inflamatorii indusă de IL-22 și activarea ERK pot contribui la formarea liposarcoamelor spontane la șoarecii IL-22-TG hrăniți cu HFD.
(A) Receptorii IL-22 sunt exprimați în celule diferențiate 3T3-L1. Nivelurile de ARNm de IL-22R1 și IL-10R2 au fost analizate prin RT-PCR. GAPDH a fost folosit ca control de încărcare. Celulele au fost tratate cu IL-22 recombinant (500 ng/ml) timp de 24 de ore, după cum sa indicat. (B) Expresia IL-1β și IL-10 au fost crescute prin tratamentul IL-22. Celulele 3T3-L1 diferențiate au fost tratate cu IL-22 recombinant (500 ng/ml) timp de 24 de ore și ARN-ul total a fost izolat și utilizat în RT-PCR cantitativă în timp real pentru a detecta nivelurile de expresie ale IL-1β, IL-10, INF-γ, TNF-α și IL-6. Datele sunt prezentate ca medie ± SD (n = 3 pentru fiecare grup). ** indică p Dumoutier L, Louahed J, Renauld JC. Clonarea și caracterizarea factorului inductibil derivat din celule T legate de IL-10 (IL-TIF), o citokină nouă legată structural de IL-10 și inductibilă de IL-9. J Immunol. 2000; 164: 1814–1819. [PubMed] [Google Scholar]
- Dieta bogată în grăsimi induce hipersensibilitatea căilor respiratorii la șoareci Rapoarte științifice
- Dieta bogată în grăsimi și exercițiile fizice conduc la un metilom ADN perturbat și patogen în ficatul șoarecelui
- Dieta ketogenică și inflamația țesutului adipos - o poveste simplă Șansă de grăsime! Natura Metabolismului
- Îmbunătățirea polarizării macrofagelor adipoase la șoarecii knock-out GHSR obezi induși în dietă bogată în grăsimi
- Efectele pe termen lung ale lipidelor bogate și ale alimentației cu conținut ridicat de energie asupra lipidelor serice, a compoziției acizilor grași din creier,