Fabio Morellini
1 Institut pentru biosinteza structurilor neuronale, Centrul pentru Neurobiologie Moleculară Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Germania
2 Grup de cercetare Biologie comportamentală, Centrul pentru Neurobiologie Moleculară Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Germania
Aleksey Malyshev
3 Departamentul de Neurofiziologie, Universitatea Ruhr Bochum, Bochum, Germania
4 Institutul de activitate nervoasă superioară și neurofiziologie, Academia Rusă de Științe, Moscova, Rusia
Maxim Volgushev
3 Departamentul de Neurofiziologie, Universitatea Ruhr Bochum, Bochum, Germania
4 Institutul de activitate nervoasă superioară și neurofiziologie, Academia Rusă de Științe, Moscova, Rusia
5 Departamentul de Științe Psihologice, Universitatea din Connecticut, Storrs, CT, Statele Unite
Marina Chistiakova
3 Departamentul de neurofiziologie, Universitatea Ruhr Bochum, Bochum, Germania
5 Departamentul de Științe Psihologice, Universitatea din Connecticut, Storrs, CT, Statele Unite
Giorgi Papashvili
1 Institut pentru biosinteza structurilor neuronale, Centrul pentru Neurobiologie Moleculară Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Germania
Laetitia Fellini
1 Institut pentru biosinteza structurilor neuronale, Centrul pentru Neurobiologie Moleculară Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Germania
Ralf Kleene
1 Institut pentru biosinteza structurilor neuronale, Centrul pentru Neurobiologie Moleculară Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Germania
Melitta Schachner
6 Center for Neuroscience, Shantou University Medical College, Shantou, China
7 Keck Center for Collaborative Neuroscience și Departamentul de biologie celulară și neuroștiințe, Universitatea Rutgers, Piscataway, NJ, Statele Unite
Alexandru Dityatev
1 Institut pentru biosinteza structurilor neuronale, Centrul pentru Neurobiologie Moleculară Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Germania
8 Grupul de Neuroplasticitate Moleculară, Centrul German pentru Boli Neurodegenerative (DZNE), Magdeburg, Germania
9 Facultatea de Medicină, Universitatea Otto-von-Guericke, Magdeburg, Germania
10 Center for Behavioral Brain Sciences (CBBS), Magdeburg, Germania
Abstract
Introducere
Tenascin-C (TNC) este exprimat în mod vizibil în diferite țesuturi în timpul dezvoltării. În sistemul nervos central în curs de dezvoltare, TNC este implicat în reglarea proliferării celulelor precursoare ale oligodendrocitelor și a astrocitelor. Expresia TNC este subregulată în creierul adultului, cu excepția zonelor care mențin neurogeneza până la maturitate, cum ar fi hipocampul și hipotalamusul (Wiese și colab., 2012). După vătămare, expresia TNC este reglată în sus în neuronii care răspund la insultă. TNC susține regenerarea măduvei spinării prin promovarea creșterii axonale și a formării sinapselor în măduva spinării caudală la locul leziunii (Yu și colab., 2011).
Afectarea selectivă a LTP indusă de protocoalele care implică activarea L-VGCC la șoareci TNC -/- sugerează că deficiența TNC duce la afectarea expresiei și/sau funcționalității acestor canale, care sunt compuse din 3-4 subunități: poro- formând subunitatea α1 și β auxiliară, precum și subunitățile α2δ și γ (Hofmann și colab., 1994). În creierul mamiferelor, Cav1.2 și Cav1.3 sunt cele două subunități α1 majore ale L-VGCC care constituie o cale importantă de intrare Ca 2+ în neuroni.
Aici, am încercat să legăm mai strâns deficiența observată de LTP la șoareci TNC -/- la o funcție redusă a canalelor de calciu de tip L și la deficitele comportamentale. Arătăm că la șoareci TNC -/-, nivelul de exprimare a celor două subunități L-VGCC α1 nu este scăzut, dar afluxul de Ca 2+ prin L-VGCC este redus semnificativ. Arătăm în continuare o afectare dependentă de L-VGCC în dispariția amintirilor de frică contextuale la șoareci TNC -/-. Concluzionăm că funcționalitatea afectată a L-VGCC poate fi motivul afectării deficienței LTP și a comportamentului la șoarecii TNC -/-.
Materiale și metode
Șoarecii TNC -/- (Evers și colab., 2002) au fost consangvinizați pe fundalul C57BL/6. Masculii TNC -/- și TNC +/+ de sex masculin în vârstă de zece până la doisprezece săptămâni au fost obținuți din reproducerea heterozigotă și au fost ținute sub un ciclu de lumină inversat de 12: 12 h: luminile stinse la 07:00) și condițiile standard de adăpostire (23 ± 1 ° C; 50% umiditate; alimente și apă ad libitum). Testele comportamentale au fost efectuate într-o cameră experimentală adiacentă facilității pentru animale și iluminate cu lumină roșie slabă. Experimentele au fost efectuate în mijlocul fazei întunecate a ciclului. Toate materialele au fost curățate cu apă cu săpun, apă și etanol (75%) între șoareci. Experimentele au fost efectuate în conformitate cu Directiva Consiliului Comunității Europene (86/609/CEE), iar procedurile utilizate au fost aprobate de statul Hamburg. S-a avut grijă să minimizeze durerea sau disconfortul pentru animale.
Analiza expresiei Cav1.2 și Cav1.3
Anticorpii policlonali împotriva subunităților Cav1.2 și Cav1.3 ale L-VGCC au fost furnizați cu amabilitate de R. Westenbroek și W. Catterall și sunt descriși în altă parte (Hell și colab., 1996). Anticorp monoclonal împotriva gliceraldehidei-3-fosfat dehidrogenazei de iepure (GAPDH) a fost obținut de la Chemicon International (Temecula, CA, SUA).
Analiza imunohistochimică a expresiei Cav1.2 și Cav1.3 a fost efectuată așa cum a fost descris de Kochlamazashvili și colab. (2010). Pentru Western blot, hipocampii au fost omogenizați în 200 μl tampon TE (50 mM Tris/HCI, 5 mM EDTA, pH 8). După determinarea concentrației de proteine folosind testul BCATM Protein (Thermo Scientific, Rockford, IL, SUA), 50 μg proteine pe bandă au fost supuse SDS-PAGE pe 10% geluri urmate de analiza Western blot. Proteinele au fost transferate într-o membrană de nitroceluloză (Protran, Schleicher și Schuell, Dassel, Germania), iar membrana a fost blocată cu lapte praf uscat fără grăsimi 5% în PBS, pH 7,5. Membrana a fost incubată cu anticorp primar (1: 1000) peste noapte la 4 ° C cu agitare, spălată în PBS cu 0,05% Tween (PBS-T) și sondată cu anticorp secundar HRP conjugat (1: 10000 în PBS conținând 5% lapte praf) timp de 1 oră. După spălare, imunodetecția a fost efectuată folosind substratul chemiluminiscent cu durată extinsă (Pierce, Bonn, Germania) pe filme cu raze X (Kodak Biomax-ML, Sigma-Aldrich). Intensitățile benzilor au fost cuantificate densitometric folosind software-ul de imagine TINA 2.09 (DesignSoft Inc., Budapesta, Ungaria).
Înregistrări ale LTP în felii de hipocamp
Imagistica Ca 2+
Condiționarea fricii contextuale
Droguri pentru experimente comportamentale
Nifedipina (25 mg/kg) a fost suspendată în vehicul 10% Cremophor EL/PBS și diltiazemul (15 mg/kg) a fost suspendat în soluție salină (0,9% NaCI în apă). Injecțiile intraperitoneale au fost efectuate cu 50 min (nifedipină) sau 20 min (diltiazem) înainte de procesul de rechemare și protocolul de extincție efectuat în ziua 2 a testului contextual de condiționare a fricii.
Analize statistice
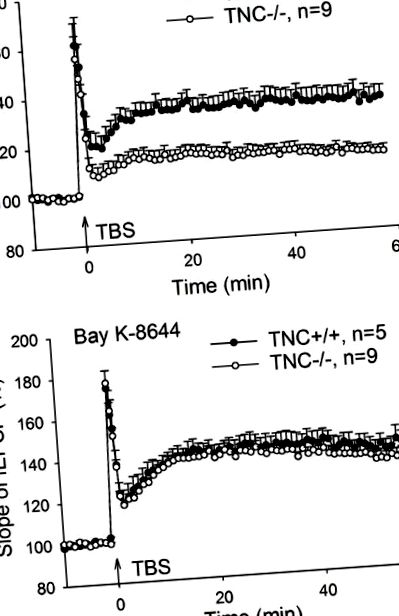
Comparațiile între două grupuri au fost efectuate cu testul t cu două cozi. Datele comportamentale au fost evaluate utilizând o analiză multifactorială a varianței (ANOVA) urmată de teste post-hoc Newman-Keuls, atunci când este cazul: ANOVA bidirecțional (cu „genotip” și „tratament” între factori de grup), genotip mixt bidirecțional ”ca între factorii de grup și „timp” ca în cadrul factorului de grup) și ANOVA mixtă cu trei căi (cu „genotip” și „tratament” ca între factorii de grup și „timp” ca în cadrul factorului de grup). Toate testele au fost cu două cozi, iar nivelul de semnificație a fost stabilit la p -/- Șoarecii sunt salvați prin activarea tranzitorie a L-VGCC în timpul inducției LTP
Restabilirea potențării pe termen lung CA1 (LTP) la șoareci tenascin-C (TNC -/-) de către activatorul Bay L-VGCC) de tip activator de canal Ca 2+ (L-VGCC). (A) Patru trenuri de stimulare theta-burst (TBS) ale fibrelor colaterale/comisurale Schaffer au indus LTP afectat în regiunea CA1 a șoarecilor TNC -/-. (B) LTP în șoareci TNC -/- poate fi readus la niveluri de tip sălbatic de către activatorul L-VGCC Bay K-8644 (10 μM). Se arată valorile medii și valorile SEM, panta medie a potențialului postsinaptic excitator de câmp (fEPSP) înregistrată cu 10 minute înainte de inducerea LTP a fost setată la 100%.
Expresia canalului L-VGCC nu este redusă la hipocampii șoarecilor TNC -/-
Am efectuat mai întâi analize imunohistochimice pentru a estima dacă deficiența de TNC afectează expresia generală sau localizarea subunităților Cav1.2 și Cav1.3 α1 ale L-VGCC neuronale. Nu a fost detectată nicio reducere a expresiei oricărei subunități a canalului în zona CA1 a hipocampului (Figura (Figura 2). 2). În concordanță cu un studiu anterior (Hell și colab., 1996), am observat cea mai puternică expresie a L-VGCCs în somata și dendritele proximale ale neuronilor piramidali CA1, dar aceste canale au fost evidente și în partea distală a arborilor dendritici.
Imunoreactivitate pentru subunitățile Cav1.2 și Cav1.3 ale L-VGCC neuronale în zonele CA1 ale șoarecilor TNC +/+ și TNC -/-. Cel mai puternic semnal a fost observat la somata și dendritele apicale ale celulelor situate în stratul piramidal. Nu a existat nicio diferență evidentă în expresie între genotipuri, deși s-a observat o ușoară creștere a expresiei Cav1.3 la șoareci TNC -/- prin compararea imaginilor de la trei perechi de șoareci de tip sălbatic și knockout. Bara de măsurare: 200 μm, aplicabilă tuturor panourilor.
Apoi, am efectuat o analiză semicantitativă Western blot cu cantități egale de proteine din omogenat total preparat din hipocampii șoarecilor TNC -/- și TNC +/+. Am folosit anticorpi policlonali purificați prin afinitate împotriva subunităților Cav1.2 și Cav1.3 ale L-VGCC neuronale, care au recunoscut două benzi de 210-220 și 180-190 kDa (Hell și colab., 1996). Nivelurile totale ale acestor două forme au fost cuantificate prin densitometrie și normalizate față de nivelurile GAPDH. Nivelurile de GAPDH au fost aproape identice în sondele comparate, arătând că este un control adecvat de încărcare și expresie care poate fi utilizat pentru normalizarea nivelurilor de L-VGCC. Rezultatele au indicat expresia crescută, mai degrabă decât redusă, a acestor două forme de subunități Cav1.2 și Cav1.3 în hipocampusul șoarecilor TNC -/- comparativ cu șoarecii TCN +/+ (Figura (Figura 3). 3). Trebuie subliniat faptul că, pe lângă benzile cu greutăți moleculare înrudite pentru subunitățile canalului, se observă benzi suplimentare de identitate necunoscută în Western blots cu acești anticorpi (Figura (Figura 2). 2). Prin urmare, am decis că aceste benzi suplimentare nu vor fi măsurate.
Expresie crescută a L-VGCCs în hipocampus de șoareci TNC -/-. Omogenizații de hipocamp din TNC -/- și TNC +/+ au fost supuși analizei Western blot folosind anticorpi împotriva subunităților Cav1.2 și Cav1.3 ale L-VGCCs și împotriva gliceraldehidei-3-fosfat dehidrogenazei (GAPDH) pentru a controla încărcarea. (A) Sunt prezentate Western blots reprezentative. (B) Cantitățile de Cav1.2 și Cav1.3 variind de la
220 kDa (indicat prin linii verticale) au fost determinate prin densitometrie și normalizate la nivelurile GAPDH. Asteriscurile din (A) indica benzi de identitate necunoscută. Mijloacele și SEM ale nivelurilor de expresie (4 animale pentru fiecare genotip) au fost corelate cu valoarea medie măsurată pentru TNC +/+ hipocampi, care a fost setată la 100%, *** p -/- șoareci, sugerând că afectarea L- Mecanismele LTP dependente de VGCC la șoareci TNC -/- se datorează modificării fie a proprietăților funcționale, fie a expresiei suprafeței celulare a acestor canale.
Influența de Ca 2+ prin L-VGCC este redusă și insensibilă la nifedipină în TNC -/- neuroni piramidali CA1
Pentru a testa în mod direct dacă deficitul de TNC duce la afectarea activității L-VGCC, am măsurat influxul de Ca 2+ în neuronii TNC -/- și TNC +/+ folosind imagistica Ca 2+. Am umplut celulele piramidale CA1 cu vopseaua sensibilă Ca 2+ Oregon Green 488 BAPTA-1 și am înregistrat modificări ale fluorescenței induse de TBS sau trenuri de impulsuri de depolarizare aplicate printr-o pipetă patch (Figurile 4A, B). Pentru a evalua contribuția L-VGCCs, am măsurat influxul de Ca 2+ în condițiile de control și după adăugarea de nifedipină la mediul de înregistrare. Diferența dintre semnalele Ca 2+ înregistrate în aceste două condiții caracterizează contribuția L-VGCC. Am relevat o diferență semnificativă între componentele sensibile la nifedipină la șoarecii TNC +/+ și TNC -/-. La șoarecii TNC +/+, aplicarea nifedipinei a condus la o reducere clară a semnalelor de Ca 2+ în somatele neuronilor piramidali CA1 ca răspuns la TBS. La șoarecii TNC +/+, semnalele Ca 2+ au fost reduse cu
10% (până la 90,1% din control, reducere cu 9,9 ± 3,1%, n = 13, p = 0,008). În schimb, la șoareci TNC -/-, aplicarea nifedipinei nu a redus semnalele Ca 2+ (101,3% din control, schimbare de 1,3 ± 3,6%, n = 10; p = 0,726; Figurile 4C, D). Diferența dintre genotipuri în reducerea semnalelor de Ca 2+ de către nifedipină (și, astfel, în contribuția canalelor de tip L în cele două genotipuri) a fost semnificativă (p = 0,022).
Astfel, intrarea Ca 2+ mediată de L-VGCCs în timpul TBS sau activării post-sinaptice directe asemănătoare tetei este afectată în hipocampusul șoarecilor TNC -/-. Aceste rezultate oferă un sprijin puternic pentru ipoteza că TNC reglează activitatea L-VGCCs în zona CA1 a hipocampului (Evers și colab., 2002). În continuare, am întrebat dacă acest mecanism joacă un rol în reglarea comportamentului dependent de hipocamp.
Achiziționarea și păstrarea memoriei de frică pe termen lung sunt normale, dar dispariția este afectată la șoarecii TNC -/-
Efecte reduse ale blocantelor L-VGCC asupra comportamentului la șoareci TNC -/-
La șoareci TNC -/-, blocantul L-VGCC nifedipină nu afectează influxul de Ca 2+ în neuronii piramidali CA1 (Figura (Figura 4) 4) și nici nu reduce dimensiunea LTP (Evers și colab., 2002). Am întrebat astfel dacă efectele comportamentale ale nifedipinei ar fi, de asemenea, afectate la șoarecii TNC -/-. Se știe că blocada farmacologică a L-VGCCs inhibă dispariția fricii (Cain și colab., 2002; Izquierdo și colab., 2016), deși rămâne o chestiune de dezbatere dacă aceste efecte se datorează afectării proceselor cognitive specifice care mediază dispariția. sau cauzată de o inhibiție motorie mai generalizată (Waltereit și colab., 2008; Singewald și colab., 2015). Am efectuat teste contextuale de condiționare și extincție a fricii, așa cum este descris mai sus, folosind șoareci TNC +/+ și TNC -/- injectați fie cu vehicul, fie cu blocanți VGCC de tip L nifedipină sau diltiazem cu 20 de minute înainte de procesul de extincție din ziua 2. confirmați că efectele posibile induse de blocada farmacologică a VGCC de tip L nu sunt cauzate de efectele secundare descrise deja pentru nifedipină (Waltereit și colab., 2008).
În concluzie, efectele inhibitoare ale blocantelor L-VGCC asupra extincției au fost mai puțin pronunțate la șoarecii TNC -/- decât la șoarecii TNC +/+, indicând o ocluzie a mecanismelor implicate.
Discuţie
În prezentul studiu, am arătat că LTP-ul dependent de L-VGCC în hipocampii TNC -/- nu este cauzat de expresia redusă a subunităților L-VGCC α1, dar este cel mai probabil datorită unui aflux redus de Ca 2+ prin Canalele de tip L. Mai mult, datele noastre comportamentale sugerează că activitatea redusă a L-VGCC poate sta la baza dispariției afectate a fricii condiționate observată la șoarecii cu deficit de TNC.
Datele noastre de imagistică Ca 2+ arată în mod direct, pentru prima dată, că tranzitorii Ca 2+ dependenți de L-VGCC provocați de TBS de intrare CA3 la celulele piramidale CA1 sunt afectate la șoareci TNC -/-. Deoarece nu există o reducere a expresiei subunităților Cav1.2 și Cav1.3 majore ale L-VGCC și funcția de promovare a LTP a canalelor poate fi salvată prin aplicarea acută a activatorului canalului L Bay K-8644, concluzionăm că, în absența constitutivă a TNC, L-VGCCs sunt exprimate, dar sunt mai puțin active decât în prezența TNC.
Este de remarcat faptul că dispariția fricii condiționate ar putea fi inhibată parțial doar de nifedipină și diltiazem la șoareci TNC -/-, în timp ce a fost complet abolită de acești blocanți L-VGCC la șoareci TNC +/+. Această observație sugerează că alte mecanisme independente de L-VGCC sunt responsabile de dispariția reziduală la șoareci TNC -/-. Este posibil ca astfel de mecanisme să fie activate ca răspuns compensator la activitatea redusă a canalelor de tip L în absența TNC. Într-adevăr, am observat că expresia subunităților Cav1.2 și Cav1.3 a fost îmbunătățită în TNC -/- vs. Hipocampi TN +/+, sugerând că apar mecanisme compensatorii pentru a sprijini funcția celulară adecvată și comportamentul adaptativ la șoarecii TNC -/-.
Interesant, la pacienții cu boala Alzheimer (AD), TNC este co-exprimat în plăci Aβ (Mi și colab., 2016). În plus, într-un model de AD de șoarece, expresia TNC este reglată în sus, în timp ce deficitul de TNC reduce pro-, dar îmbunătățește funcțiile antiinflamatorii în modelul AD și este asociat cu o sarcină redusă Aβ cerebrală și niveluri mai ridicate ale densității postsinaptice proteine 95 (Xie și colab., 2013). Având în vedere rolul TNC în reglarea L-VGCC (date actuale) și a depresiei pe termen lung (Evers și colab., 2002), este plauzibil să presupunem că o reducere a depresiei dependente de L-VGCC se poate suprapune cu -efecte inflamatorii ale deficitului de TNC și contribuie la păstrarea utilajului postsinaptic în modelul AD. Mai mult decât atât, sa constatat că variabilitatea genetică a L-VGCC are efecte pleiotrope asupra psihopatologiei asociate cu tulburarea spectrului autismului, tulburarea deficitului de atenție-hiperactivitate, tulburarea bipolară, tulburarea depresivă majoră și schizofrenia (Grupul de tulburări încrucișate al consorțiului psihiatric de genomică, 2013 ). Deoarece TNC pare a fi un regulator major al activității L-VGCC, este foarte tentant să speculăm că TNC este legat de unele dintre aceste tulburări.
Contribuțiile autorului
FM, MV, RK, MS și AD au proiectat experimentul. FM, AM, MV, MC, GP, LF și RK au colectat și analizat datele. FM, MV, MS și AD au scris și revizuit manuscrisul; toți autorii au aprobat versiunea finală a manuscrisului.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
- Munții pierduți din Karoo dezvăluie secretele paginii de geologie a evenimentului de extincție masivă
- Vreau să rămân curbată - frica mea de slăbire
- Limitarea mobilității extremităților inferioare și afectarea funcției musculare la femeile cu ulcer
- Hipoxemia intermitentă ușoară la șoarecii neonatali determină deficit neurofuncțional permanent și alb
- Cum să te descurci cu frica de a îngrășa din nou în timp ce ești în formă De la Fată la Grăsime