Abstract
fundal
Studiul actual a urmărit să investigheze siguranța perfuziei intraperitoneale intraperitoneale intraoperatorii și postoperatorii timpurii (IEPCHIP) la diferite temperaturi într-un model porcin de gastrectomie distală experimentală cu reconstrucție Billroth II.
Metode
Treizeci de porci au fost împărțiți în mod aleatoriu în 5 grupe. Au fost utilizate două grupuri ca grupuri de control (grupurile A1 și A2) și 3 grupuri au fost utilizate ca grupuri de perfuzie (grupurile B, C și D). Porcii din grupa A1 au primit gastrectomie distală numai cu reconstrucție Billroth II. Porcii din grupele A2, B, C și D au primit aceeași intervenție chirurgicală ca și grupul A1, urmat de IEPCHIP la 37 ± 0,5 ° C, 42,5 ± 0,5 ° C, 43,5 ± 0,5 ° C sau 44,5 ± 0,5 ° C, respectiv. Timpul de perfuzie a fost evaluat pentru fiecare porc din grupa A2, precum și din grupurile de perfuzie, iar perfuziile au fost efectuate de două ori pentru fiecare grup. Prima perfuzie a fost efectuată intraoperator, iar a doua perfuzie a fost inițiată la o zi după operație. Au fost colectate date privind semnele vitale și funcția hepatică și renală. S-au comparat parametrii privind vindecarea anastomotică, patologia țesutului anastomotic și aderența abdominală.
Rezultate
Semnele vitale și funcțiile hepatice și renale ale porcilor din grupele A1, A2, B și C nu au fost afectate semnificativ de această procedură. În schimb, semnele vitale și funcțiile hepatice și renale ale porcilor din grupa D au fost semnificativ afectate. În comparație cu porcii din grupele A1, A2 sau B, presiunea de rupere anastomotică, rezistența la rupere și conținutul de hidroxiprolină la porcii din grupele C și D au fost semnificativ mai mici. Nu au fost observate diferențe semnificative în acești parametri între grupurile A1, A2 și B. Aderența abdominală a fost mai severă la porcii din grupa D. Depunerea de colagen la porcii din grupele A1, A2 și B a fost densă în anastomoză, iar infiltrarea celulelor inflamatorii a fost observată în grupul D.
Concluzii
IEPCHIP la 42,5 ± 0,5 ° C a fost sigur și a cauzat afectări minime. Cu toate acestea, vindecarea anastomotică a fost afectată de perfuzie la 43,5 ± 0,5 ° C și 44,5 ± 0,5 ° C, iar aderența abdominală a fost cea mai severă la animalele din grupul D, care au fost perfuzate la 44,5 ± 0,5 ° C.
fundal
Peste 900.000 de cazuri noi de cancer gastric sunt diagnosticate în întreaga lume în fiecare an, iar 42% din aceste cazuri apar în China [1]. În plus, mai mult de 30% din cancerele gastrice avansate coexistă cu diseminarea peritoneală, iar timpul mediu de supraviețuire pentru acești pacienți este de aproximativ 6 luni [2, 3].
Chiar și după gastrectomie radicală, mai mult de 50% dintre pacienții cu cancer gastric avansat pot muri de recurență peritoneală [3, 4]. În ultimii ani, supraviețuirea îmbunătățită asociată cu chimioterapia de perfuzie intraperitoneală hipertermică pentru carcinomatoza peritoneală a cancerului gastric [5, 6] a fost verificată atât de cercetările experimentale [7], cât și de cele clinice [5, 8]. Mai mult, chirurgia citoreductivă plus chimioterapia hipertermică de perfuzie intraperitoneală a devenit tratamentul prioritar pentru cancerele gastrice cu carcinomatoză peritoneală [9], iar supraviețuirea poate fi prelungită prin chimioterapie intraoperatorie și postoperatorie timpurie intraperitoneală [10, 11]. Acest tratament poate duce la eliminarea în timp util a celulelor canceroase libere rezultate din factori operativi sau diseminare spontană. Astfel, perfuzia hipertermică intraperitoneală este considerată eficientă pentru prevenirea și/sau tratarea carcinomatozei peritoneale și promovarea supraviețuirii [5, 12].
Cu toate acestea, chimioterapia cu perfuzie intraperitoneală hipertermică crește complicațiile perioperatorii și mortalitatea în cazurile de cancer gastric avansat [13-18]. Ratele de morbiditate și mortalitate din 1999 până în 2010 au fost între 12% și 66,3% și între 0% și respectiv 12,5% [3].
Se consideră că perfuzia timpurie duce la o creștere suplimentară a riscului de complicații postoperatorii și de mortalitate. În consecință, siguranța perfuziei hipertermice timpurii a devenit o problemă importantă. Repararea anastomotică, după reconstrucția tractului digestiv, este considerată unul dintre cei mai importanți factori implicați în siguranța postoperatorie. Când malunionul anastomotic duce la scurgeri, poate declanșa infecții abdominale, obstrucții adezive ale intestinului, strictură anastomotică și chiar șoc septic [14-16]. Deși calitatea vieții redusă nu ar trebui să fie un motiv pentru a nega această terapie [19], unii anchetatori consideră că hipertermia plus chimioterapia afectează vindecarea rănilor [20]. Mai mult, chimioterapia cu perfuzie intraperitoneală hipertermică după o intervenție chirurgicală gastro-intestinală crește probabilitatea scurgerii anastomotice și a mortalității perioperatorii [17, 21].
În general, celulele canceroase sunt efectiv eliminate prin perfuzie hipertermică dacă temperatura depășește 42 ° C [22, 23], deși hipertermia mai mare de 45 ° C duce la afectarea ireversibilă a hepatocitelor [24]. Klaver și colegii săi au examinat tratamentul adjuvant după o intervenție chirurgicală citoreductivă pentru carcinomatoza peritoneală la un model de șobolan, iar investigațiile lor privind perfuzia hipertermică intraperitoneală la 37 sau 41 ° C necesită studii suplimentare [25].
Mai mult, s-au efectuat puține studii pentru a examina intervalul de temperatură sigur și optim pentru perfuzia intraoperatorie și postoperatorie timpurie continuă hipertermică intraperitoneală (IEPCHIP) în tratamentul carcinomatozei peritoneale a cancerului gastric. Astfel, am efectuat o investigație a IEPCHIP într-un model porcin de gastrectomie distală experimentală cu reconstrucție Billroth II pentru a examina siguranța acestei proceduri la un interval de temperatură de la 37 la 45 ° C.
Metode
Acest studiu a fost realizat în conformitate cu principiile Declarației de la Helsinki, iar comisiile de revizuire instituționale ale instituțiilor respective au examinat și aprobat proiectarea acestuia.
Construirea și gestionarea modelelor
Au fost folosiți 30 de Bama Minipigs sănătoși și maturi (15 femele și 15 bărbați). Animalele au fost furnizate de mini incubatorul de porci din orașul Taizhou, provincia Jiangsu. Greutatea medie a acestor animale a fost de 20 ± 2 kg.
Toți porcii au fost posti 12 ore înainte de operație. Procedura a fost efectuată sub anestezie intravenoasă și inhalatorie. Aceeași echipă de chirurgi a efectuat toate procedurile pentru a asigura uniformitatea tehnică.
Porcii Bama au fost împărțiți în mod aleatoriu în 5 grupe. Grupurile A1 și A2 au servit ca grupuri de control, iar grupurile B, C și D au reprezentat grupurile de perfuzie hipertermică. Porcii din grupa A1 au suferit gastrectomie distală cu reconstrucție Billroth II (Figura 1A). Celelalte grupuri au primit IEPCHIP după ce au trecut prin aceeași procedură ca și grupul A1.
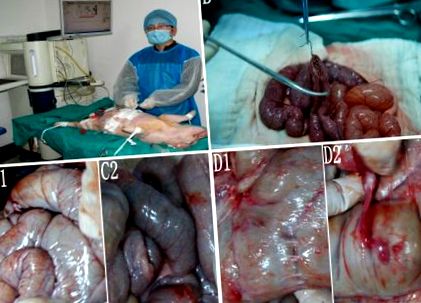
Procedura și aderența postoperatorie. A, Enteroenterostomie. B, Perfuzie hipertermică în modelul porcine. C1 și C2, Nu s-a observat aderență postoperatorie în grupuri A 2 și B. D1 și D2, Filme postoperatorii și aderență densă au fost observate în grup D.
Preoperator, abdomenul a fost pregătit prin bărbierit. După ce s-a realizat o anestezie satisfăcătoare în condiții sterile, am efectuat o rezecție distală a stomacului și am construit o gastrojejunostomie și o jejunojejunostomie de la capăt la capăt printr-o incizie mediană folosind 3–0 suturi de mătase (Ethicon, Norderstedt, Germania). În grupurile A2, B, C și D, două catetere de ieșire au fost plasate sub diafragmă și 2 catetere de intrare au fost plasate în cavitatea pelviană a fiecărui porc (Figura 1B). Cateterele au fost fixate pe pielea înconjurătoare cu suturi de mătase de 1-0 (Ethicon, Norderstedt, Germania). Toate inciziile cutanate au fost apoi suturate pentru a închide abdomenul.
Procedura IEPCHIP
După perfuzie, am folosit mai multe benzi pentru a oferi protecție inciziei abdominale. Nici un porc nu a primit alimente timp de 24 de ore postoperator și toate animalele au fost tratate intravenos cu 80.000 UI gentamicină și 0,5 g metronidazol într-o soluție de glucoză și clorură de sodiu la o doză de 40 ml/kg. În a treia zi, a fost administrată o dietă lichidă fără zgură, iar în a șasea zi, animalele au primit o dietă semi-fluidă și au fost tranziționate treptat la o dietă normală. Perfuzia hipertermică intraperitoneală postoperatorie a fost realizată și la porci sub anestezie sistemică cu picioarele fixate. Tramadol la 30 mg pe zi a fost administrat pentru ameliorarea durerii; acest tratament a fost continuat timp de 3 zile de succes după operație.
Parametrii observați
Am măsurat frecvența respiratorie, tensiunea arterială, temperatura anală și ritmul cardiac la porci cu 2 ore înainte, în timpul și 2 ore după procedură. De asemenea, am observat starea postoperatorie a animalelor experimentale, incluzând defecația, dieta, modificările de activitate și greutate și am clasificat performanța fiecărui animal după operație.
Sângele venos periferic a fost extras din toate animalele înainte de operație și la 1 zi, 3 zile, 7 zile și 14 zile după operație. S-au evaluat nivelurile de transaminază glutamico-piruvică (ALT), albumină (ALB), bilirubină totală (TBIL), azot uree din sânge (BUN) și creatinină (CR).
Animalele au fost sacrificate la 14 zile după procedură, moment în care a fost efectuată o autopsie.
Măsurarea presiunii de rupere anastomotică, rezistența la rupere și conținutul de hidroxiprolină
Hidroxiprolina oferă un indice al concentrației de colagen, deoarece este cel mai frecvent aminoacid din colagen. O metodă colorimetrică chimică, cu reactivi analitici puri, a fost utilizată pentru a calcula conținutul de hidroxiprolină conform următoarei formule: conținut de hidroxiprolină (μg/mg greutate umedă) = (absorbanță a tubului spectrofotometru - absorbanță a tubului gol/absorbanță standard a tubului - absorbanță a tubului gol ) × conținutul de substanță standard (5 μg/ml) × volumul total de hidrolizat (10 ml)/greutatea umedă a organizației (mg).
Examen patologic
Țesutul anastomotic a fost excizat și fixat într-o soluție de 4% formaldehidă utilizând proceduri de rutină și standard. Secțiunile seriale de 5 μm ale blocurilor de parafină au fost preparate și colorate cu hematoxilin-eozină (HE). Aceste probe au fost evaluate cu microscopie optică.
analize statistice
Toate datele experimentale au fost analizate cu SPSS18.0 Statistical Software (SPSS Inc, Chicago, IL, SUA). Datele referitoare la funcțiile hepatice și renale au fost exprimate ca mijloace ± SD. Diferențele dintre grupuri au fost analizate și comparate folosind o analiză a varianței și testul Newman-Keuls. P valori mai mici de 0,05 au fost considerate semnificative statistic.
Rezultate
Nu au apărut complicații majore în timpul intervențiilor chirurgicale sau de perfuzie.
Aderența abdominală și anastomoza
Aderența nu a fost detectată în grupurile A1, A2 (Figura 1, C1) sau B (Figura 1, C2). Doar 1 caz cu aderență membrană a fost observat în grupa C. Aderența membrană și aderența densă au fost observate la 3 porci din grupa D (Figura 1D1, D2).
Presiunea medie de rupere, rezistența la rupere și conținutul de hidroxiprolină din anastomoza stomacului-jejun și anastomoza jejunului-jejunului din grupele C și D au fost mai mici decât valorile observate în grupele A1, A2 și B (Figura 2).
Patologie
Formarea fibrelor de colagen în interiorul anastomozei a fost vizibilă după colorarea HE. Comparativ cu cel al grupurilor B, C și D, colagenul a fost depus mai dens în anastomozele grupurilor A1 și A2, cu granulare și formare tisulară mai bune, iar repararea stratului mucos a fost superioară în cele 2 grupuri (Figura 3, A1 și A2). În grupul B, depunerea de colagen a fost densă în anastomoză (Figura 3B), iar depunerea neregulată de colagen a fost prezentă în cantități mai mici în grupul C decât în grupul B (Figura 3C). Depunerea de colagen a fost mai puțin densă în grupa D și a fost însoțită de infiltrare celulară inflamatorie (Figura 3D).
Examinarea patologică a țesutului anastomotic. A1 și A2, Colagenul a fost depus dens în anastomoză, cu o mai bună reparare a stratului mucos în grupuri A1 și A2. B, Colagenul a fost depus dens în anastomoza grupului B animale. C, Depunerea redusă și neregulată de colagen a fost observată în anastomoza grupului C animale. D, Depunerea redusă și neregulată de colagen și infiltrarea celulelor inflamatorii au fost observate în grupul anastomoză D animale.
Semne vitale perioperatorii
În comparație cu valorile obținute înainte de perfuzie, temperatura corpului porcilor din grupele A1 și A2 a fost stabilă, la fel ca frecvența cardiacă, frecvențele respiratorii și presiunile arteriale medii în timpul procedurii. În plus, după perfuzia animalelor din grupele B și C, temperaturile corpului au crescut cu o medie de aproximativ 1 ° C, ritmul cardiac a crescut la o medie de 105 bătăi pe minut, frecvența respiratorie a crescut de 35 de ori pe minut, iar presiunea arterială medie a scăzut cu aproximativ 25 mmHg. La două ore după procedură, semnele vitale au atins niveluri normale la aceste animale. În grupa D, temperatura medie a crescut cu 1,5 ° C, ritmul cardiac a crescut la aproximativ 120 de bătăi pe minut, frecvența respiratorie a crescut de 40 de ori pe minut și presiunea arterială medie a scăzut cu aproximativ 35 mmHg. Semnele vitale ale acestor animale nu au revenit la niveluri normale în decurs de 2 ore de la procedură.
Recuperare postoperatorie
Toți porcii au fost predispuși în cea mai mare parte a primei zile. Toți porcii din grupele A1, A2, B și C au fost capabili să stea și să meargă la o zi după procedură. După 2 zile, animalele au putut să bea și să mănânce. După procedură, doar 1 porc din grupa C a vomitat de două ori în prima zi. În plus, starea mentală și performanța animalelor au fost corecte. Cu toate acestea, animalele din grupa D nu au putut sta în a doua zi după procedură și trei porci au gemut continuu. Două zile mai târziu, animalele puteau să bea doar, dar în a treia zi, acești porci au început să mănânce. În grupa D, un porc a prezentat vărsături de 2 ori în prima zi; iar un alt porc a vomitat de 6 ori/zi timp de 3 zile succesive.
Funcția hepatică și renală
Nivelurile de ALT, TBIL și ALB la porci din grupele A1 și A2 au rămas stabile. La temperaturi de perfuzie de 37 ± 0,5 ° C, 42,5 ± 0,5 ° C și 43,5 ± 0,5 ° C, o perfuzie hipertermică intraperitoneală continuă de 60 de minute nu a avut nicio influență semnificativă asupra funcției hepatice sau renale. După o săptămână, grupele de porci A1 și A2 s-au recuperat la niveluri normale. În schimb, la o temperatură de 44,5 ± 0,5 ° C, o perfuzie hipertermică intraperitoneală continuă de 60 de minute a afectat grav funcțiile hepatice și renale ale animalelor. Această afectare a funcției renale și hepatice a durat cel puțin 2 săptămâni. Parametrii legați de funcțiile hepatice și renale sunt prezentați în tabelele 1, 2 și 3 pentru porcii din grupele B, C și D.
Discuţie
Chimioterapia intraperitoneală hipertermică intraoperatorie (IHIC) singură și IHIC combinate cu chimioterapia intraperitoneală postoperatorie timpurie au fost efectuate în studiile anterioare [10, 26-28]. Supraviețuirea îmbunătățită a fost raportată în aceste studii, deși cu anumite niveluri de mortalitate și complicații severe [11, 29]. Scopul IEPCHIP este de a distruge celulele canceroase libere și de a îndepărta micro leziunile la o perioadă timpurie după operația citoreductivă.
În timpul procesului de perfuzie, semnele vitale ale animalelor studiate au variat între grupurile de perfuzie. Porcii din grupele A1, A2, B și C s-au recuperat rapid și au mâncat și au băut mai devreme după operație, decât porcii din grupa D. După cum s-a demonstrat mai sus, perfusatul de 44,5 ± 0,5 ° C a avut un impact semnificativ și durabil asupra vitalității animalelor semne și dietă.
Ficatul poate fi, de asemenea, afectat de anestezie și chimioterapie hipertermică intraperitoneală. Într-un studiu anterior, funcțiile hepatice și renale ale șoarecilor dintr-un grup de chimioterapie hipertermică intraperitoneală tratate la 41 ° C nu au fost semnificativ diferite de un grup de temperatură normală care a primit o aplicare a unei formulări de paclitaxel și beta-ciclodextrină [30]. În aceste studii, s-a considerat că stresul termic provoacă leziuni hepatice, care s-a agravat în timp și s-a crezut că provine dintr-o serie de răspunsuri complexe la stres oxidativ [31]. În prezentul experiment, modificările funcției hepatice și renale din grupele A2, B și C au fost reversibile. Perfuzia la 37 ± 0,5 ° C, 42,5 ± 0,5 și 43,5 ± 0,5 ° C a determinat creșterea tranzitorie și ușoară a parametrilor fiziologici asociați. Cu toate acestea, perfuzia la 44,5 ± 0,5 ° C a acoperit acești parametri pentru a se modifica substanțial, rezultând disfuncții hepatice și renale aparente. Cele 2 perfuzii efectuate la 44,5 ± 0,5 ° C au indus o afectare durabilă și evidentă a funcțiilor hepatice și renale.
Deoarece ratele de supraviețuire s-au îmbunătățit după intervenția chirurgicală citoreductivă plus IEPCHIP pentru cancerul gastric, toxicitatea chimioterapiei suplimentare ar trebui monitorizată îndeaproape. Într-o meta-analiză a studiilor randomizate controlate cu chimioterapie hipertermică intraperitoneală pentru cancerul gastric rezecabil, ratele de mortalitate postoperatorie din 6 studii au fost de 2,6% (10/385) [11]. Într-un studiu multi-instituțional cu 1.290 de pacienți care a examinat tratamentul carcinomatozei peritoneale de origine non-ovariană prin chirurgie citoreductivă și chimioterapie intraperitoneală perioperatorie, rata mortalității a fost de 4,1% [28]. Într-un alt studiu multi-instituțional care a examinat chirurgia citoreductivă combinat cu chimioterapia intraoperatorie și postoperatorie intraperitoneală pentru carcinomatoza peritoneală din cancerul colorectal, rata mortalității aferentă a fost raportată a fi de 4% (20/506) [29].
Chimioterapia suplimentară poate fi excesiv de riscantă pentru acești pacienți, iar posibila creștere a numărului de celule stem canceroase după chimioterapie este o preocupare suplimentară [38]. Perfuzia hipertermică poate fi, de asemenea, eficientă, permițând o calitate mai bună a vieții, fără unele dintre complicațiile observate după procedurile de cancer gastric avansat. În plus, chirurgia citoreductivă cu chimioterapie hipertermică intraperitoneală prelungește supraviețuirea la morbiditate și mortalitate considerabile la pacienții vârstnici [39]. Perfuzia hipertermică intraperitoneală fără chimioterapie poate fi deosebit de potrivită pentru pacienții vârstnici cu stare de performanță slabă sau cei care nu pot tolera chimioterapia. Prin urmare, am efectuat perfuzie intraperitoneală hipertermică intraoperatorie și postoperatorie timpurie fără chimioterapie la 34 de pacienți cu cancer gastric avansat din 2011.
Din motivele menționate mai sus, studiul actual s-a concentrat pe determinarea intervalului de temperatură acceptabil, care stă la baza perfuziei hipertermice intraperitoneale cu sau fără chimioterapie.
Concluzii
Am constatat că IEPCHIP la 42,5 ± 0,5 ° C nu a afectat în mod semnificativ porcii primitori în ceea ce privește semnele lor vitale, funcția hepatică, funcția renală și vindecarea anastomotică. Mai mult, nu a existat niciun risc suplimentar de scurgere anastomotică și aderență abdominală. Astfel, perfuzia la 42,5 ± 0,5 ° C a fost sigură și adecvată pentru IEPCHIP, în timp ce perfuzia la 43,5 ± 0,5 ° C sau 44,5 ± 0,5 ° C a fost dăunătoare și s-a dovedit a agrava semnificativ vindecarea anastomotică.
- Salata cultivată în spațiu este sigură de mâncat, spune studiul; delicios, spun astronauții
- Rusia Înregistrarea temperaturii în spatele cercului polar
- Obezitate și terapie cu fluide intraoperatorii orientate spre obiective - Vizualizare text complet
- Arome naturale Ghidul final pentru ceea ce este sigur - Keto perfect
- Culturism sigur, mai mulți mușchi cu mai puține proteine dietetice