J. Antonio González
1 Mill Hill Laboratory, Institutul Francis Crick, Londra NW7 1AA, Marea Britanie
Lise T. Jensen
2 Institutul de Medicină Clinică, Universitatea Aarhus, 8200 Aarhus, Danemarca
Panagiota Iordanidou
1 Mill Hill Laboratory, Institutul Francis Crick, Londra NW7 1AA, Marea Britanie
Molly Strom
3 Sainsbury Wellcome Center, University College London, Londra W1T 4JG, Marea Britanie
Lars Fugger
2 Institutul de Medicină Clinică, Universitatea Aarhus, 8200 Aarhus, Danemarca
4 Oxford Center for Neuroinflammation, Division of Clinical Neurology and MRC Human Immunology Unit, Nuffield Department of Clinical Neurosciences, Weatherall Institute of Molecular Medicine, University of Oxford, Oxford OX3 9DS, UK
Denis Burdakov
1 Mill Hill Laboratory, Institutul Francis Crick, Londra NW7 1AA, Marea Britanie
5 Institute of Psychiatry, Psychology and Neuroscience, Department of Developmental Neurobiology, King’s College London, London WC2R 2LS, UK
Date asociate
rezumat
Rezultate si discutii
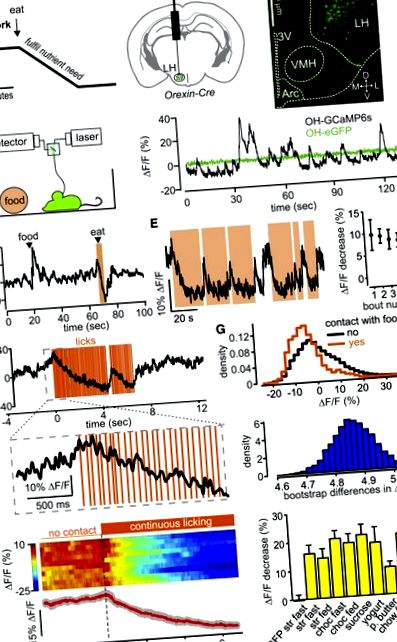
Dinamica naturală a populației celulelor OH în timpul consumului voluntar
Celulele Orexin/hipocretină (OH) sunt activate de post și de niveluri scăzute de glucoză și au fost formulate ipotezele că conduc alimentația până când glucoza ingerată încet (în câteva minute) le inactivează (Figura 1 A) [19, 24]. Am măsurat activitatea populației de celule OH la șoareci care se comportă liber utilizând fotometria cu fibre [17] a indicatorului de activitate GCaMP6s direcționat către celulele OH în timp ce monitorizați alimentația utilizând urmărirea video sau senzorii tactili (Figura 1 B; Figurile S1 - S3). La șoareci cu comportament liber, am observat fluctuații ale activității în OH-GCaMP6s, dar nu și în celulele OH-eGFP (Figura 1 C). Magnitudinea acestor fluctuații (∼10% –40% ΔF/F) a fost similară cu dinamica rețelei înregistrată cu metode similare în alte regiuni ale creierului [25, 26]. Cuantificarea noastră experimentală a performanței fotometriei a sugerat că> 95% din semnalul de fluorescență ar proveni de la ± 0,5 mm din tipul de fibră (Figurile S2A și S2B), care se potrivește bine dimensiunilor grupului OH din hipotalamusul șoarecelui. Am confirmat că semnalul GCaMP6 reflectă modularea celulelor OH fiziologice prin reproducerea activării in vivo a celulelor OH descrise anterior prin sunete [14] și inhibarea in vitro a celulelor OH de către glucoză [24] (Figurile S1C și S1D). Semnalul OH-GCaMP6s a fost direct proporțional cu viteza de ardere a celulei OH (Figura S3).
Impactul alimentației asupra dinamicii celulare OH naturale in vivo
(A) O ipoteză pentru modularea temporală a celulelor OH în timpul consumului.
(B) Stânga: schema de direcționare a GCaMP6s către celulele OH pentru obținerea datelor prezentate în această figură (datele care utilizează direcționarea alternativă a celulelor OH sunt prezentate în figurile S2C - S2F). Dreapta: localizarea locului de injectare și traseul fibrei optice. 3V, al treilea ventricul; L, D, M, V, lateral, dorsal, medial, ventral; VMH, hipotalamus ventromedial; Arc, nucleu arcuat. Imagine reprezentativă a n = 5 creiere.
(C) Stânga: schemă de înregistrare. Dreapta: urmă de fluorescență în timpul explorării cuștii pentru șoareci care exprimă GCaMP6s sau eGFP în neuroni OH. Exemple tipice de șoareci n = 5 și n = 3, respectiv.
(D) Urmă de fluorescență în timpul introducerii alimentelor în cușcă și consumul ulterior al acesteia (zona umbrită cu portocaliu). Mâncarea era o picătură de milkshake de căpșuni. Exemplu tipic de n = 5 șoareci.
(E) Stânga: urmă de fluorescență în timpul unor accese repetate de contact cu alimentele (zone cu umbră portocalie; mâncarea este un milkshake de căpșuni). Exemplu tipic de n = 5 șoareci. Dreapta: cuantificarea modificării fluorescenței în primele 2 secunde de crize consecutive de contact cu alimentele (înseamnă ± SEM, n = 3 șoareci).
(F) Schimbarea fluorescenței în timpul linsului alimentar detectată cu un senzor tactil (alimentul este un milkshake de căpșuni). Exemplu tipic de n = 5 șoareci din opt alimente prezentat în (H), dreapta.
(G) Sus: densitatea probabilității activității celulei OH. Partea de jos: distribuția diferențelor de bootstrap ale acelorași date. Exemplu tipic de n = 3 șoareci.
(H) Stânga: comploturi peri-eveniment aliniate la debutul loviturilor de lins (linie punctată). Harta de căldură arată lupte individuale (două pe mouse), iar urmele de sub hârtie de căldură arată media mediilor de încercare de la fiecare șoarece (linia roșie; liniile gri reprezintă SEM); n = 5 șoareci. Dreapta: cuantificarea experimentului prezentat în stânga, pentru diferite alimente. Fiecare coloană arată schimbarea fluorescenței în timpul primelor 4 secunde ale unui episod de lins (semnalele medii în timpul 3,5 până la 4 s minus semnal în timpul -0,5 până la 0 s, ori relativ la prima lins). Datele sunt media ± SEM a n = 4 șoareci din fiecare grup. Coloana din stânga este control (șoareci OH-eGFP); alte coloane sunt șoareci OH-GCaMP6s; pentru prescurtări alimentare, consultați Procedurile experimentale suplimentare; repede, peste noapte post înainte de experiment; hrănit, hrănit ad libitum înainte de experiment. Toate modificările la șoarecii OH-GCaMP6 au fost semnificative (p 3.4).
Am constatat că contactul cu alimentele a deprimat activitatea celulelor OH extrem de rapid (Figurile 1 D - 1H). Celulele OH au revenit la o stare ridicată în câteva secunde după ce contactul cu alimentele a fost oprit (Figurile 1 D - 1F; Figura S2E), sugerând că modularea rapidă a celulei OH nu este cauzată de variația lentă a semnalelor nutriționale. Acest efect a fost observat atât la șoarecii OH-GCaMP6s, cât și la cei hrăniți, dar nu și la controalele OH-eGFP (Figura 1 H). Pentru alimentele lichide, scăderea activității celulelor OH a fost evidentă în doar câteva linguri (Figura 1 F; Figurile S2E și S2F). Depresia celulară OH asociată consumului de alimente a fost similară pentru alimentele cu consistență diferită (de exemplu, chow versus iaurt) și cu valoare apetisivă diferită (de exemplu, chow versus unt de arahide) (Figura 1 H). Pentru a confirma dacă conținutul caloric a avut un rol, am testat un „aliment” fără calorii (soluție de sucraloză) și am observat în continuare o inactivare robustă a celulelor OH în timpul linsului (Figura 1 H). În ansamblu, aceste date arată că celulele OH sunt rapid inactivate de actul de a mânca, indiferent de proprietățile alimentelor sau de starea de energie a corpului.
Impactul natural al neuronilor OH asupra alimentației
Datele corelative de mai sus au două interpretări cauzale posibile: (1) celulele OH se opun mâncării și sunt dezactivate pentru a permite să mănânce, sau (2) celulele OH conduc alimentația, astfel încât mâncarea se oprește la scurt timp după ce celulele OH sunt tăcute. Pentru a face distincția între aceste posibilități, am investigat cauzalitatea dintre activitatea OH naturală și alimentația prin inactivarea celulelor OH la șoarecii adulți printr-o strategie de eliminare a celulelor mediată de receptorii toxinei [27, 28].
Am generat șoareci transgenici noi în care expresia receptorului de toxină difterică umană (DTR) este condusă de promotorul OH (vezi Procedurile experimentale suplimentare). La șoarecii OH-DTR, dar nu și la șoarecii WT de control, injectarea toxinei difterice a ablat toate celulele OH, dar nu celulele vecine care conțin hormoni care concentrează melanina, în câteva zile (Figurile 2 A - 2D). Această inactivare completă a celulelor OH, care nu este la fel de ușor de realizat prin metode alternative de reducere a silențierii, cum ar fi opto- și chimiogenetica, poate fi critică pentru elucidarea impactului lor deplin, deoarece fenotipurile de deficiență cheie nu sunt evidente la inactivarea parțială [13].
Impactul activității celulare OH naturale asupra ritmului de hrănire spontană
(A) Strategie pentru distrugerea neuronilor OH la șoareci adulți.
(B) Imunocolorarea pentru neuronii OH (verzi) și melanici care conțin hormoni (MCH) (roșii) în neuronii DTR - (de sus) și DTR + (de jos) la 10 zile după injectarea DT. Injecția DT a dus la pierderea neuronilor OH în toate creierele testate (n = 8). Barele de scară reprezintă 500 μm (stânga) și 100 μm (dreapta). Casetele cu puncte din panourile din stânga indică zonele afișate în panourile din dreapta corespunzătoare.
(C) Cursul de timp al pierderii celulei OH după injecția DT în DTR + și DTR - colegii lor (n = 5 șoareci din fiecare grup).
(D) Cuantificarea numărului de celule OH> 21 de zile după injectarea DT în colegii DTR - și DTR +. Test t nepereche, t (13,3) = 16,41, p = 3,2e-10, n = 8 șoareci din fiecare grup.
(E) Seria temporală a greutății corporale a colegilor de așternut DTR - și DTR + după injecția DT. ANCOVA, F (1, 12) = 12,07, p = 0,005, n = 7 șoareci în fiecare grup.
(F) Ritmul zilnic al consumului la șoareci DTR - și DTR + după injecția DT, pe parcursul a câteva zile. n = 7 șoareci din fiecare grup.
Disocierea temporală a alimentelor dependente de post și dependente de OH
Descoperirile de mai sus demonstrează că activitatea naturală a celulelor OH se opune consumului și, prin urmare, contestă modelele actuale care postulează că celulele OH stimulează consumul. Cu toate acestea, deoarece celulele OH sunt activate prin post, este încă posibil să devină critice pentru alimentația compensatorie după post [11]. Pentru a examina această posibilitate, am măsurat supraalimentarea rebotei după post la șoareci OH - (adică șoareci DTR + injectați cu DT), dar în mod surprinzător am găsit-o similară cu colegii lor OH + (DTR - șoareci injectați cu DT) (Figurile 3 A și 3B ). Mai mult, deși atât șoarecii OH -, cât și șoarecii OH + supraalimentează câteva zile după post, în fiecare dintre aceste zile au mâncat mai mult doar în faza de noapte (figurile 3 C și 3D), adică o fază diferită de cea a alimentelor aportul a fost reglat în mod natural de celulele OH (Figura 2 G). Această disociere temporală relevă faptul că, cel puțin în condițiile studiate aici, lipsa de nutrienți și celulele OH reglează faze zilnice distincte ale consumului de alimente. Aceste date sugerează că celulele OH nu sunt necesare pentru supraalimentarea compensatorie după post, cel puțin atunci când alimentele sunt ușor disponibile.
Impactul activității celulare OH naturale asupra consumului de rebond după post
(A) Consumul de răspunsuri la un post de o zi la șoareci martor (OH +, DTR - șoareci injectați cu DT) și colegii lor cu deficiențe de celule OH (șoareci OH -, DTR + injectați cu DT). n = 6 șoareci din fiecare grup.
(B) Ritmuri zilnice de mâncare înainte și după un post de o zi în OH + și OH - colegii de așternut. n = 6 șoareci din fiecare grup.
(C) Ritmuri alimentare zilnice cu 3 zile înainte și după restricționarea alimentelor. ANOVA cu măsuri repetate, interacțiune: F (7, 35) = 3,36, p = 0,008 (stânga) și F (7, 35) = 3,53, p = 0,006 (dreapta). Testele de urmărire au arătat diferențe semnificative doar la momentele marcate cu asteriscuri (∗∗ p ∗∗∗ p + și OH - șoareci (n = 6 în fiecare grup) în timpul nopții devreme (ZT12-14) comparativ cu cele consumate în noaptea târziu ZT18 –20) .Testele t asociate.
Normalizarea alimentației împiedică creșterea în greutate la șoarecii cu deficit de celule OH
Identificarea unei strategii eficiente pentru controlul greutății corporale la persoanele cu deficit de OH este de interes clinic [21, 30]. În experimentele noastre, supraalimentarea la șoareci OH (aproximativ 10 g de alimente pe parcursul a 50 de zile sau aproximativ 2% pe zi) ar putea fi teoretic suficientă pentru a explica excesul de greutate la acești șoareci pe baza următoarelor raționamente. Șoarecii OH - câștigă aproximativ 10% în greutate (comparativ cu controalele OH +) în aproximativ 45 de zile, adică creșterea în greutate în exces de aproximativ 0,2% pe zi (Figura 2 E). Experimentul nostru de post arată că, într-o zi, o modificare de 100% a consumului de alimente poate provoca o schimbare de 10% în greutate (Figura 3 A). Dacă această relație de 10: 1 se menține în general, atunci creșterea zilnică de ± 2% ar fi suficientă pentru a explica creșterea zilnică în exces de 0,2% în greutate.
Prin urmare, am investigat dacă creșterea în greutate în exces la șoarecii OH poate fi controlată prin restricție dietetică ușoară. Pentru a realiza acest lucru, am folosit paradigma de hrănire în perechi [31], în care alimentele disponibile fiecărui șoarece OH erau potrivite zilnic cu cele consumate de controlul său OH + pentru colegii (Figura 4 A). Aceasta fixează în mod eficient consumul de alimente, dar într-o manieră fiziologică ușoară, fără perioade anormale de post [31].
Prevenirea creșterii în greutate cauzată de pierderea celulelor OH prin dietă
(A) Strategia pentru experimentul de hrănire în perechi (OH +, DTR - șoareci injectați cu DT; OH -, colegii lor de liti DTR + injectați cu DT).
(B) Creșterea în greutate a colegilor de așternut OH - și OH + în timpul săptămânilor 2 și 3 după injectarea DT și în timpul hrănirii libere (test t nepereche, t (11,93) = −4,327, p = 0,0009, n = 7 șoareci din fiecare grup) și hrănirea în perechi (test t nepereche, t (5,41) = −0,598, p = 0,574, n = 4 animale din fiecare grup).
Hrănirea pereche a șoarecilor OH le-a împiedicat să devină mai grele decât frații lor OH + (Figura 4 B). În contrast, în experimentele de control efectuate în același timp, șoarecii OH cu hrană liberă au devenit semnificativ mai grei decât frații lor OH + (Figura 4 B). Rețineți că acest lucru nu exclude faptul că alți factori în afară de a mânca pot media creșterea în greutate a șoarecilor OH, de exemplu, modificări ale ritmurilor somn/veghe și cheltuieli de energie [2, 31, 32]. Cu toate acestea, rezultatele noastre sugerează că, în absența supraalimentării, astfel de factori sunt insuficienți pentru a determina creșterea excesivă în greutate.
Concluzii
Descoperirile noastre dezvăluie dinamica activității populației celulelor OH în timpul consumului și sugerează că consumul este mai puțin probabil să apară atunci când celulele OH sunt active în mod natural. Celulele OH stimulează comportamente „care nu mănâncă”, cum ar fi locomoția [18]. Deși aceste comportamente consumă energie, este dificil să mănânci în timp ce le îndeplinești. Astfel, o posibilă rațiune evolutivă pentru descoperirile noastre este că suprimarea comportamentelor non-alimentare dependente de OH - prin reducerea la tăcere a celulelor OH la contactul cu alimente - ar facilita consumul (de exemplu, făcând șoarecele mai puțin probabil să se îndepărteze de alimente). Este tentant să speculăm că alimentația crescută după stimularea experimentală a sistemului OH [11, 13] poate fi un răspuns secundar la cheltuielile de energie conduse de OH [33], mai degrabă decât o funcție primară a celulelor OH.
Descoperirile noastre identifică direcții interesante pentru munca viitoare. Am constatat că creșterea în greutate la șoarecii cu deficit de celule OH ar putea fi prevenită prin restricții calorice ușoare. Acest lucru sugerează că dezvoltarea intervențiilor non-farmacologice poate fi utilă în gestionarea creșterii excesive în greutate în condițiile neuropsihiatrice asociate cu semnalizarea OH redusă [3, 21, 30, 34]. Mai mult, rezultatele noastre sugerează că celulele OH - a căror hiperactivitate a fost implicată în stări patologice, cum ar fi anxietatea de panică [5] - ar putea fi inhibate de acțiuni voluntare simple, cum ar fi mâncarea, indiferent de natura alimentelor. Cercetări suplimentare privind intervențiile de stil de viață bazate pe neuroștiințe pentru anxietate și obezitate ar putea duce la tratamente care sunt mai ușor de implementat și au mai puține efecte secundare.
Proceduri experimentale
Activitatea celulelor OH a fost înregistrată in vivo utilizând fotometria de fibre a indicatorului de activitate GCaMP6s direcționat către celulele OH fie folosind șoareci orexin-Cre caracterizați anterior și vectori virali GCaMP6s inductibili cu Cre [35, 36] (Figura 1; Figura S1B) sau utilizând un nou vectorul adeno-asociat (ADV) -GCaMP6s dependent de promotorul orexinei generat (caracterizat în Figurile S2C - S2F și descris în Procedurile Experimentale Suplimentare). Celulele OH au fost inactivate în mod specific și complet folosind o strategie de ablație celulară mediată de receptorul toxinei difterice la șoarecii transgenici OH-DTR nou generați descriși în Procedurile Experimentale Suplimentare. Aportul alimentar a fost monitorizat utilizând un sistem Teno PhenoMaster, a cărui sensibilitate și precizie au fost determinate direct în laboratorul nostru (Figurile S4A - S4D). Testele de imunohistochimie și toleranță la glucoză au fost efectuate folosind tehnici standard (a se vedea Procedurile experimentale suplimentare).
Contribuțiile autorului
J.A.G. a efectuat majoritatea experimentelor; L.T.J. a creat și a caracterizat șoarecii transgenici DTR; P.I. a efectuat experimentele din figurile S2C - S2F; DOMNIȘOARĂ. a contribuit la experimentele din Figura S2C; D.B. și L.F. a proiectat studiul și a obținut finanțare; și D.B., L.F. și L.T.J. a scris ziarul.
Mulțumiri
Mulțumim doctorilor. Cornelia Schöne, Rui Costa și Guohong Cui pentru asistența lor cu fotometria cu fibre. Această lucrare a fost finanțată de Institutul Francis Crick, care primește finanțarea sa principală de la Cancer Research UK, UK Medical Research Council și Wellcome Trust. L.F. este susținut de MRC și Wellcome Trust.
Note
Publicat: 18 august 2016
Note de subsol
Informațiile suplimentare includ proceduri experimentale suplimentare, patru figuri și un film și pot fi găsite împreună cu acest articol online la http://dx.doi.org/10.1016/j.cub.2016.07.013.
Informatii suplimentare
Săgeata arată locația canalului alimentar care conține alimente lichide (milkshake de căpșuni). Punctul roșu marchează momentul în care mouse-ul începe să lingă.
- Mâncarea târziu în noapte pentru a scăpa mai multe grăsimi; Construiți mai mult film muscular
- Cum; curat; mâncarea m-a ajutat să-mi depășesc atacurile de panică SBS Food
- Vindecați-vă relația cu mâncarea în bucătărie Rețete de mâncare intuitivă
- Cum; s Dieta ta Mâncare antiinflamatorie pentru nutriție optimă Karyn Shanks MD
- Modul în care schimbarea obiceiurilor mele alimentare mi-a ajutat anxietatea; Bucle sudice; Perle