Termeni asociați:
- Glucoză
- Acizi grași
- Leptina
- Receptor Eicosanoid
- Enzime
- Adenozin trifosfat
- Insulină
- Mitocondrie
- Stresul oxidativ
- Proteină
Descărcați în format PDF
Despre această pagină
METABOLISMUL ENERGETIC
Metabolismul energetic este esențial pentru viață și principala funcție a sistemului respirator este de a menține procesele metabolice aerobe în organism. În ciuda acestui rol important, metabolismul energetic este slab integrat în procesul de diagnosticare a bolilor respiratorii cronice. O atenție sporită în ultimul deceniu sa concentrat pe contribuția dezechilibrului energetic în patogeneza pierderii în greutate, în special la pacienții cu boli pulmonare obstructive cronice (BPOC). Câțiva factori contribuie la cantitatea de energie cheltuită de un individ: cheltuielile de energie în repaus, activitatea fizică și într-o măsură mai mică termogeneza indusă de dietă. Articolul se referă în special la cheltuielile de energie de repaus, precum și la datele totale zilnice privind cheltuielile de energie, măsurate la pacienții cu BPOC. Factorii responsabili de creșterea cheltuielilor energetice de repaus, precum și cheltuielile totale de energie sunt discutate în detaliu. Aportul alimentar, precum și utilizarea alimentelor sunt componente esențiale în menținerea echilibrului energetic. Progresele recente în domeniul homeostaziei energetice relevă complexitatea rețelei neuroendocrine de reglementare. Rolul hormonului anorexigenic și adipostatic leptina este discutat în detaliu.
Metabolismul energetic
Metabolismul glicogenului
Globulele roșii și creierul au o cerință absolută de glucoză pentru metabolismul energetic. Glucoza este absorbită din intestine doar 2-3 ore după masă și, prin urmare, trebuie să existe o altă sursă de glucoză pentru a menține un nivel constant al glicemiei. Când nivelul glicemiei crește după masă, ficatul poate absorbi cantități mari de glucoză, unde este transformat în glucoză-6-fosfat, care poate fi utilizat pentru sintetizarea glicogenului (glicogeneza). Când depozitele de glicogen sunt pline, glucoza-6-fosfatul poate intra în glicoliză sau poate fi utilizat pentru a sintetiza glicerina pentru formarea grăsimilor. Când nivelul glicemiei scade, în timpul postului între mese, glicogenul este descompus în ficat și glucoza eliberată (glicogenoliză). În timpul postului, glicogenul este descompus prin îndepărtarea unităților de glucoză sub formă de glucoză-1-fosfat de la mai multe capete ale moleculei. Acesta este apoi izomerizat în glucoză-6-fosfat. Numai ficatul poate elibera glucoză liberă, deoarece țesutului muscular îi lipsește glucoza-6-fosfataza. Glucoza liberă eliberată de ficat este utilizată de creier și celulele roșii din sânge.
Glucoza-6-fosfatul eliberat în țesutul muscular din glicogen poate intra direct în glicoliză pentru producerea de energie de către mușchi. Alternativ, poate fi metabolizat în piruvat și apoi transaminat în alanină care este exportată din mușchi în ficat, unde poate fi utilizată ca substrat pentru gluconeogeneză.
Tabelul 2 arată importanța relativă a căilor metabolice energetice în diferite țesuturi ale corpului.
Masa 2. Un rezumat al importanței relative a diferitelor căi metabolice în metabolismul intermediar în diferite țesuturi
| Creier | 25% consum de O2 bazal |
| Metabolizează numai glucoza, cu excepția unei înfometări prelungite, când se poate adapta la absorbție și metabolizează cetone | |
| Sânge | Globulele roșii mature nu au mitocondrii: energie din glicoliză anaerobă: glucoză → lactat |
| Muşchi | Metabolizează preferențial acizii grași și cetonele produse din ficat. |
| Glicoliza anaerobă a glucozei din depozitele de glicogen | |
| Respirația aerobă a glucozei din glicogen sau acizi grași/cetone | |
| Ficat | În principal oxidarea aminoacizilor pentru generarea de ATP |
| Cel mai important țesut pentru menținerea glicemiei prin gluconeogeneză din aminoacizi și lactat (prin ciclul Cori) și glicerol și, de asemenea, din defalcarea depozitelor de glicogen | |
| Sinteza acizilor grași și sinteza lipoproteinelor pentru transport | |
| Producția de cetone în circulație | |
| Situl căii pentoză-fosfat pentru generarea de NADPH + H + | |
| Țesut adipos | Conceput pentru depozitarea grăsimilor |
| Poate sintetiza grăsimea din glucoză | |
| Rinichi | Gluconeogeneză |
| Oxidarea aminoacizilor pentru generarea de ATP |
METABOLISMUL ENERGETIC
rezumat
Așa cum s-a descris în paragrafele anterioare, oamenii își obțin energia din alimente. Odată ajunși în organism, macromoleculele găsite în alimente suferă o serie de reacții degenerative care produc substraturile necesare pentru a promova continuarea unui proces cunoscut sub numele de metabolism energetic. Rezultatul acestei serii foarte precise de reacții chimice și biologice este transformarea energiei în forma sa liberă în energie care poate fi pe deplin utilizată de corpul uman. Carbohidrații sunt degradați în zaharuri simple, grăsimi în acizi grași și proteine în aminoacizi. În cele din urmă, oxidarea completă a acestor molecule produce acetil CoA, care acționează ca o legătură cu ciclul TCA.
În ciclul TCA, acetil CoA este complet oxidat la CO2 și H2O. Pe tot parcursul ciclului, atomii de hidrogen și electronii lor sunt eliberați. Atomii de hidrogen sunt legați apoi de alți compuși, rezultând în producerea a trei molecule de NADH, una FADH2 și una GTP. Aceste noi molecule conțin energia găsită inițial în acetil CoA. Pentru producerea de ATP, NADH și FADH2 transportă electronii din ciclul TCA printr-un lanț de transport al electronilor cunoscut sub numele de fosforilare oxidativă. Procesul se încheie cu producerea de ATP și H2O. O modificare a fosforilării oxidative poate afecta producția de ATP și poate disipa energia ca căldură. Proteinele de decuplare sunt responsabile pentru acest lucru.
Serotonina
Metabolismul energetic și reglarea acestuia
Diagnosticul și gestionarea bolilor mitocondriale
Recomandări generale
Metabolismul energetic este compromis la pacienții cu encefalomiopatii mitocondriale, de aceea trebuie evitată exagerarea până la oboseală și epuizare. Sa demonstrat că condiționarea aerobă îmbunătățește capacitatea de efort la pacienții cu miopatii mitocondriale. Nu se recomandă un regim alimentar specific, dar pacienții sunt sfătuiți să evite postul prelungit și să consume mese ușoare frecvente. Expunerea la potențiali cofactori de mediu, cum ar fi consumul de alcool și tutun în LHON, ar trebui eliminată. Febra este tratată agresiv cu acetaminofen, iar aspirina trebuie evitată. Atunci când este nevoie de tratament cu antibiotice, cloramfenicolul și tetraciclina trebuie evitate din cauza toxicității pentru mitocondrii.
Metabolismul energetic și țintirea metabolică a neuroblastomului
Sepideh Aminzadeh-Gohari,. Barbara Kofler și Neuroblastoma, 2019
Abstract
Metabolismul energetic se referă la toate reacțiile implicate în generarea adenozin trifosfatului (ATP) din nutrienți, incluzând atât respirația aerobă (oxigen prezent), respirația anaerobă (fermentația), cât și metabolismul acizilor grași și aminoacizilor. În condiții normoxice, celulele normale folosesc respirația aerobă pentru a oxida glucoza prin fosforilare oxidativă mitocondrială. Celulele canceroase, pe de altă parte, preferă să fermenteze glucoza în lactat chiar și cu oxigen prezent (efect Warburg) și prezintă alterarea metabolismului lipidelor și aminoacizilor. Acest capitol discută caracteristicile metabolice ale neuroblastomului (NB), care permit tumorii să mențină nivelurile de ATP și biomasa necesare pentru susținerea proliferării ridicate și evidențiază noi ținte metabolice în terapia NB.
Sarcina: Cerințe energetice și adaptări metabolice
Metabolismul energetic în sarcina umană a primit o atenție considerabilă de peste 60 de ani, datând de la lucrările timpurii care au evaluat contribuția metabolismului fetal la costurile energetice generale ale sarcinii. De atunci, accentul a fost pus pe separarea și cuantificarea diferitelor componente ale necesităților de energie gestațională și pe stabilirea recomandărilor adecvate pentru necesitățile energetice ale femeilor însărcinate, cu intenția de a cuantifica cantitățile medii. Aceste variații interindividuale ale răspunsurilor metabolice la sarcină sunt din ce în ce mai recunoscute ca „plasticitate” semnificativă din punct de vedere biologic, care are o adevărată valoare de adaptare, permițând femeilor să ducă o sarcină la termen într-o gamă largă de condiții nutriționale. Consecințele unor astfel de adaptări sunt explorate ca parte a originilor fetale și infantile ale ipotezelor bolii adulte.
Contextul conceptual și aspectele bioenergetice/mitocondriale ale oncometabolismului
Martin Pelletier,. Richard M. Siegel, în Methods in Enzymology, 2014
1.1 Metabolismul energetic și reglarea celulelor imune
Metabolismul energetic asigură funcționarea corectă a sistemului imunitar, deoarece celulele imune necesită energie pentru a menține viabilitatea celulară și pentru a îndeplini funcții imune specifice. Aceasta include consumul de energie pentru funcțiile motorii (migrație și fagocitoză), procesarea și prezentarea antigenului, funcțiile de activare (semnalizare și proliferare) și funcțiile efectoare (sinteza anticorpilor, secreția citokinelor și citotoxicitatea) (Buttgereit, Burmester și Brand, 2000). Celulele imune sunt foarte adaptate mediilor în care circulă și acasă în timpul răspunsurilor inflamatorii. Ele diferă adesea în stările metabolice bazale și în răspunsurile la activarea stimulilor. Răspunsurile metabolice adaptate sunt esențiale pentru supraviețuirea și funcția celulară. Eșecul metabolismului pentru a se potrivi nevoilor celulare poate duce la afectarea funcției și apoptoza, în timp ce funcția metabolică în exces poate duce la supraviețuirea celulei, funcționalitate sporită și hiperreactivitate, ducând la autoimunitate și boli inflamatorii (Jacobs și colab., 2008; Rathmell, Elstrom, Cinalli și Thompson, 2003).
Bioenergetica somnului
Metabolismul regional al glucozei cerebrale în timpul somnului
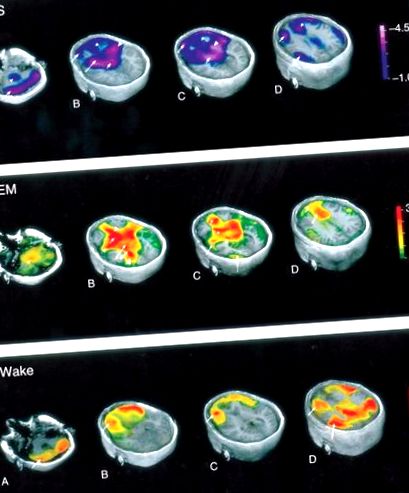
Figura 5. Hărți cerebrale care ilustrează modificările fluxului sanguin cerebral regional (rCBF) în timpul diferitelor etape de somn și veghe. Modificat cu permisiunea Braun AR, Balkin TJ, Wesenten NJ și colab. (1997) Fluxul de sânge cerebral regional pe tot parcursul ciclului somn - veghe. Un studiu H2 (15) O PET. Creierul 120 (Pt 7): 1173–1197.
Inferențele activității metabolice din tehnicile de neuroimagistică care măsoară fluxul sanguin cerebral presupun că fluxul sanguin cerebral se corelează cu activitatea neuronală care, la rândul său, se corelează cu activitatea metabolică. Există o scădere globală a fluxului sanguin cerebral în timpul somnului NREM. Scăderea fluxului sanguin în timpul somnului NREM se observă la pons dorsal, mezencefal, talami, ganglioni bazali, creierul bazal, hipotalamusul anterior, cortexul prefrontal, cortexul cingulat anterior și precuneus. Scăderile regionale ale fluxului sanguin pot fi grupate în trei zone cerebrale principale - structuri subcorticale, structuri corticale și alte zone.
Activitatea neuronală intensă, metabolismul cu energie ridicată și creșterea fluxului sanguin către creier caracterizează somnul REM. În comparație cu starea de veghe, fluxul sanguin crescut se observă în cortexul cingulat, zonele temporo-occipitale, creierul bazal, cerebelul și nucleul caudat în timpul somnului REM. Scăderea fluxului de sânge regional se observă în cortexul prefrontal dorsolateral (DLPF), girusul cingulat posterior, precuneus și cortexul parietal inferior. Nucleii tegmentali pedunculopontini (PPT) și tegmentali laterodorsali (LDT) proiectează neuronii colinergici dorsal către talamus și ventral către creierul bazal în care mediază activarea corticală.
Metabolismul energetic bacterian
Introducere în metabolismul energetic
Metabolismul energetic este integrat cu alte procese metabolice, cum ar fi chimiotaxia, absorbția nutrienților, secreția de polimeri, efluxul de metaboliți reziduali și compuși toxici. Componenta centrală a majorității bacteriilor este un proton (H +) care translocează ATPaza. În bacteriile fermentative, acesta transformă ATP derivat din fosforilarea la nivel de substrat într-o forță motrice a protonului (pmf), compusă din două componente: un gradient de proton electrochimic ΔpH și un potențial de membrană Δμ. La bacteriile care obțin energie de către electronii respiratori sunt transmise un lanț respirator format din citocromi și flavoproteine; în puncte specifice din acest proces există o separare a sarcinii și protonii sunt translocați pe membrana citoplasmatică, creând un pmf. H + -ATPase este reversibil, deci este posibil să utilizați pmf pentru a genera ATP.
Bacteriile arată o diversitate uluitoare în capacitatea lor de a utiliza metaboliții pentru generarea de energie și de a trece de la un mod de generare a energiei la altul. Acest lucru este cel mai evident prezentat în aerobii facultativi, cum ar fi Escherichia coli, care pot folosi respirația aerobă cu oxigenul ca acceptor final de electroni, dar pot folosi și acceptori alternativi de electroni, cum ar fi azotatul, fumaratul, oxidul de trimetilamină (TMAO) și dimetilsulfoxidul (DMSO). E. coli poate, de asemenea, regla fin lanțul respirator folosind citocrom oxidaze alternative în funcție de concentrația de oxigen din jurul celulei.
Alte bacterii sunt mai limitate. Anaerobii precum Bifidobacterium longum, un colonizator al intestinului uman, câștigă energie prin fermentare.
- Sindromul dintelui crăpat - o prezentare generală a subiectelor ScienceDirect
- Diogene - o privire de ansamblu Subiecte ScienceDirect
- Demența frontotemporală - o prezentare generală Subiecte ScienceDirect
- Pancreatectomia distală - o prezentare generală Subiecte ScienceDirect
- Șobolan sensibil la sare Dahl - o prezentare generală Subiecte ScienceDirect