Eiji Kasumi
1 EN Otsuka Pharmaceutical Co., Ltd., Laboratoare de cercetare și dezvoltare, 4-3-5 Nimaibashi, Hanamaki, Iwate 025-0312, Japonia
Norifumi Sato
1 EN Otsuka Pharmaceutical Co., Ltd., Laboratoare de cercetare și dezvoltare, 4-3-5 Nimaibashi, Hanamaki, Iwate 025-0312, Japonia
Abstract
Introducere
Carcinomatoza peritoneală este o formă severă de progresie a cancerului metastatic, care se observă la 10–35% dintre pacienții cu cancer colorectal și la 50% dintre pacienții cu cancer gastric. (1) Diseminarea peritoneală rezultată este cel mai frecvent și mai sever simptom clinic, ducând la un prognostic slab. (2) Diseminarea peritoneală este observată la aproximativ 10% dintre pacienții cu cancer colorectal și provoacă ascită, oboseală extremă, disconfort abdominal, dureri abdominale și obstrucție intestinală, cu o rată de supraviețuire la 5 ani mai mică de 10%. (3,4) De remarcat, pacienții cu obstrucție intestinală cauzată de diseminarea peritoneală provenită din cancerul colorectal ca leziune primară au un prognostic mai prost cu o supraviețuire mediană de aproximativ 3 luni, chiar și după tratamentul chirurgical. (5)
Recent, s-a raportat că supraviețuirea mediană generală a pacienților cu diseminare peritoneală care au primit chimioterapie hipertermică intraperitoneală, care combină chirurgia citoreductivă și chimioterapia încălzită în cavitatea peritoneală, a fost de 19,2 luni, iar rata de supraviețuire la 3 și 5 ani a fost de 39% și 19%, respectiv. (6) Deși prognosticul pacienților cu diseminare peritoneală derivată din cancerul colorectal s-a îmbunătățit din cauza dezvoltării de noi terapii, sunt necesare terapii mai eficiente.
Concentrându-ne pe mecanismele de metabolizare a cancerului de mai sus, am emis ipoteza că o dietă ketogenică va îmbunătăți starea bolii de diseminare peritoneală prin furnizarea de corpuri cetonice ca sursă de energie și reducerea aportului de glucoză către celulele canceroase. În plus, deoarece corpurile cetonice inhibă histona deacetilaza, (13) ar putea exercita un efect similar cu cel al Vorinostat, (14) un agent anticancer. Deși studiile anterioare au demonstrat eficacitatea unei diete ketogenice asupra cancerelor în experimente pe animale sau studii clinice la scară mică, utilizarea acesteia nu a fost raportată pentru cancerele refractare, în special diseminarea peritoneală.
Aici, demonstrăm că o dietă ketogenică prelungește rata de supraviețuire a unui model de diseminare peritoneală de șoarece. În mod neașteptat, dieta ketogenică nu a avut un efect anticancer împotriva tumorilor peritoneale in vivo, în ciuda scăderii nivelului de glucoză și creșterea nivelului de cetonă din sânge. Mai mult, corpurile cetonice nu au avut niciun efect asupra creșterii celulelor cancerului de colon in vitro. Deși nu ne-am confirmat ipoteza, am constatat că o dietă ketogenică a redus dramatic retenția ascitei asociată cu diseminarea peritoneală. Descoperirile noastre indică faptul că o dietă ketogenică poate fi o terapie potențială nouă pentru diseminarea peritoneală.
Materiale și metode
Animale
Șoarecii masculi BALB/c de 5 săptămâni (CLEA Japan, Inc., Tokyo, Japonia) au fost adăpostiți în cuști de sârmă sub o temperatură controlată (23 ± 3 ° C) și condiții de umiditate (50 ± 20%), cu o Ciclu de 12 ore lumină-întuneric. Șoarecii au fost hrăniți cu chow de laborator comercial și li s-a permis să bea apă ad libitum timp de aproximativ o săptămână înainte de începerea experimentelor. Toate experimentele pe animale au fost conforme cu liniile directoare pentru îngrijirea și utilizarea animalelor de laborator stabilite de Comitetul de utilizare și îngrijire a animalelor din EN Otsuka Pharmaceutical Co., Ltd.
Cultură celulară și model experimental de șoarece de diseminare peritoneală
Linia celulară de colon 26 a fost achiziționată de la RIKEN BioResource Center (Tsukuba, Japonia). Celulele Colon 26 au fost cultivate în mediu RPMI-1640 suplimentat cu 10% ser fetal bovin, 2 mM l-glutamină, 100 U/ml penicilină și 100 μg/ml streptomicină sub 5% CO2 în aer la 37 ° C. 26 de celule de colon cultivate au fost recoltate cu Accutase (Nacalai Tesque, Inc., Kyoto, Japonia) și preparate ca suspensie celulară la o concentrație de 5 × 106 celule/ml în soluție salină tamponată cu fosfat (PBS). Șoarecii au fost inoculați intraperitoneal cu o suspensie celulară de 0,1 ml folosind un ac de 26 G.
Proiectare experimentală
După inocularea tumorii, șoarecii au fost împărțiți în mod aleatoriu în două grupuri și au primit o dietă ketogenică sau o dietă regulată (Tabelul 1) ad libitum. S-a efectuat analiza supraviețuirii și scorurile de sănătate ale șoarecilor au fost înregistrate în funcție de următorii parametri: aspectul 0-2, comportamentul natural 0-3, comportamentul provocat 0-3 și starea corpului 1-5 în conformitate cu metoda lui Paster și colab. . (15) Șoarecii cu un scor total de 3 sau mai puțin au fost eutanasiați uman și s-a înregistrat timpul de supraviețuire.
tabelul 1
Compoziția dietelor obișnuite și ketogene utilizate în acest studiu
| Cazeină | 20.3 | 14.4 |
| Ulei de soia | 7.0 | 72.4 |
| Dextrină | 63.2 | 3.7 |
| AIN-93G amestec mineral | 3.5 | 3.5 |
| Amestec de vitamine AIN-93 | 1.0 | 1.0 |
| Celuloză | 5.0 | 5.0 |
Dieta obișnuită s-a bazat pe compoziția AIN-93G. Dieta ketogenică a constat din ulei praf obținut prin liofilizarea unei emulsii de cazeină și ulei de soia care ar putea fi consumat de animale. Toate ingredientele au fost achiziționate de la Oriental Yeast Co., Ltd. (Tokyo, Japonia).
Pentru a investiga în detaliu efectul unei diete ketogenice asupra condițiilor de boală ale modelului de diseminare peritoneală, șoarecii purtători de celule tumorale au fost hrăniți cu dieta experimentală timp de încă 15 zile ca experiment separat. În cele din urmă, toți șoarecii au fost eutanasiați și tumorile, lichidul de ascită și țesuturile au fost colectate și cântărite.
Măsurători de sânge
În ziua necropsiei, s-au obținut probe de sânge din vena cavă sub anestezie cu izofluran. Pentru analize chimice clinice, toate probele de sânge au fost centrifugate la 1.500 × g timp de 15 minute la 4 ° C, după care s-a colectat serul. β-OHB a fost măsurat folosind Precision Xceed (Abbott Japan Co., Ltd., Tokyo, Japonia). Un analizor hematologic XT-1800iV (SYSMEX Corp., Hyogo, Japonia) și un analizor de chimie clinică (Fuji Drichem 3500V, FUJIFILM Medical Co. Ltd., Tokyo, Japonia) au fost utilizate pentru evaluarea hematologică și, respectiv, pentru chimia serului, conform producătorului. instrucțiuni.
Cuantificarea factorului de creștere endotelial vascular A (VEGF-A)
VEGF-A în ser și lichid de ascită a fost cuantificat printr-un kit Quantikine (R&D Systems, Inc, Minneapolis, MN) conform instrucțiunilor producătorului.
Cuantificarea RT-PCR și ARNm
Pentru prepararea ARN, Isogen (Wako Pure Chemical Industries, Ltd., Osaka, Japonia) a fost utilizat conform instrucțiunilor producătorului. Sinteza ADNc a fost realizată folosind Transcriptaza Prime Script (Takara Bio, Inc., Shiga, Japonia). Pentru RT-PCR semicantitativă, fragmentele specifice genei au fost obținute prin amplificare PCR în fază liniară și normalizate la nivelul β-actinei. Perechile de exemple specifice au fost: VEGF-A 5'-AGACACACCCACCCACATACA-3 '(înainte), 5'-ACATCCTCCTCCCAACACAAC-3' (invers); factorul inductibil hipoxie (Hif) -1α 5'-GGGTACAAGAAACCACCCAT-3 '(înainte), 5'-GAGGCTGTGTCGACTGAGAA-3' (invers); cutie cu furcă O 3A (FoxO3A) 5'-CTGGGGGAACCTGTCCTATG-3 '(înainte), 5'-CTTCATGCGCGTTCAGAATGA-3' (invers); β-actină 5'-AGTGTGACGTTGACATCCGT-3 '(înainte), 5'-TGCTAGGAG CCAGAGCAGTA-3' (invers).
Test WST-8
Pentru numărarea celulelor, am folosit un kit de testare WST-8 (Dojindo, Kumamoto, Japonia) conform instrucțiunilor producătorului. Celulele au fost cultivate cu β-OHB (Sigma, St. Louis, MO) la fiecare concentrație timp de 48 de ore, apoi s-a adăugat un mediu de cultură care conține soluție de WST-8. După o incubare de 1 oră la 37 ° C, absorbanța din fiecare godeu a fost măsurată la lungimi de undă de 450 nm (lungimea de undă de test) și 700 nm (lungimea de undă de referință) cu un cititor de microplăci SH-1000 (CORONA, Niigata, Japonia).
Test de diluare a esterului succinimidilic diacetat de carboxifluoresceină (CFSE)
Măsurarea diviziunii celulare a fost efectuată prin testul de diluție CFSE așa cum s-a descris anterior. (16) Pe scurt, celulele de colon 26 au fost incubate cu CFSE (Wako Pure Chemical Industries, Ltd.) în PBS la 37 ° C timp de 1 oră pentru a aplica eticheta de fluorescență și apoi placate în plăci cu 6 godeuri la o densitate de 2 × 10 5 celule/ml cu β-OHB. După 2 zile de incubație, celulele recoltate au fost excitate cu un laser la o lungime de undă de 488 nm și intensitatea fluorescenței CFSE per celulă a fost cuantificată prin citometru de flux FACSVerse (BD Biosciences, San Diego, CA).
analize statistice
Rezultatele sunt exprimate ca mijloace ± SD. Analiza statistică a fost efectuată prin testul t Student sau testul t Welch pe baza rezultatului unui test F. Metoda Kaplan-Meier a fost utilizată pentru a analiza rata de supraviețuire și testul log-rank a fost aplicat pentru a compara curba de supraviețuire. Valorile P mai mici de 0,05 au fost considerate semnificative statistic.
Rezultate
Dieta ketogenică prelungește supraviețuirea și îmbunătățește scorul stării de sănătate la șoareci cu diseminare peritoneală
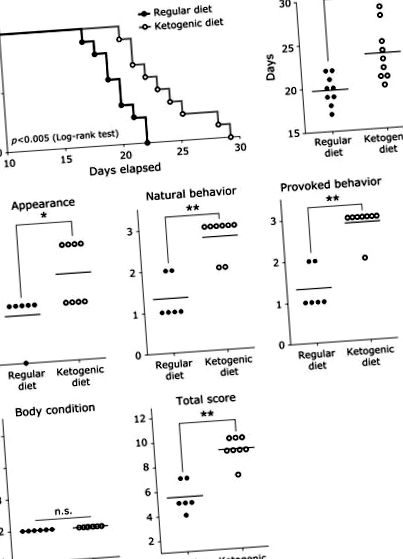
Am examinat influența unei diete ketogene asupra timpului de supraviețuire și a condițiilor de sănătate într-un model de șoarece de diseminare peritoneală. Șoarecii hrăniți cu o dietă ketogenică au avut un timp de supraviețuire crescut statistic în comparație cu șoarecii hrăniți cu o dietă obișnuită (Fig. 1 A). Grupul cu dietă ketogenică a avut un timp mediu de supraviețuire crescut semnificativ în comparație cu grupul cu dietă obișnuită (Fig. 1 B). Starea de sănătate, aspectul, comportamentul natural și scorurile comportamentului provocat au fost semnificativ mai mari în grupul cu dietă ketogenică comparativ cu grupul cu dietă obișnuită, unde scorurile stării corpului (scor 2) nu au fost diferite între grupuri. Scorul total a fost mai mare în grupul cu dietă ketogenică comparativ cu grupul cu dietă obișnuită (Fig. 1 C). De remarcat, comportamentul natural și scorurile de comportament provocat în grupul cu dietă ketogenică au fost foarte ridicate.
Influența dietei ketogene asupra timpului de supraviețuire și a stării de sănătate la șoareci cu diseminare peritoneală. (A) Curba de supraviețuire Kaplan-Meier a șoarecilor cu colon 26 care au avut o dietă obișnuită sau o dietă ketogenică. A fost efectuat testul log-rank pentru distribuția supraviețuirii (p 2). În mod remarcabil, nu a existat nicio diferență semnificativă în greutatea tumorii peritoneale între cele două grupuri, dar șoarecii care au primit dieta obișnuită au avut o cantitate mare de ascită hemoragică, în timp ce șoarecii hrăniți cu dieta ketogenă nu au avut aproape nici o acumulare de ascită. Aceste rezultate sugerează că greutatea corporală a grupului cu dietă obișnuită a crescut din cauza acumulării crescute de ascită și că prelungirea timpului de supraviețuire în grupul cu dietă ketogenică nu s-a datorat reducerii tumorii peritoneale, ci mai degrabă o îmbunătățire a acumulării ascitei.
Dieta ketogenică reduce producția de VEGF-A din celulele tumorale in vivo
Apoi, ne-am concentrat asupra efectului scăderii retenției de lichid de ascită prin dieta ketogenică. Formarea ascitei implică o microvasculatură peritoneală crescută, permeabilitatea celulelor endoteliale, invazia și metastaza celulelor tumorale și mediul anoxic al cavității peritoneale, care sunt asociate cu VEGF-A. (17-20) Prin urmare, am testat dacă dieta ketogenică a afectat producția de VEGF-A, care este implicată în acumularea ascitei. (21) Șoarecii din grupul cu dietă ketogenică au arătat o scădere semnificativă a nivelurilor de VEGF-A în ser și ascită în comparație cu grupul cu dietă obișnuită (Fig. 4 A și B). În plus, nivelurile de ARNm VEGF-A în tumoarea peritoneală au fost scăzute în grupul cu dietă ketogenică. Gena VEGF este indusă de Hif-1, un factor de transcripție, iar activitatea transcripțională Hif-1 depinde de expresia subunității Hif-1α. (22) Prin urmare, am măsurat nivelurile de ARNm Hif-1α în tumori, dar nu a existat nicio diferență semnificativă între cele două grupuri (Fig. 4 C și D). Deși mecanismul implicat este neclar, aceste date implică faptul că dieta ketogenică reduce acumularea de ascită prin suprimarea producției de VEGF-A din tumori la nivelul transcripției.
Efectele β-OHB asupra proliferării colonului 26 și producției de VEGF-A in vitro. (A) Fotomicrografii reprezentative ale celulelor de colon 26 în absența sau prezența β-OHB la concentrațiile indicate după 48 de ore. Fotomicrografiile au fost realizate la mărire × 40. (B) Numărarea celulelor a fost efectuată prin testul WST-8. Rezultatele prezentate sunt media ± SD. (C) Proliferarea celulară evaluată prin testul de diluare CFSE. 26 de celule de colon marcate cu CFSE au fost tratate cu doze diferite de β-OHB. După 48 de ore, intensitatea fluorescenței CFSE a fost cuantificată prin analize de citometrie în flux. (D) Densitățile optice ale nivelurilor de ARNm de FoxO3A și β-actină în celulele 26 de colon la fiecare concentrație de β-OHB după 48 de ore de incubație. Rezultatele au fost analizate prin RT-RCR semicantitativ. (E) Expresia FoxO3A a fost normalizată de β-actină. (F) Celulele Colon 26 au fost tratate cu doze diferite de β-OHB. După 48 de ore, VEGF-A în supernatantul de cultură a fost măsurat prin ELISA. Rezultatele prezentate sunt media ± SD. 5-FU, 5-Fluorouracil.
Discuţie
În acest studiu, am demonstrat că o dietă ketogenică a prelungit timpul de supraviețuire și a îmbunătățit acumularea ascitei, markerii nutriționali și simptomele anemiei, fără a suprima progresia tumorii într-un model de șoarece de diseminare peritoneală. Studii recente au raportat că dieta ketogenică a suprimat progresia tumorii și corpurile cetonice au scăzut direct viabilitatea celulelor tumorale. (25,26) Aici, am constatat că o dietă ketogenică a crescut concentrația corpului cetonei în sângele șoarecilor cu diseminare peritoneală, deși nu a existat nicio modificare a greutății tumorii in vivo. Mai mult, β-OHB, un organism cetonic, nu a modificat creșterea celulelor tumorale in vitro. Alte studii au raportat că corpurile cetonice au promovat dezvoltarea celulelor cancerului de sân uman. (27) Nu toate tumorile sunt implicate în glicoliza aerobă, „efectul Warburg”, iar celulele canceroase utilizează atât glicoliza, cât și fosforilarea oxidativă prin mitocondrii pentru a-și satisface cerințele metabolice. (28) Diferențele dintre aceste rapoarte ar putea fi legate de diferite căi de producere a energiei specifice fiecărei celule canceroase. Prin urmare, acest lucru sugerează că β-OHB nu a avut activitate antitumorală, deoarece celulele 26 din colon utilizate în acest studiu ar putea să nu depindă de glicoliza aerobă.
Pe scurt, o dietă ketogenică a prelungit timpul de supraviețuire și a îmbunătățit performanța motorie și acumularea ascitei fără a suprima creșterea tumorii într-un model de șoarece de diseminare peritoneală. Ameliorarea ascitei ar putea fi legată de atenuarea VEGF-A în tumoră, dar mecanismul detaliat este neclar. O dietă ketogenică poate spori producția eficientă de ATP în mușchi. Din punct de vedere clinic, o dietă ketogenică ar putea fi o abordare pentru îmbunătățirea QOL la pacienții cu diseminare peritoneală.
Contribuțiile autorului
E. Kasumi a efectuat toate experimentele și a scris manuscrisul. N. Sato a supravegheat proiectul general de cercetare.
Mulțumiri
Mulțumim dnei Y. Kuzumaki pentru îngrijirea animalelor; Domnișoară. N. Yoshida pentru cultura celulară; Domnul. K. Sugimura, S. Chiyokawa, S. Shinohara și K. Shigemi pentru a ajuta la pregătirea dietelor experimentale pe animale. Mulțumim și dl. M. Sadakata și H. Kuzuoka pentru discuții utile.
- O dietă ketogenică este un instrument puternic împotriva cancerului - Tratamentul CC
- O dietă hipocalorică pe bază de leguminoase reduce starea proinflamatorie și îmbunătățește caracteristicile metabolice din
- Orice informații despre Ketogenic Diet Epilepsy Foundation
- Un model simplu de NASH murin indus de dietă și chimie, cu progresie rapidă a steatohepatitei,
- Dieta cu oțet de mere pentru a slăbi consumul înainte de mese îmbunătățește digestia, sănătatea intestinelor