Tammy A. Butterick
un sistem de îngrijire a sănătății veteranilor din Minneapolis, Research 151, One Veterans Drive, Minneapolis, MN SUA 55417
Charles J. Billington
un sistem de îngrijire a sănătății veteranilor din Minneapolis, Research 151, One Veterans Drive, Minneapolis, MN SUA 55417
b Departamentul de Științe Alimentare și Nutriție, Universitatea din Minnesota, 225 Știință Alimentară și Nutriție, 1334 Eckles Avenue, St. Paul, MN SUA 55108
c Departamentul de Medicină, Facultatea de Medicină a Universității din Minnesota, Suite 14-110 Phillips-Wangensteen Bldg, 420 Delaware Street SE, MMC 194, Minneapolis, MN SUA 55455
Catherine M. Kotz
un sistem de îngrijire a sănătății veteranilor din Minneapolis, Research 151, One Veterans Drive, Minneapolis, MN SUA 55417
b Departamentul de Științe Alimentare și Nutriție, Universitatea din Minnesota, 225 Știință Alimentară și Nutriție, 1334 Eckles Avenue, St. Paul, MN SUA 55108
Joshua P. Nixon
a Minneapolis Veterans Affairs Health Care System, Research 151, One Veterans Drive, Minneapolis, MN SUA 55417
b Departamentul de Științe Alimentare și Nutriție, Universitatea din Minnesota, 225 Știință Alimentară și Nutriție, 1334 Eckles Avenue, St. Paul, MN SUA 55108
Abstract
Activitate fizică spontană și Orexin
În ciuda influențelor genetice și a mediilor obezigene, înclinația spre obezitate variază în rândul oamenilor și animalelor, unele persoane rezistând obezității [1-6]. Rezistența la obezitate este corelată pozitiv cu activitatea fizică spontană crescută (SPA), definită ca fiind orice mișcare care nu este asociată cu exercițiul formal; SPA contribuie la rezistența la obezitate printr-o creștere a termogenezei de activitate fără exerciții (NEAT) [Revizuită în 7]. Efectul termogen al mișcării subtile, dar cronice, are o influență importantă asupra echilibrului energetic, iar NEAT contribuie semnificativ la rezistența la obezitate [8,5,9,10]. În timp ce studii remarcabile efectuate atât la oameni, cât și la rozătoare au demonstrat că diferențele în activitățile vieții de zi cu zi și înclinația pentru mișcarea generală pot prezice rezistența la obezitate [11,12,5,13], mecanismele neuronale centrale care stau la baza SPA rămân relativ nedefinite.
Se crede că multe regiuni cerebrale, neurotransmițători și neuropeptide contribuie la rezistența la SPA și la obezitate [14]. Neuropeptida hipotalamică orexina (hipocretina), care inițial interesează echilibrul energetic datorită efectului său asupra hrănirii și excitării, s-a dovedit a juca un rol integrator în echilibrul și cheltuielile energetice [15,16]. În ultimul deceniu, munca în laboratorul nostru și în alte părți a demonstrat în mod colectiv importanța orexinei în rezistența la obezitate [17-19.9]. Cu toate acestea, până în prezent nu sunt cunoscute mecanismele de semnalizare celulară prin care orexina produce modificări pe termen lung și scurt în SPA. Dovezile din studiile de ischemie și stres oxidativ au sugerat că semnalizarea orexinei poate influența factorii de transcripție implicați în rezistența la acești factori de stres și că aceste căi ar putea fi implicate în mod critic în efectele orexinei asupra metabolismului. Obiectivul acestei revizuiri va fi evaluarea cascadelor de semnalizare orotină hipotalamică care pot sta la baza mecanismelor prin care orexina conferă rezistență la obezitate.
Rezistența la orezină și obezitate
Una dintre constatările majore care explică diferența de creștere în greutate în acest model este că animalele SAU prezintă un SPA mai mare decât fac mai multe controale predispuse la obezitate [27]. Mai multe linii de dovezi sugerează că orexina contribuie la fenotipul SPA. Se știe că injectarea orexinei A (OXA) în hipotalamusul rostral lateral (rLH), nucleul hipotalamic paraventricular, nucleul accumbens sau al treilea ventricul stimulează SPA atât la modelele de rozătoare monogenetice, cât și la cele poligenetice [28-32] și la șobolani DR și OR. prezintă un răspuns SPA mai mare la orexină decât controalele obeze [19,9]. Calorimetria indirectă arată că SPA indusă de OXA are ca rezultat un consum crescut de oxigen, producția de CO2 și termogeneză [29]. În plus, reacția crescută la OXA la șobolani OR se datorează parțial nivelurilor mai ridicate de exprimare a receptorului orexinei, în special în rLH [17,9]. În timp ce efectele OXA asupra SPA pot fi provocate în mai multe locații specifice ale creierului, o mare parte din munca noastră s-a concentrat astfel pe rLH.
Împreună, dovezile sugerează că diferențele genetice de bază contribuie la rezistența la obezitate, că orexina este o componentă importantă a acestei variabilități și că modelele de rozătoare poligenice descrise mai sus sunt potrivite pentru testarea potențialelor mecanisme creierului de rezistență la obezitate mediate de orexină. Lucrul cu aceste modele animale a definit în mod clar o legătură directă între semnalizarea orexinei și neuromodularea SPA; cu toate acestea, căile de semnalizare celulară prin care orexina mediază SPA și rezistența la obezitate rămân în continuare în mare parte necunoscute [9,38]. Prezentăm aici dovezi din mai multe investigații in vitro, inclusiv date din lucrările noastre în curs și cele din alte modele de rozătoare care nu sunt axate pe orexină, pentru a delimita mecanismele potențiale prin care orexina ar putea afecta rezistența obezității.
Orexinele și transducția semnalului
Orexinele constau din două peptide, OXA și orexin B (OXB; hipocretină 2); ambele sunt produse prin modificare post-traducere de la un precursor comun, prepro-orexina [39-41]. Expresia prepro-orexinei din SNC pare limitată la un subgrup de celule din hipotalamusul lateral și perifornical [40,42], în timp ce fibrele imunoreactive OXA și OXB sunt abundente atât în regiunile hipotalamice, cât și în cele extrahipotalamice [42- 44]. Peptidele Orexin sunt liganzi endogeni pentru doi receptori cuplați la proteina G, receptori orexină 1 și 2 (OX1R și respectiv OX2R; respectiv); receptorii orexinei sunt distribuiți pe scară largă și diferențiat în creier [39,45,46]. Datele farmacologice susțin că OX1R are o selectivitate mai mare pentru OXA, în timp ce OX2R se leagă cu afinitate similară la ambele orexine [39]. Deși se pare că OXB poate induce SPA într-o oarecare măsură [32] și nu respingem un potențial rol al OXB în rezistența la obezitate, în acest moment contribuția OXB la promovarea cheltuielilor energetice este neclară. Prin urmare, această revizuire se concentrează pe OXA; ca atare, numai mecanismele potențiale de transducție a semnalului OXA vor fi abordate direct aici.
Recent, s-a demonstrat că OXA activează căile proteine kinazei (MAPK) activate de mitogen [53]. Profilarea semnalului receptorilor umani OX1R și OX2R recombinați a demonstrat că orexina poate activa receptorul extracelular kinază 1/2 (ERK1/2) și p38, membri proteici ai cascadei MAPK [54]. Un model de supraexpresie OX1R în celulele ovariene de hamster chinez a arătat că activarea orexinei ERK1/2 poate avea loc printr-o cale PLC/PKC, Ras, Src și PI3K [55]. Studiile asupra celulelor rinichiului embrionar uman (HEK-293) transfectate cu OX2R uman demonstrează că activarea OXA a ERK1/2 este predominant un proces Gq/11, Gs și Gi, în timp ce inițierea p38 este independentă de activarea Gq/11 și Gi [54] . În mod colectiv, aceste descoperiri sugerează că activarea subunității G-α OX1R și OX2R de către OXA poate regla răspunsurile orexinei distincte la nivel regional și specifice țesuturilor.
Semnalizarea mediată de orexină și echilibrul energetic
OXA activează MAPK-uri
Posibil rol al PGC-1α
OXA activează HIF1α
Deși un rol specific pentru PGC-1α în hipotalamus și modul în care acesta poate contribui la controlul central al obezității nu este clar în acest moment, datele sugerează că PGC-1α poate fi o parte importantă a unei legături recent descrise între OXA și factorul de transcripție factorul inductibil de hipoxie 1α (HIF-1α). S-a demonstrat recent că OXA crește expresia HIF-1α în țesutul hipotalamic [70]. În timp ce creșterile HIF-1α sunt de obicei asociate cu hipoxie, inducerea OXA a HIF-1α apare în țesutul hipotalamic normal, nehipoxic [70]. OXA s-a dovedit a fi neuroprotector în cortexul cerebral și în cultura celulară hipotalamică în urma factorilor de stres oxidativ [71,38], potențial prin activarea HIF-1α. Studii recente au arătat că, împreună cu MAPK, PGC-1α este important în reglarea expresiei HIF-1α [72,62,73,61]. Așa cum s-a descris mai sus, efectele OXA asupra căilor MAPK ar putea duce la creșterea PGC-1α. Se știe că PGC-1α participă la reglarea HIF-1α în țesutul periferic [61] și probabil ar putea face acest lucru și în hipotalamus.
Mai multe linii de dovezi sugerează că efectele OXA asupra HIF-1α ar putea reprezenta o altă legătură între orexină și căile de semnalizare metabolică celulară relevante pentru obezitate. Noi și alții am legat OXA de metabolismul energetic, arătând că OXA induce expresia HIF-1α în țesutul hipotalamic in vitro (Figura 1) și că acest lucru are ca rezultat creșterea producției de ATP prin fosforilare oxidativă [74,70,38] În studii separate de rozătoare Șoarecii cu pierderea specifică neuronului factorului asparaginil hidroxilazei (FIH) inhibitor HIF-1α au redus greutatea corporală și au fost protejați împotriva creșterii în greutate induse de dietă bogată în grăsimi [75]. În plus, șoarecii lipsiți de proteine funcționale HIF-1α și HIF-2α în neuronii pro-opiomelanocortină (POMC) din nucleul arcuit (șoareci POMC/HIFβ) au afectat consumul de energie, hiperfagia și au crescut masa de grăsime [76]. În același studiu, supraexprimarea virală a HIF-1α în hipotalamusul mediobasal a dus la rezistența obezității în timpul hrănirii cu HFD. Rolul specific al OXA în aceste modele nu a fost evaluat pe deplin, dar literatura actuală sugerează că efectele OXA asupra cascadelor de semnalizare HIF ar putea modifica mecanismele centrale ale cheltuielilor de energie ca răspuns la diferiți factori de stres metabolic, cum ar fi dietele bogate în grăsimi.
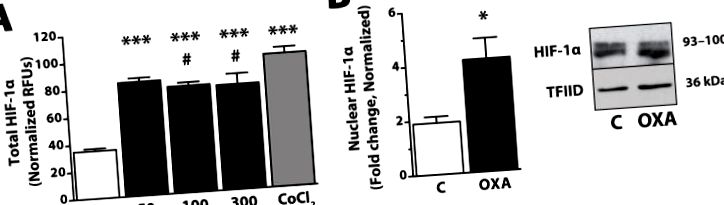
OXA crește atât proteina totală, cât și cea nucleară HIF-1α în decurs de 2 ore într-o linie celulară hipotalamică imortalizată. (A) Nivelurile de proteine au fost determinate printr-un test ELISA în celule (R&D Systems, Minneapolis, MN SUA) în urma tratamentului OXA (Phoenix Pharmaceuticals, Burlingame, CA SUA; 50, 100 sau 300 nM) sau controlul pozitiv al CoCl2 (Sigma, St Louis, MO SUA; 150 μM). Pe scurt, celulele intacte au fost fixate cu 4% formalină după tratamentul cu OXA, incubate cu anticorp primar (anti-HIF-1α sau anti-citocrom-C) urmat de anticorp secundar (fiecare conținând doi conjugați diferiți marcați distinct). Celulele au fost testate prin citirea unităților fluorescente relative (RFU) pentru fiecare anticorp secundar. Valorile normalizate la proteina de menaj citocrom-C; n = 3-6/grup; *** p Figura 2, datele actuale din mai multe modele independente in vitro și rozătoare susțin ipoteza că creșterea mediată de OXA a cheltuielilor de energie și, astfel, proprietățile de rezistență la obezitate ale orexinei, ar putea depinde în parte de cascadele de semnalizare care implică MAPK, PGC- 1α și HIF-1α. În mod colectiv, aceste linii independente de dovezi susțin ideea că acțiunile OXA asupra neuronilor responsivi declanșează efecte pleiotropice asupra expresiei genelor și ale căilor de mesagerie secundare importante în reglarea metabolismului neuronal intracelular, care se manifestă în cele din urmă prin creșterea rezistenței la SPA și obezitate. O investigație suplimentară a implicării orexinei în căile de semnalizare prezentate aici va oferi o perspectivă asupra mecanismelor care influențează starea metabolică a neuronilor receptivi la OXA și vor elucida modul în care aceasta influențează în cele din urmă cheltuielile de energie și înclinația pentru obezitate.
Reprezentarea schematică a căilor ipotetice de semnalizare a orexinei. Orexinele A și B (OXA, OXB) acționează asupra receptorilor orexinei 1 și 2 (OX1R, OX2R). Orexinul este cunoscut pentru creșterea activării (fosforilării) kinazelor MAP ERK1/2 și p38 MAPK. Această activare pare a fi mediată în primul rând de semnalizarea Gq/11, dar Gs/Go poate fi mai important pentru OX2R. Atât OXA, cât și p38 MAPK pot crește activarea și exprimarea HIF-1α; mecanismul poate răspunde pe coactivatorul transcripțional PGC-1α. PGC-1α funcționează ca o legătură directă între stimulii fiziologici externi și reglarea biogenezei mitocondriale și este un facilitator cheie pentru producția de ATP. PGC-1α este activat de p38 MAPK și este un regulator cunoscut al expresiei HIF-1α în țesutul periferic. Creșterea HIF-1α are ca rezultat modificări ale expresiei genelor care duc la creșterea fosforilării oxidative și scăderea peroxidării lipidelor.
Mulțumiri
Autorii au primit sprijin de la Departamentul SUA pentru Cercetare și Dezvoltare pentru Reabilitarea Afacerilor Veteranilor, subvenția BX001686 și R01 DK078985.
- Inhibitor al activatorului de plasminogen - 1, inflamație, obezitate, rezistență la insulină și risc vascular -
- Reducerea în obezitate HuffPost Life
- Rezistența pacientului în tulburările de alimentație psihiatrice
- Rolul microcirculației renale în progresia leziunii renale cronice la obezitate - FullText -
- Grăsimea perivasculară și relevanța microcirculației pentru rezistența la insulină, diabet și