Marcio C. Mancini
1 Unitatea de obezitate și sindrom metabolic, Serviciul de endocrinologie și metabolizare, Spitalul Clinici, Școala de Medicină a Universității São Paulo, São Paulo, Brazilia
2 Laborator de carbohidrați și radioimunotest LIM-18, Facultatea de Medicină a Universității São Paulo, São Paulo, Brazilia
3 Secretariatul Serviciului Endocrinologie și Metabolism, Av. Dr. Enéas de Carvalho Aguiar, 255, 7º andar, camera 7037, São Paulo, SP 05403-000 Brazilia
Maria Edna de Melo
1 Unitatea de obezitate și sindrom metabolic, Serviciul de endocrinologie și metabolizare, Spitalul Clinici, Școala de Medicină a Universității São Paulo, São Paulo, Brazilia
2 Laborator de carbohidrați și radioimunotest LIM-18, Facultatea de Medicină a Universității São Paulo, São Paulo, Brazilia
Abstract
fundal
Mai mult decât o simplă consecință a alegerilor slabe de stil de viață, obezitatea este o boală complexă, poligenică, multifactorială, cronică și rezistentă la multe forme de tratament. Obezitatea predispune la dezvoltarea bolilor cardiovasculare (BCV), diabet zaharat tip 2 (T2D), hipertensiune și numeroase alte afecțiuni [1].
În perioada cuprinsă între 1980 și 2014, prevalența mondială a obezității s-a dublat mai mult. Potrivit Organizației Mondiale a Sănătății (OMS), peste 1,9 miliarde de adulți cu vârsta peste 18 ani erau supraponderali (38% dintre bărbați și 40% dintre femei), dintre aceștia peste 600 de milioane erau obezi (11% dintre bărbați și 15% dintre femei ) în 2014. Patruzeci și două de milioane de copii cu vârsta sub 5 ani erau supraponderali sau obezi în 2013. În țările emergente, creșterea supraponderalității și obezității la copii a fost cu peste 30% mai mare decât cea a țărilor dezvoltate [2]. De exemplu, în Brazilia, 16,8% dintre bărbați și 24,4% dintre femei erau obezi, în timp ce 56% din populația adultă era supraponderală în 2013 [3].
Indicele de masă corporală (IMC) este o încercare de a cuantifica cantitatea de masă tisulară (mușchi, grăsime și os) în mod individual, iar categoriile IMC sunt definite după cum urmează: slab sub 18,5, greutate normală 18,5-24,9, supraponderal 25-29,9 și atârnă peste 30 kg/m 2 [2]. În conformitate cu OMS, asiaticii orientali cu greutate normală au un IMC 18,5-23, supraponderali 23-27,4 și obezi peste 27,5 kg/m 2 [4]. IMC are limitări semnificative, deoarece nu prezintă întotdeauna riscul altor afecțiuni cronice legate de greutate [5]. Sharma și colab. au propus un sistem clinic simplu și funcțional de stadializare, și anume Edmonton Obesity Staging System (EOSS). Atunci când este utilizat împreună cu alte clasificări antropometrice, EOSS oferă o măsurare mai precisă a riscurilor de sănătate legate de obezitate, deoarece încorporează prezența comorbidităților pentru a ajuta la luarea deciziilor în practica clinică [6], ceea ce este important, având în vedere că obezii sănătoși din punct de vedere metabolic aproximativ 20% dintre indivizii obezi [7].
În Statele Unite, prevalența crescută a obezității este responsabilă de aproape 40 de miliarde de dolari din cheltuielile medicale crescute până în 2006, inclusiv 7 miliarde de dolari din costurile medicamentelor eliberate pe bază de rețetă. Finkelstein și colab. au arătat în ce măsură excesul de greutate a crescut cheltuielile medicale anuale: costurile excesului de greutate și ale obezității ar fi putut fi de până la 78,5 miliarde de dolari în 1998 și 147 de miliarde de dolari în 2008 [8]. Pe baza datelor din 2000 până în 2005, Cawley și Meyerhoefer au estimat că costurile de îngrijire medicală din Statele Unite ale bolilor legate de obezitate la adulți sunt de 209,7 miliarde de dolari, ceea ce corespunde cu 20,6% din cheltuielile naționale de sănătate [9].
Factorii care duc la dezvoltarea obezității au fost studiați pe larg în ultimii ani. Reglarea centrală a apetitului, în special în ceea ce privește apetitul hedonic, este un domeniu extrem de interesant. Recent, au fost aprobate noi medicamente pentru tratamentul obezității în Statele Unite: liraglutidă, fentermină/topiramat, naltrexonă/bupropionă și lorcaserină.
Liraglutida este un agonist al receptorului peptidei 1 (GLP-1) asemănător glucagonului care împarte 97% omologie cu GLP-1 nativ, extinzând timpul de înjumătățire circulant al GLP-1 de la 1 la 2 minute până la 13 ore. Liraglutida a fost aprobată pentru prima dată pentru tratamentul T2D în Europa în 2009 [10]. Dintre noile medicamente pentru obezitate, liraglutida este cea mai studiată, în special în ceea ce privește efectele sale importante prin acțiuni asupra sistemului limbic [11].
Această revizuire va aborda principalele constatări privind reglementarea centrală a poftei de mâncare și principalele studii cu noile medicamente anti-obezitate, cu un accent mai mare pe liraglutidă 3,0 mg.
Fiziopatologia obezității
Pe lângă factorii binecunoscuți care duc la obezitate, cum ar fi creșterea aportului de energie prin ingestia de alimente procesate cu conținut ridicat de energie și reducerea activității fizice, există mai mulți factori diferiți de luat în considerare. Unii factori care contribuie la obezitate includ microbiota intestinală, perturbatorii endocrini, epigenetica, creșterea vârstei materne, fecunditatea mai mare în rândul persoanelor cu adipozitate mai mare, împerecherea asortativă, datoria de somn, iatrogeneza farmaceutică, reducerea variabilității temperaturilor ambiante și efectele intrauterine și intergeneraționale [12]. ]. Adipozitatea umană și predispoziția către creșterea în greutate sunt influențate de mai multe gene, iar cea mai probabilă estimare a eredității grăsimii corporale la om variază de la aproximativ 25 la 75% [13]. Mutațiile genice care sunt singure suficiente pentru a provoca obezitatea umană sunt extrem de rare. Au fost raportate aproape 176 de cazuri de obezitate umană din cauza mutațiilor la peste zece gene diferite. În mod vizibil, aproape toate aceste mutații sunt delimitate în calea leptină/melanocortină a hipotalamusului, care este esențială în ajustarea homeostaziei energetice a întregului corp [14].
Studiul obezității obișnuite sau obezității poligenice este abordat prin studii de legătură, studii de asociere a genelor candidate și studii de asociere la nivel de genom (GWAS), în încercarea de a găsi asociații între variațiile genetice și o trăsătură legată de obezitate. Până în prezent, GWAS a identificat aproape 100 de loci asociați cu trăsături legate de obezitate, printre care cel mai relevant este polimorfismul rs9939609 localizat în gena FTO [15, 16].
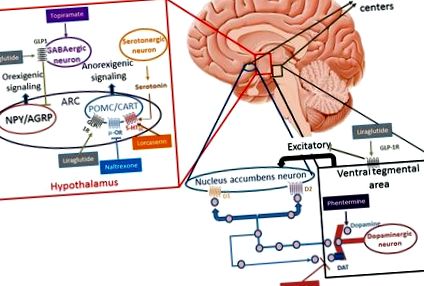
Incapacitatea de a limita consumul excesiv de alimente este probabil un proces cheie care contribuie la creșterea necontrolată în greutate, în principal pentru că pare satisfăcător să consumi un tip de aliment mai energic și obezogen. Valoarea hedonică ridicată și alimentele tentante sunt principalii vinovați de a mânca în exces sau de a mânca dincolo de necesitatea metabolică imediată (comportament de recompensare a alimentelor) [17]. Relația dintre consumul și consumul de energie este modulată nu numai de factori de mediu și de comportament, ci și de determinanți genetici și mecanisme de feedback neuroendocrin. Aceste mecanisme sunt reglementate de hipotalamus, locul central pentru reglarea homeostatică a greutății corporale. Hipotalamusul integrează semnale hormonale periferice din tractul gastro-intestinal [grelină, colecistochinină, peptida YY, polipeptidă pancreatică (PP), GLP-1], pancreas (insulină) și țesut adipos (leptină), care modifică orexigenul central [de ex. neuropeptidă Y (NPY)], peptidă asociată cu agouti (AgRP) și anorexigenă [de ex. hormon de stimulare alfa-melanocitar (α-MSH) și peptidă derivată proopiomelanocortină (POMC)], transcriptă reglementată de cocaină și amfetamină [CART]) neuropeptide [18].
În studiile pe animale, GLP-1 stimulează direct neuronii POMC/CART și inhibă indirect neurotransmisia în neuronii care exprimă NPY și AgRP prin semnalizare dependentă de acid gamma-amino butiric (GABA) [19-21]. Aceste descoperiri indică faptul că receptorii GLP-1 (GLP-1R) de pe neuronii arcuați (ARC) care exprimă POMC/CART sunt susceptibili de a media pierderea în greutate indusă de liraglutidă (Fig. 1). Pierderea în greutate este redusă prin blocarea locală a GLP-1R pe neuronii ARC cu un antagonist al GLP-1R [22]. Deși este bine documentată în modelele animale, acțiunea liraglutidei în hipotalamusul uman este mai dificil de demonstrat. Studiile cu imagistică prin rezonanță magnetică funcțională (RMN) la om nu au identificat modificări ale activității sale neuronale cu utilizarea liraglutidei; această absență a semnalului se poate datora dimensiunii reduse a hipotalamusului și imediatității acestuia către sinusuri [23, 24].
Mecanismul de acțiune al medicamentelor anti-obezitate. 5-HT2C-R: receptor 2C 5-hidroxitriptamină (serotonină); Nucleul arcului ARC, transcriptul CART cocaină și amfetamină, receptorul D1 al dopaminei D1, receptorul D2 al dopaminei D2, transportorul DAT al dopaminei, acidul GABA gamma-aminobutiric, receptorul GLP-1R al peptidei-1 glucagon, neuronii NPY/AgRP Y care exprimă neuropept și peptida asociată cu agouti, proopiomelanocortina POMC, receptorul μ-OR μ-opioid
(Adaptat din Kim și colab., Baggio și colab. Și Wang și colab. [19-21])
Reglarea apetitului hedonic se efectuează în regiunile limbice, cum ar fi hipocampul, amigdala, nucleul accumbens, zona tegmentală ventrală, girusul cingulat, cortexul orbitofrontal, insula și cortexul prefrontal. Aceste zone sunt implicate în dezvoltarea răspunsului condiționat și a recompensei. Deși neurotransmițătorii clasici implicați în această rețea sunt dopamina, serotonina și GABA, mai multe studii pe animale subliniază contribuția GLP-1 în sistem [25, 26]. Hsu și colab. a evaluat comportamentul alimentar al șobolanilor care au primit exedin-4 în porțiunea ventrală a formațiunii hipocampice. Pe lângă reducerea aportului total de energie și a greutății, s-a observat o scădere semnificativă a aportului de grăsimi și o creștere a consumului standard de furaje, când li s-a permis să aleagă ce mâncare să mănânce. Această constatare evidențiază importanța GLP-1 în regiunile creierului implicate în controlul comportamentelor învățate și motivaționale în consumul de alimente [26].
Farr și colab. a identificat, prin analize imunohistochimice, prezența GLP-1R în nucleii hipotalamici, medulla oblongată, zona postrema și cortexul parietal al creierului uman [23]. Cortexul parietal inferior face parte din rețeaua de atenție, care poate fi activată de stimuli importanți sau foarte de dorit, cum ar fi mâncarea gustabilă. Oamenii care iau liraglutid au prezentat în RMN o scădere a activării cortexului parietal ca răspuns la hrana mai dorită. Această activare parietală ca răspuns la alimentele cu conținut ridicat de energie este invers corelată cu pierderea în greutate. Pacienții cu cea mai mică activare parietală inferioară au raportat că ar fi mai puțin plăcut să mănânce în timpul tratamentului cu liraglutidă, în timp ce se află în post. În același studiu, s-a raportat o scădere a activării la insulă și putamen la pacienții care iau liraglutidă atunci când sunt expuși la indicii alimentare gustoase. Insula participă la procesarea sănătății și la sacietate, la rândul său, putamenul pare să contribuie la procesarea recompensei alimentare [23]. Un studiu anterior cu exenatidă, un alt agonist al receptorului GLP-1 (derivat din exendin-4), a arătat, de asemenea, un răspuns scăzut al creierului la imaginile gustative ale alimentelor în insulă, amigdala, putamen și cortexul orbitofrontal [27].
Un alt studiu recent care utilizează fMRI a determinat efectele GLP-1 endogen (folosind un antagonist GLP-1) și ale liraglutidei asupra activării sistemului nervos central (SNC) la indivizi slabi sănătoși, precum și la pacienții cu T2D. S-a demonstrat că GLP-1 endogen afectează reacția centrală la consumul de alimente plăcute. În comparație cu subiecții slabi sănătoși, pacienții cu T2D au prezentat activarea redusă a insulei drepte prin lapte de ciocolată. La pacienții obezi cu T2D, liraglutida a îmbunătățit deficitul observat ca răspuns la alimentele plăcute, ceea ce poate contribui la pierderea în greutate observată cu liraglutidă [28].
Un aspect care a fost luat recent în considerare în studiul obezității este adaptările hormonale la scăderea în greutate. Sumithran și colab. au înrolat 50 de pacienți nondiabetici supraponderali sau obezi într-un program de scădere în greutate de 10 săptămâni constând într-o dietă cu energie foarte scăzută. La sfârșitul a 10 săptămâni, după o pierdere medie în greutate de 13,5 ± 0,5 kg, au existat reduceri semnificative ale concentrațiilor peptidelor anorectice leptină, peptida YY, colecistochinină, insulină și amilină. Au existat, de asemenea, creșteri ale concentrațiilor de peptide orexigenice grelină, polipeptidă insulinotropă glucozodependentă (GIP) și PP. La un an după pierderea inițială în greutate, au existat încă diferențe semnificative în concentrațiile medii ale acestor peptide în comparație cu valoarea inițială; Nivelurile GLP-1 au fost, de asemenea, mai mici decât valoarea inițială. Autorii au concluzionat că modificările mediatorilor apetitului circulanți care încurajează recâștigarea greutății persistă după un an de scădere în greutate. Ele subliniază importanța strategiilor de contracarare a acestei schimbări pentru a preveni recidiva obezității, altfel, rezultatele pe termen lung vor rămâne nesatisfăcătoare [29].
Tratamentul obezității
Tratamentul non-farmacologic al obezității poate fi eficient, dar rata de succes pe termen lung este scăzută și recâștigarea greutății pierdute este o problemă majoră. Studiile randomizate au arătat că o scădere inițială mai mare în greutate realizată cu modificări ale stilului de viață asociate cu alte strategii (de exemplu, diete cu formule lichide sau medicamente anorectice) îmbunătățește menținerea pe termen lung a greutății, cu condiția ca aceasta să fie urmată de 1-2 ani de întreținere integrată a greutății program care constă din intervenții asupra stilului de viață care implică schimbări dietetice, educație nutrițională, terapie comportamentală și activitate fizică sporită. Prin urmare, o scădere inițială mai mare în greutate ca prim pas cu o intervenție farmacologică poate duce la îmbunătățirea menținerii greutății susținute [30].
Modificarea greutății corporale după tratamentul persoanelor obeze cu patru doze de liraglutidă (1,2, 1,8, 2,4 sau 3,0 mg) sau la placebo administrat o dată pe zi subcutanat sau orlistat (120 mg) de trei ori pe zi pe cale orală. Datele sunt medii (IC 95%) pentru populația ITT cu ultima observare reportată (LOCF)
Adaptat de la Astrup și colab. [35]
Proporția indivizilor cu prediabet în populația ITT la randomizare și săptămâna 20. Indivizii incluși sunt cei cu evaluare validă la începutul și sfârșitul perioadei de studiu de 20 de săptămâni. * P = 0,007 față de placebo. † P = 0,008 vs orlistat. ‡ P ≤ 0,0001 vs placebo sau orlistat
Adaptat de la Astrup și colab. [35]
Adaptat din Pi-Sunyer și colab. [37]
TA sistolică și diastolică a scăzut mai mult în grupul cu liraglutidă decât în grupul placebo până în săptămâna 56 și nivelurile de lipide în repaus alimentar, proteina C reactivă cu sensibilitate ridicată, inhibitorul activatorului plasminogen-1 și adiponectina au prezentat o îmbunătățire mai mare în grupul cu liraglutidă grup placebo [37]. Tratamentul cu liraglutidă a fost asociat cu îmbunătățirea calității vieții legate de sănătate, în special a funcției fizice, comparativ cu placebo [37].
În ceea ce privește evenimentele adverse, evenimentele gastro-intestinale au fost cele mai frecvente efecte secundare și au fost raportate mai frecvent cu liraglutidă decât cu placebo. Greața și vărsăturile au apărut mai des la indivizii tratați cu liraglutidă decât la cei tratați cu placebo, în principal în cele 4-8 săptămâni după inițierea tratamentului, dar au fost în principal tranzitorii și au dus rar la întreruperea tratamentului [37].
- Femeile, farmaciile și World Wide Web ar putea fi răspunsul la epidemia de obezitate PubMed
- Recenzie nedeclarată a obezității mondiale în paradis - combaterea grăsimilor la televiziunea și radioul Samoa The Guardian
- Ziua Mondială a Obezității 2019 Usturoiul îți poate îndeplini visul de a pierde în greutate și de a avea un corp subțire
- Ziua Mondială a Obezității 2018 Cum ajută chimenul la pierderea în greutate
- Primul studiu mondial leagă obezitatea de plasticitatea creierului redusă