Reglarea metabolică este un termen folosit pentru a descrie procesul prin care căile metabolice (atât căile anabolice/biosintetice, cât și căile catabolice/degradative) sunt reglementate la mamifere.
Termeni asociați:
- Glucoză
- Diabetul zaharat
- Metabolism
- Enzimă
- Proteină
- Insulină
- Obezitatea
- Diabet zaharat dependent de insulină
Descărcați în format PDF
Despre această pagină
Fundamente inginerești ale biotehnologiei
Abstract
Înțelegerea controlului metabolic este o fațetă importantă a manipulării căilor metabolice. S-a documentat bine că simpla eliminare a căilor concurente și a efectelor de reglementare are ca rezultat un succes limitat. Cel mai adesea, astfel de modificări nu au ca rezultat nicio modificare sau un efect mai puțin benefic decât s-a prevăzut. Analiza de control oferă o analiză cantitativă a sistemului, permițându-ne să înțelegem mai bine modul în care sistemele răspund la diferite perturbații. În consecință, cunoașterea sistemelor de răspuns la perturbare ne permite să vizăm elemente specifice pentru modificare, astfel încât să se obțină răspunsul dorit. Acest articol se va concentra pe diferitele abordări dezvoltate pentru controlul metabolic, precum și pe abordările experimentale dezvoltate pentru a obține date pentru analiza computațională. Cu o înțelegere deplină a dinamicii controlului metabolic, se poate realiza o manipulare reușită a fluxului metabolic și a concentrațiilor de metaboliți.
Biologie celulară moleculară
Introducere
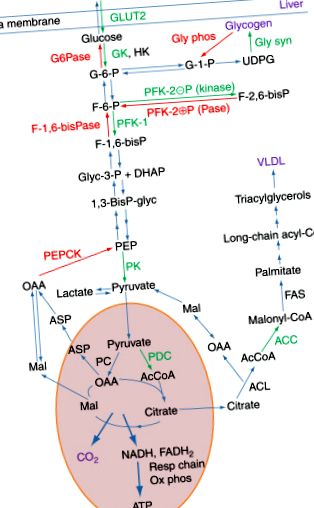
Scopul acestui articol este de a oferi un rezumat al principiilor bine stabilite de reglare metabolică în celule și țesuturi ale animalelor. Mai degrabă decât o descriere exhaustivă a ceea ce se știe despre reglarea unei anumite enzime sau a unei căi metabolice, discutăm reglarea metabolică în contextul condițiilor fiziologice care vor fi de interes pentru majoritatea cititorilor. În experiența noastră ca investigatori în acest domeniu, precum și ca profesori de biochimie medicală, am constatat că modurile remarcabile prin care ficatul este capabil să se schimbe de la un organ care sintetizează combustibili pentru depozitare în stare alimentată la un organ care furnizează combustibili pentru restul corpului este o modalitate bună de a obține o apreciere a diferitelor mecanisme prin care sunt reglementate căile metabolice (Figura 1).
Figura 1. Căile implicate în metabolismul glucozei în ficat în timpul stărilor de hrănire și de post. Principalele căi descrise aici sunt: glicoliza, sinteza și degradarea glicogenului, ciclul acidului tricarboxilic, lipogeneza și gluconeogeneza. Aceste căi sunt prescurtate pentru a evidenția enzimele de reglare cheie. Enzimele cheie și transportorul în căile biosintetice din ficat în timpul alimentării sunt prezentate în verde, iar enzimele cheie din căile degradante care funcționează în stare de post sunt în culoare roșie. Abrevierea enzimatică utilizată este: HK, hexokinază; GK, glucokinază; GLUT2, transportor de glucoză 2; Gly syn, glicogen sintază; Glifos, glicogen fosforilaza; PFC-1, fosfofructokinază-1; PFC-2, fosfofructokinază-2; F-1,6-bisPază, fructoză-1,6-bisfosfatază; PC, piruvat kinază; PDC, complex piruvat dehidrogenază; PC, piruvat carboxilază; ACL, ATP-citrat liază; ACC, acetil-CoA carboxilaza; FAS, acizi grași sintaza. Abrevierile utilizate pentru intermediari sunt utilizate în mod obișnuit în căile metabolice.
Reglarea metabolică de către autoritățile de reglementare globale ca răspuns la mediul cultural
Abstract:
Mecanismele de reglare metabolică de bază sunt explicate în termeni de reglare a catabolitului, reglarea azotului și reglarea fosfatului, precum și efectele pH-ului acid, șocului termic și foametei nutrienților asupra reglementărilor metabolice. Atenția se concentrează asupra efectelor regulatorilor globali (factori de transcripție cu factori sigma), cum ar fi cAMP-Crp, Cra, Mlc, RpoN, ArcA/B, Fnr, SoxR/S, PhoR/B, RpoH și RpoS asupra metabolismului. Se explică, de asemenea, efectele eliminării genelor precum cra, crp, mlc, arcA/B, phoR/B, soxR/S și rpoS, asupra reglării metabolice.
Biologia moleculară a arestinelor
1 O scurtă introducere în reglarea metabolică
Reglarea metabolică este mecanismul fiziologic prin care organismul preia substanțe nutritive și furnizează energie, după cum este necesar. Reglarea metabolică funcționează în cele din urmă la nivel molecular, în principal prin modularea activităților enzimatice care funcționează împreună ca un întreg sistem pentru a simți echilibrul energiei care intră și a energiei necesare. Diferitele organe din corp au propriile lor modele caracteristice de metabolism în funcție de funcțiile lor în organism. Astfel, este esențial ca căile metabolice să interacționeze într-un sens dinamic, în întregul organism. Mai mult, sistemele endocrine și nervoase trebuie să se coordoneze cu precizie pentru a controla fluxul de energie din corp.
O mare parte din reglarea metabolică este guvernată de hormoni care sunt eliberați prin fluxul sanguin și acționează prin receptori celulari specifici. Atât receptorii de la suprafața celulelor (care leagă de obicei hormonii peptidici), cât și receptorii nucleari (care leagă hormonii tiroidieni, hormonii steroizi și alți liganzi permeanți la membrană) joacă roluri critice în reglarea metabolică. Hormonii care acționează prin receptorii de la suprafața celulei sunt implicați în ajustări metabolice rapide. Acești receptori semnalizează prin intermediul adenozinei 3,5-monofosfat ciclic a moleculei mici (AMP ciclic sau AMPc) și a fosfatidilinozitolului (3,4,5) trisfosfat al membranei. După aceasta, activitățile enzimelor metabolice din aval sunt reglementate prin modificare covalentă, în special fosforilarea și defosforilarea și/sau translocarea enzimelor în celulă. Activarea receptorilor nucleari de către liganzii lor, pe de altă parte, controlează direct transcrierea genelor metabolice și duce la reglarea metabolică pe termen lung.
Studiile efectuate cu mai multe familii diferite de receptori au arătat că β-arrestinele determină specificitatea, spațialitatea și temporalitatea semnalelor celulare, precum și mișcarea intracelulară a receptorilor și a altor complexe de semnal. 1-4 Legarea β-arrestinelor de receptorii cuplați la proteina G legați de ligand (GPCR) decuplează fizic proteina G de receptor și pune capăt eficient semnalizării mediate de proteina G. Prin cuplarea la un receptor activat de ligand, β-arrestinele inițiază, de asemenea, semnalizarea GPCR într-un mod independent de proteina G. Mai mult, β-arrestinele schelează diverse complexe de semnal, conectând astfel receptorii activi cu seturi distincte de proteine accesorii și efectoare. Având în vedere rețeaua complexă de reglare metabolică compusă dintr-o varietate de hormoni și receptorii lor specifici, nu ar trebui să fie o surpriză faptul că funcționarea corectă a β-arrestinelor este indispensabilă funcției metabolice a organismului. Acest capitol rezumă funcția β-arrestinelor în reglarea metabolică și, de asemenea, discută asocierea acestora cu sindroame metabolice, inclusiv rezistența la insulină, diabetul de tip 2 și obezitatea.
Metabolism principal
1.14 Reglarea metabolică și ciclul inutil
Reglarea metabolică a unei celule realizează creșterea celulelor prin optimizarea generării de ATP (catabolism) și a sintezei celulare (anabolism) în timpul fazei de creștere a celulei. Mai mult, celula reglează metabolismul pentru a face față diferitelor tipuri de stresuri cauzate de schimbările din mediul de cultură și, prin urmare, nu este ușor de înțeles întregul mecanism de reglare metabolică. Reglarea metabolică are loc atât la nivelul genelor, cât și la nivelul enzimei, unde reglarea nivelului enzimei se face de obicei prin reglarea alosterică, care se obține prin schimbarea structurii 3D prin legarea metaboliților specifici etc. De exemplu, G6PDH și 6PGDH sunt inhibate de NADPH, în timp ce Pfk este inhibat de PEP. PDH este, de asemenea, inhibat de NADH, ATP, AcCoA și așa mai departe. Luați în considerare reglarea Pfk și Fbp în calea EMP, unde Pfk catalizează următoarea reacție:
în timp ce Fbp catalizează reacția inversă, cum ar fi:
Dacă aceste reacții apar în același timp, energia generată de o cale este utilizată de cealaltă cale fără o utilizare eficientă. Acest fenomen se numește a ciclu inutil, unde acest lucru se datorează controlului independent de către fiecare cale. Un fenomen similar poate fi observat pentru Ppc și Pck pentru căile anaplerotice și gluconeogenetice, cum ar fi:
Rețineți că acestea apar în funcție de condițiile culturii.
Tulburări ale somnului ritmului circadian (CRSD)
M.T. Bună, C.M. Pandya, în Enciclopedia somnului, 2013
Opioide, răspunsuri hipercapnice și ventilatorii hipoxice
Controlul metabolic al respirației este determinat în mare parte de interacțiunile dintre chemoreceptorii centrali și periferici. Chimioreceptorii centrali sunt localizați în mai multe locuri din cadrul SNC, inclusiv nucleul tractus solitarius, grupul respirator dorsal, rafe medular, pre-BotC și grupul respirator retrotrapezoid/parafacial. Acești chemoreceptori centrali simt în primul rând H +/PCO2 în SNC. Gradul de stimulare ventilatorie a sistemului respirator pentru un nivel dat de PaCO2 este cunoscut sub numele de HCVR. În schimb, gradul de stimulare ventilatorie pentru o scădere dată a tensiunii oxigenului (PaO2) din sânge este cunoscut sub numele de HVR și este mediat predominant la locul chemoreceptorilor periferici. Situați în corpuri carotide, chemoreceptorii periferici detectează modificări în principal în PaO2, cu răspunsuri sinergice la dioxidul de carbon și pH. Chimioreceptorii periferici au intrări și interacționează cu centrele respiratorii centrale, care comunică apoi cu neuronii motori care inervează mușchii respiratori majori (adică diafragma, intercostalii interni/externi și musculatura abdominală).
Receptorii opioizi se află în întregul sistem nervos periferic și SNC. Toți opioizii stimulează receptorii μ-opioizi care sunt exprimați atât pe neuronii respiratori, cât și pe cei ai durerii. Toate aspectele respirației, inclusiv frecvența respiratorie, volumul mareelor și ventilația mică, sunt suprimate în prezența opioidelor. Scăderea HVR și HCVR duce la stimulare respiratorie mai puțin robustă pentru un anumit grad de hipoxie (PaO2 scăzut) și hipercapnie (PaCO2 crescut). O chemosensibilitate periferică crescută (HVR) s-a dovedit a fi un factor predispozant pentru dezvoltarea SDB. Cu toate acestea, câștigul total al controlerului este compus atât din HCVR, cât și din HVR și, după cum sa menționat anterior, răspunsul anterior este diminuat de opioide.
Efectul unei eliminări specifice a genei asupra metabolismului
Abstract:
Reglarea metabolică a eliminării genei specifice Escherichia coli este explicată în termeni de fluxuri metabolice de 13 C, activități enzimatice, concentrații intracelulare de metaboliți și expresii genetice. Se arată că calea glioxilatului este activată în mutanții pckA și ppc, unde randamentul celulei poate fi îmbunătățit în comparație cu tipul sălbatic. În cazul mutantului gnd E. coli, calea ED este activată acolo unde Mez este activat atât pentru mutanții zwf cât și pentru cei gnd pentru a susține producția de NADPH. Este analizat mecanismul de reglare al mutantului pykF E. coli, unde se arată că este robust împotriva acestor knock-out genelor prin redirecționarea căilor. Mai mult, sunt explicate și reglementările metabolice ale mutanților lpdA, sucA și C, precum și mutanților icdA și ldhA, pe baza analizei fluxului metabolic 13 C și a altor informații.
Fixarea fotosintetică a dioxidului de carbon
Reglarea ciclului Calvin
Epigenetica bolilor metabolice
Dieta, metabolismul și epigenomul
Reglarea metabolică funcționează în cele din urmă la nivel molecular. Cromatina, care se află sub control genetic și epigenetic, facilitează reglarea transcripțională între tipurile de celule și dovezile crescând indică o interfață de reglare între cromatină și homeostazia energetică [18]. Influența factorilor dietetici asupra reglării epigenetice oferă o explicație a modului în care stilul de viață interacționează, epigenomul afectând metabolismul uman în sănătate și boală.
Impactul donatorilor de metil, al componentelor bioactive alimentare și al nutrienților asupra modificărilor epigenetice a fost frecvent studiat într-un cadru în care este investigat impactul dietei materne asupra metilării ADN la descendenți. De exemplu, suplimentarea dietetică, cu acidul omega-3 acid docosahexaenoic în timpul sarcinii, a determinat niveluri crescute de metilare a ADN ale factorului de creștere a insulinei genei imprimate 2 (IGF2), care este important pentru creștere și dezvoltare, în sângele din cordonul ombilical de la sugari [25 ]. Cel mai vizual exemplu al modului în care disponibilitatea donatorului de metil în timpul gestației este crucială pentru stabilirea modelelor de metilare a ADN la descendenți provine de la șoarecii Agouti vy. Descendenții mamelor hrănite cu o dietă bogată în donatori de metil au primit o culoare de blană de tip sălbatic (maro), în timp ce descendenții mamelor hrănite cu o dietă standard au dezvoltat o culoare de blană galbenă [26]. Culoarea stratului maro s-a datorat hipermetilării ADN a unei expresii terminale lungi care controlează expresia genei agouti care a determinat scăderea expresiei genice a agouti și, prin urmare, a modificat pigmentarea stratului.
Tabelul 37.1. O selecție de studii în care metilarea ADN-ului și expresia genică a regulatorului metabolizator principal al receptorului activat de proliferatorul peroxizomului gamma coactivator 1 alfa (PPARGC1A) este asociată cu boli metabolice și factorii predispozanți
| Dieta bogată în grăsimi | Băieți sănătoși | Mușchiul scheletic și țesutul adipos subcutanat | Creșterea metilării promotorului după 5 zile de supraalimentare bogată în grăsimi | [29.30] |
| Șoareci, materni | Mușchi scheletic | Creșterea metilării promotorului și scăderea exprimării genelor la descendenți | [75] | |
| Exercițiu fizic | Bărbați și femei sănătoși, sedentari | Mușchi scheletic | Scăderea metilării promotorului, creșterea expresiei genelor | [38.40] |
| Lipsa de activitate fizică | Băieți sănătoși | Mușchi scheletic | Creșterea metilării promotorului și scăderea expresiei genelor după 9 zile de repaus la pat | [42] |
| Greutate redusă la naștere | Tinerii sănătoși născuți cu LBW | Mușchiul scheletic și țesutul adipos subcutanat | Promotor de metilare crescut | [29,30,57] |
| IMC matern | Descendenți neonatali ai femeilor obeze | Sângele din cordonul ombilical | Corelația pozitivă între IMC matern și metilarea promotorului la nou-născuți | [58] |
| Adipozitate | Copii preadolescenți | Sânge periferic | Metilarea promotorului la copii a prezis adipozitatea 5-7 ani mai târziu în viață | [59] |
| GDM și T1D | Vârsta adultă masculină și feminină | Mușchi scheletic | Scăderea expresiei genice la descendenții GDM | [68] |
| T2D | T2D, bărbați și femei | Insulele pancreatice | Creșterea metilării promotorului, scăderea expresiei genelor | [77] |
| T2D, bărbați și femei | Mușchi scheletic | Promotor de metilare crescut | [80,95] |
IMC, indicele de masă corporală; GDM, diabet zaharat gestațional; LBW, greutate redusă la naștere; T1D, diabet de tip 1; T2D, diabet de tip 2.
Într-un model de șoarece obezitate indus de o dietă bogată în grăsimi, metilarea histonei modificate a fost găsită în spermatozoizii paterni la gene importante pentru embriogeneză, sugerând că expunerile dietetice pot modula modificările histonice ale genelor implicate în procesele de dezvoltare [33]. Dieta noastră poate avea, de asemenea, o influență asupra expresiei miARN. În ficatul de la șoarecii hrăniți cu diete bogate în grăsimi, comparativ cu șoarecii hrăniți cu chow, expresia miR-21 a scăzut, care, vizând proteina 7 care leagă acidul gras, a fost legată de acumularea de lipide intracelulare în ficat (revizuită în Ref. [34]).
La ficatul de la șobolani expuși la 8 săptămâni de control sau diete bogate în grăsimi de zaharoză, cu sau fără supliment de donator de metil, metilarea globală a ADN-ului a scăzut în mod surprinzător în ficat de la șobolanii hrăniți cu control expuși la suplimentarea de donator de metil [35]. Această constatare, împreună cu disocierea dintre plasticitatea epigenetică indusă de dietă în țesutul adipos și mușchiul scheletic de la aceiași subiecți indică faptul că sunt necesare studii focalizate (de exemplu, grupuri de studiu bine potrivite și intervenții standardizate), cu ipoteze clare atunci când se investighează influența dieta pe modele epigenetice globale, la nivel de genom și specifice site-ului la oameni și animale.
Înțelegerea de bază a cât de susceptibil este epigenomul uman la modificările dietetice este în mare parte necunoscută. Studiile suplimentare care vizează elucidarea impactului dietei asupra epigenomului pot oferi orientări dietetice optimizate și, prin urmare, pot îmbunătăți prevenirea tulburărilor metabolice.
Înfometarea și postul: Aspecte biochimice
Reglementarea adaptării
Reglarea metabolică a foametei este complexă și vizează transpunerea mediului metabolic total al corpului în răspunsuri adaptative la nivel tisular și celular, ducând la modificări structurale, biochimice și funcționale. Există o interacțiune extinsă între mecanismele de detectare a nutrienților și semnalizarea aferentă și eferentă neuronală și endocrină.
Glucagonul, o peptidă de 29 de aminoacizi eliberată din celulele α pancreatice, este un important regulator al homeostaziei glucozei, un contraregulator al insulinei și este eliberat în situații de glucoză plasmatică scăzută. Stimulează producția de glucoză hepatică prin creșterea glicogenolizei și gluconeogenezei hepatice prin calea sa canonică de cAMP/PKA, facilitând fosforilarea și schimbarea alosterică a enzimelor metabolice cheie și a factorilor nucleari (de exemplu, CREB, proteina de legare a elementelor de răspuns cAMP). Astfel, joacă un rol crucial în faza timpurie a adaptării la foamete (Tabelul 1).
Axa AMPK-SIRT1 integrează multiple semnale hormonale și nutriționale (de exemplu, glucagon, leptină, adiponectină, glicogen și acizi grași liberi) și este încorporată într-o rețea complexă de autoreglare care vizează restricționarea cheltuielilor generale de energie în vremuri de foame (Figura 6 ). Are efecte intracelulare pleiotrope care au ca rezultat schimbări rapide prin fosforilarea AMP kinază și modificări alosterice ale principalelor enzime metabolice, cum ar fi acetil-CoA carboxilaza (sinteza acidului gras), lipaza hormonală (hidroliza trigliceridelor) și complexul piruvat dehidrogenază (oxidarea piruvat în ciclul Krebs). Mecanismele adaptive pe termen mediu și lung au efect ca o consecință a modificărilor transcripționale ale enzimelor metabolice prin fosforilare și deacetilare a receptorilor nucleari din aval (de exemplu, FOXO, PPAR) și coregulatori transcripționali (PCG-1α). În plus, deacetilarea reziduurilor de lizină ajută SIRT1 să crească gradul de compactare a cromatinei, ducând la reprimarea directă a activității transcripționale.
- Agricultura insectelor - o prezentare generală Subiecte ScienceDirect
- MacConkey Agar - o prezentare generală a subiectelor ScienceDirect
- Maltodextrina - o prezentare generală a subiectelor ScienceDirect
- Lactobacillus - o prezentare generală Subiecte ScienceDirect
- Stomatita herpetică - o prezentare generală Subiecte ScienceDirect