Abstract
Introducere
Pierderea în greutate a fost descrisă la 20% până la 45% dintre pacienții cu boala Alzheimer (AD) și a fost asociată cu rezultate adverse. Au fost propuse diferite mecanisme pentru pierderea în greutate la pacienții cu AD, deși niciunul nu a fost dovedit. Acest studiu a avut ca scop elucidarea unui mecanism de scădere în greutate la pacienții cu AD, examinând ipoteza că scăderea în greutate este asociată cu atrofia mediană a lobului temporal (MTA).
Metode
Pacienții din studiul de cohortă al bolii Alzheimer frisone (un studiu retrospectiv, longitudinal pe 576 de pacienți cu AD care locuiesc în comunitate) au fost incluși atunci când s-a efectuat un RMN cerebral pe care MTA ar putea fi evaluat. Pentru a investiga ipoteza că pierderea în greutate este asociată cu MTA, am investigat dacă traiectoria schimbării greutății corporale depinde de severitatea MTA în momentul diagnosticului (adică valoarea inițială). Am emis ipoteza că pacienții cu MTA mai severă la momentul inițial ar avea o greutate corporală mai mică la momentul inițial și o scădere mai rapidă a greutății corporale în cursul bolii. Modelul mixt liniar generalizat (GLMM) a fost utilizat pentru a determina relația traiectoriei schimbării greutății cu severitatea MTA.
Rezultate
În total, au fost incluși 214 de pacienți (vârsta medie 79 de ani, MMSE medie 23, greutatea medie 73,9 kg). Pacienții cu MTA moderată, severă sau foarte severă la momentul inițial au cântărit cu 3,2 până la 6,8 kg mai mult decât pacienții fără MTA sau ușoară. În cei 3,5 ani, pacienții au crescut în medie 1,7 kg în greutate corporală, indiferent de severitatea MTA lor la momentul inițial.
Concluzii
Nu am găsit dovezi că MTA este asociat cu pierderea în greutate la pacienții cu AD. Mai mult, contrar a ceea ce era de așteptat, pacienții cu AD nu au slăbit, ci s-au îngrășat în timpul urmăririi.
Introducere
Diverse studii au investigat relația dintre greutatea corporală și boala Alzheimer (AD). Pe de o parte, supraponderalitatea a fost asociată cu o funcție cognitivă mai slabă [1] și a fost descrisă ca un factor de risc pentru AD [2]. Pe de altă parte, în 1907, Alois Alzheimer a descris pierderea în greutate la primul său pacient [3], iar pierderea în greutate este recunoscută în prezent ca o caracteristică clinică a AD [4]. În prezentul studiu, ne vom concentra pe relația dintre pierderea în greutate și AD.
Pierderea în greutate a fost descrisă la aproximativ 20% până la 45% dintre pacienții cu AD [5-11] și a fost asociată cu rezultate adverse, cum ar fi o progresie accelerată a AD [5,7,11,12], o rată mai mare de instituționalizare [13] și creșterea mortalității [14-16]. Au fost propuse diferite mecanisme de scădere în greutate la pacienții cu AD [5,17-19], deși niciunul nu a fost dovedit.
Reglarea greutății corporale este complexă și influențată de diverși factori, cum ar fi apetitul, comportamentul de hrănire și sistemele endocrine [20,21]. În plus, se presupune că sunt implicate diferite zone cerebrale, dintre care unul este lobul temporal medial, posibil prin influențarea aportului de alimente și a apetitului [22-24]. Mai mult, atrofia lobului temporal medial reflectă modificările rețelelor neuroanatomice funcționale care sunt implicate în reglarea greutății corporale [22]. Lobul temporal medial este un loc în care patologia AD este de obicei prezentă [25]. La imagistica prin rezonanță magnetică (RMN), aceasta prezintă atrofie în primele etape ale bolii, care se agravează pe măsură ce progresează AD [25]. Grundman și colab. a arătat că atrofia medială a lobului temporal (MTA) a fost asociată cu greutatea corporală redusă la pacienții cu AD [22]. Datorită designului transversal, nu a fost posibil să se atribuie relații de cauză și efect în acest studiu, adică pierderea în greutate poate fi rezultatul MTA sau, invers, agrava MTA [17,22]. Dacă acesta din urmă este adevărat, creșterea în greutate, de exemplu prin furnizarea de intervenții nutriționale, ar putea preveni sau încetini MTA și, eventual, progresia bolii.
Puține studii au investigat relația dintre patologia creierului și starea nutrițională la pacienții cu AD. Rezultatele acestor studii sunt contradictorii și niciunul dintre studii nu s-a concentrat în primul rând pe relația dintre MTA și starea nutrițională [26-28]. Scopul prezentului studiu a fost de a elucida un mecanism de scădere în greutate la pacienții cu AD, examinând ipoteza că scăderea în greutate este asociată cu MTA.
Metode
Setare
Participanți și proiectarea studiului
Pacienții incluși în studiul de cohortă al bolii Alzheimer frisone au vizitat clinica de memorie între 2002 și 2012, aveau 65 de ani sau mai mult, locuiau la domiciliu sau în îngrijiri rezidențiale în momentul diagnosticului și au început cu un ICE. Pacienții au fost incluși în prezentul studiu atunci când au avut o evaluare inițială, cel puțin o evaluare de urmărire și un RMN al creierului (efectuat cu până la 6 luni înainte de diagnosticul AD) pe care MTA ar putea fi evaluată. Pentru a examina ipoteza că pierderea în greutate este asociată cu MTA, am investigat dacă traiectoria schimbării greutății corporale depinde de severitatea MTA în momentul diagnosticului (adică valoarea inițială). Am emis ipoteza că pacienții cu MTA mai severă la momentul inițial ar avea o greutate corporală mai mică la momentul inițial și o scădere mai rapidă a greutății corporale în cursul bolii. Acest studiu, pentru care nu era necesar consimțământul informat, a fost aprobat de comitetul local de etică al Centrului Medical Leeuwarden. Nu a fost necesar consimțământul informat, deoarece acesta a fost un studiu retrospectiv în cadrul căruia anonimatul pacienților era garantat.
Măsurători
Caracteristici sociodemografice
S-au înregistrat vârsta, sexul, statutul social, utilizarea serviciilor informale și de îngrijire profesională (adică ajutorul gospodăriei, mesele la domiciliu). Comorbiditatea a fost evaluată prin scara cumulativă de evaluare a bolii (CIRS) cu scoruri totale variind de la 0 (fără afectare) la 56 (afectare extrem de severă) [32]. AD, deoarece boala indicelui nu a fost inclusă în scorul CIRS. S-a înregistrat numărul de medicamente pe lângă CHEI. Polifarmacia a fost definită ca utilizarea a patru sau mai multe medicamente pe lângă ChEI.
Funcționarea cognitivă
Funcționarea cognitivă a fost evaluată prin examinarea mini-stării mentale (MMSE) [33] și testul de desenare a ceasului (CDT). CDT a fost marcat conform sistemului de scor al lui Shulman și colab. în 1993, în care scorul total variază de la 1 la 6 și un scor de 3 sau mai mult indică o afectare cognitivă [34].
Simptome comportamentale și psihologice (BPS) ale demenței
Pe baza informațiilor auto-raportate despre pacient și îngrijitor, am înregistrat dacă BPS a fost prezent sau absent. Deoarece BPS nu a fost operaționalizat cu un instrument de măsurare, nu a fost posibil să se raporteze severitatea, natura sau frecvența BPS.
Tipul și doza de ChEI
La fiecare vizită în ambulatoriu, s-au înregistrat tipul și doza de ChEI și, dacă este cazul, memantină. La clinica noastră de memorie, retardul de galantamină este prima alegere de tratament pentru pacienții cu AD ușoară până la moderată. Forma de întârziere a galantaminei a fost prescrisă din 2005. Înainte de 2005, galantamina a fost administrată de două ori pe zi. Doza este crescută treptat de la 8 miligrame (mg) pe zi la 24 mg pe zi în 8 săptămâni.
Starea nutrițională
Au fost înregistrate greutatea corporală (kg), indicele de masă corporală (IMC), pierderea în greutate auto-raportată, apetitul și utilizarea suplimentelor nutritive orale (ONS). Pierderea în greutate, apetitul și utilizarea ONS raportate de sine au fost înregistrate pe baza informațiilor despre pacient și îngrijitor.
Atrofia medială a lobului temporal (MTA)
RMN cerebrale au fost obținute cu un scaner IRM Philips 3.0 Tesla (Philips, Eindhoven, Olanda). MTA a fost evaluată pe secvențe RMN ponderate T1 cu gradient tridimensional coronal. MTA a fost evaluată utilizând o scară validată de evaluare vizuală în 5 puncte, pe baza evaluării lățimii fisurii coroidiene, a lățimii cornului temporal și a înălțimii hipocampice [35,36]. Severitatea MTA a fost notată de la 0 (fără atrofie) la 4 (atrofie foarte severă) [35]. Conform instrucțiunilor scalei de evaluare vizuală, atât MTA stânga cât și dreapta au fost examinate [37,38]. MTA a fost evaluată independent de doi evaluatori (ED și HB, ambii cercetători) care au fost instruiți în evaluarea MTA de către un neurolog cu experiență. Acordul dintre cei doi evaluatori a fost măsurat prin calcularea valorii kappa [39]. Dezacordul dintre ED și HB a fost rezolvat prin discuții cu un al treilea evaluator (DA).
analize statistice
Datele au fost analizate cu pachetul statistic pentru științele sociale (SPSS) 16.0 (SPSS Inc., Chicago, IL, SUA) și Software-ul de analiză statistică (SAS) 9.2 (SAS Institute Inc., Cary, NC, SUA). Ipotezele au fost testate cu două cozi. O probabilitate (P) valoarea mai mică de 0,05 a fost considerată semnificativă statistic. Statisticile descriptive sunt prezentate ca medie ± deviație standard (SD) pentru variabilele distribuite în mod normal. Pentru variabilele distribuite înclinate, sunt date mediana și percentilele 25-75. Am folosit testul Kolmogorov-Smirnov pentru a stabili distribuția variabilei. Numărul și proporția sunt date pentru variabilele categorice.
Pentru a investiga dacă traiectoria modificării greutății corporale depinde de severitatea MTA la momentul inițial, traiectoria modificării greutății corporale a fost comparată între grupurile de scor MTA, utilizând modelul mixt liniar generalizat (GLMM) [40,41]. GLMM a fost dezvoltat pentru analiza datelor longitudinale dependente și oferă o estimare a modificării variabilei dependente (adică a greutății corporale) în timp. Analizele GLMM au fost efectuate cu date de la pacienți cu o evaluare inițială și cel puțin o evaluare de urmărire. În caz contrar, nu este posibil să se descrie o schimbare a greutății corporale în timp. Scorurile MTA stânga și dreapta au fost utilizate separat pentru analize. Din al șaselea (MTA stâng), respectiv al cincilea (MTA dreapta) moment de măsurare, nu a fost posibil să se dea o estimare fiabilă a modificării greutății corporale din cauza numărului mic de pacienți rămași în acel moment. Prin urmare, analizele GLMM au fost efectuate la primele cinci momente de măsurare (o perioadă de 3,5 ani) pentru scorurile MTA stâng, respectiv la primele patru măsurători (o perioadă de 2,5 ani) pentru scorurile MTA corecte.
Relația MTA stânga și MTA dreaptă cu traiectoria greutății a fost analizată într-un GLMM multivariat, incluzând potențiali confundători. Analizele GLMM multivariate au fost efectuate în conformitate cu metoda inversă, cu greutatea ca rezultat primar (care este variabila dependentă). Grupul MTA, timpul (adică numărul momentelor de măsurare) și potențialii confundători au fost folosiți ca variabile independente. Confuzorii potențiali au fost variabile de bază asociate cu evoluția greutății în analiza GLMM univariată, a implicat: sex (P
Rezultate
Caracteristicile pacientului la momentul inițial
Au fost incluși două sute paisprezece pacienți. La momentul inițial, vârsta mediană a fost de 79 de ani (percentila 25 până la 75th 75,0 la 82,0), scor mediu MMSE 23 (percentila 25 la 75th 20,0 la 25,0) și greutatea medie 73,8 ± 12,0 kg. Mai mult de jumătate dintre pacienți prezentau AD ușoară și niciunul dintre pacienți nu prezentau AD sever. Aproape unul din șase pacienți a raportat pierderea în greutate (14,4%) și treisprezece pacienți (7,1%) au avut un apetit slab (Tabelul 1). Un tabel suplimentar rezumă numărul pacienților care au prezentat pierderea în greutate, creșterea în greutate sau nicio modificare a greutății (Tabelul 2).
Atrofia medială a lobului temporal (MTA)
Scanările RMN au fost efectuate median cu 20,5 zile (percentila 25 până la 75th, 45,0 până la 8,0) înainte de diagnosticarea AD. Trei pacienți (1,4%) au avut un scor MTA de 0 (Tabelul 1), au fost grupați cu pacienți cu un scor MTA de 1, reprezentând pacienți fără sau cu MTA ușor. La 75,4% dintre pacienți, MTA din partea stângă a fost aceeași ca pe partea dreaptă. Acordul dintre cei doi evaluatori a fost corect la bun pentru MTA stânga (Cohen’s kappa 0.66) și corect pentru MTA dreapta (Cohen’s kappa 0.60) [39,42].
Relația MTA stânga cu traiectoria schimbării greutății
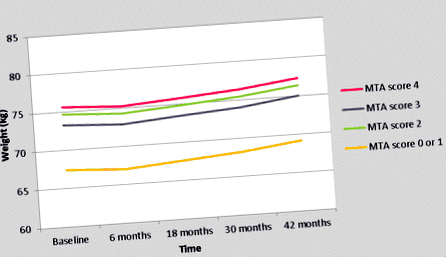
Traiectoria modificării greutății pentru scorul MTA stâng este prezentată în Tabelul 3 și Figura 1. În primele 6 luni, greutatea corporală a scăzut cu 0,4 kg în toate grupurile MTA (Tabelul 3, Figura 1). Ulterior, a crescut treptat cu 2,1 kg în următorii 3 ani (Figura 1, Tabelul 3). În general, toți pacienții au crescut în medie 1,7 kg în greutate corporală în decurs de 3,5 ani (Tabelul 3, Figura 1). Figura 1 și Tabelul 3 arată o diferență evidentă în greutatea corporală între pacienții cu un scor MTA de 0 sau 1, comparativ cu pacienții cu un scor MTA de 2, 3 sau 4 (Tabelul 3, Figura 1). Datorită acestei diferențe clare cu o traiectorie de greutate foarte comparabilă la pacienții cu scor MTA 2, 3 și 4, am comparat traiectoria greutății între pacienții cu un scor MTA de 0 sau 1, comparativ cu pacienții cu un scor MTA de 2, 3 sau 4 (Tabelul 4, Figura 2). Pacienții cu MTA 0 sau 1 au cântărit cu 6,8 kg mai puțin decât pacienții cu MTA 2, 3, 4 în fiecare moment în timpul urmăririi, independent de potențialii confundători (P = 0,001). Nu au existat interacțiuni ale scorului MTA stâng cu timpul sau cu cei patru potențiali confundători. Așa cum se arată în Tabelul 5, pacienții cu MTA 0 sau 1 erau mai tineri și aveau un scor MMSE mai mare la momentul inițial, comparativ cu pacienții cu un scor MTA de 2, 3 sau 4 (Tabelul 5).
Traiectoria greutății pe scorul MTA stâng (rezultate din analizele GLMM univariate). GLMM, model mixt liniar generalizat; MTA, atrofie medială a lobului temporal.
Traiectoria greutății; scor MTA stâng de 0 sau 1 față de 2, 3 sau 4 (rezultate din analizele GLMM univariate). GLMM, model mixt liniar generalizat; MTA, atrofie medială a lobului temporal.
Relația MTA corectă cu traiectoria schimbării greutății
Traiectoria greutății pe scorul MTA drept este prezentată în Tabelul 6 și Figura 3. În ceea ce privește MTA stânga, am comparat traiectoria greutății între pacienții cu un scor MTA de 0 sau 1, comparativ cu pacienții cu un scor MTA de 2, 3 sau 4 (Tabelul 7, Figura 4). Pacienții cu MTA 0 sau 1 au cântărit mai puțin decât pacienții cu MTA 2, 3, 4 în orice moment în timpul urmăririi. În aceasta, o interacțiune cu timpul (P = 0,001) a fost observată, în funcție de momentul din timpul urmăririi, pacienții cu MTA 0 sau 1 cântăreau între 3,2 kg (la 6 luni) și 6,4 kg (la 18 luni) mai puțin decât pacienții cu MTA 2, 3, 4 7, Figura 4). În general, toți pacienții au crescut în medie 0,7 kg în greutate corporală după 2,5 ani (Tabelul 7). În ceea ce privește MTA stânga, am comparat caracteristicile inițiale între pacienții cu MTA 0 sau 1, comparativ cu pacienții cu un scor MTA de 2, 3 sau 4 (Tabelul 8). Pacienții cu MTA 0 sau 1 erau mai tineri, aveau un scor MMSE mai mare și foloseau îngrijiri informale mai rar la momentul inițial comparativ cu pacienții cu un scor MTA de 2, 3 sau 4 (Tabelul 8).
Traiectoria greutății per scor MTA corect (rezultate din analizele GLMM univariate). GLMM, model mixt liniar generalizat; MTA, atrofie medială a lobului temporal.
Traiectoria greutății; scor MTA corect 0 sau 1 versus 2, 3 sau 4 (rezultate din analizele GLMM univariate). GLMM, model mixt liniar generalizat; MTA, atrofie medială a lobului temporal.
Discuţie
Scopul prezentului studiu a fost de a elucida un mecanism de scădere în greutate la pacienții cu AD. Contrar a ceea ce era de așteptat, pacienții cu AD din populația noastră nu au pierdut, dar s-au îngrășat în cei 3,5 ani de urmărire. Studii recente au raportat rezultate similare [43,44]. Secher și colab. a arătat că pacienții care locuiesc în comunitate cu AD moderată nu au slăbit în cei 4 ani de urmărire [43], Gu și colab. a arătat că după debutul clinic al AD, IMC a crescut [44]. Cum se poate explica creșterea greutății corporale?
Numărul de pacienți cu AD care locuiesc în comunitate, cu pierderea în greutate, descris în literatură, variază între 20% și 45% [5-10]. Cele mai mari cifre sunt raportate în studiile din epoca pre-CHEI [5,6,9], iar studiile recente au arătat un risc redus de pierdere în greutate la pacienții cu AD tratați cu un CHEI comparativ cu pacienții netratați [7,8,45, 46]. În aceste studii, chEI-urile păreau să protejeze împotriva pierderii în greutate. Prin urmare, creșterea în greutate din cohorta noastră ar putea fi explicată prin utilizarea unui ChEI.
S-ar putea ca pierderea în greutate la pacienții cu AD să fie în prezent mai puțin frecvent observată din cauza calității crescute a îngrijirii pacienților cu AD cu domiciliul. În ultimul deceniu, nu doar tratamentul farmacologic a schimbat managementul AD. Medicamentele sunt administrate în plus față de mai multe intervenții non-farmacologice, inclusiv sfaturi dietetice și furnizarea de mese la domiciliu [31,47]. Gu și colab. a arătat că IMC-ul pacienților cu AD a scăzut până la debutul clinic al AD. După debutul clinic, nu a existat o scădere a IMC, care chiar a crescut, posibil pentru că îngrijirea a fost aranjată după diagnosticul de AD [44]. Postulăm că pierderea în greutate la pacienții cu AD ar putea fi considerată un marker pentru calitatea îngrijirii pacienților cu AD, mai degrabă decât un marker pentru severitatea AD. Acest lucru este susținut de constatarea noastră că severitatea AD, măsurată prin severitatea MTA, nu a fost legată de traiectoria greutății.
Descoperirea noastră surprinzătoare conform căreia pacienții cu MTA mai severă cântăreau mai mult decât pacienții fără MTA sau ușoară, trebuie interpretată cu atenție, deoarece mai puțin de 10% dintre pacienții din cohorta noastră au avut un scor MTA de 0 sau 1. Reprezentativitatea pacienților fără sau MTA ușor în cohorta noastră este neclar. Așa cum era de așteptat, pacienții cu MTA fără sau ușor au avut un scor MMSE inițial mai mare și au fost mai puțin dependenți decât pacienții cu MTA moderat, sever sau foarte sever [25]. Deși, în ciuda faptului că acești pacienți nu au avut sau au doar un MTA ușor, aceștia au fost direcționați către clinica de memorie. Nu există date privind greutatea pacienților cu un scor MTA de 0 sau 1 care nu au fost direcționați către o clinică de memorie. Nu se poate exclude faptul că acești pacienți au o greutate corporală mai mare decât pacienții cu un scor MTA de 0 sau 1 care au prezentat la clinica noastră de memorie.
Din câte știm, acesta este cel mai mare studiu care examinează relația dintre MTA și traiectoria schimbării greutății la pacienții cu AD și singurul studiu în care greutatea corporală a fost măsurată longitudinal. Un alt punct forte al studiului este utilizarea GLMM. Analiza statistică a datelor longitudinale este complicată din cauza interdependenței măsurătorilor și, mai ales la pacienții cu vârstă cu AD, renunță la pacienți [54]. GLMM este dezvoltat special pentru analiza datelor longitudinale dependente. Toate datele contribuie la analiza longitudinală și pot fi utilizate chiar și datele de la pacienții care au renunțat la abandon. În acest fel am putea include un număr mare de pacienți cu o lungă perioadă de urmărire. Mai mult, severitatea MTA a fost evaluată independent de doi evaluatori. Acordul dintre evaluatori a fost corect la bun și mai bun decât acordul interobserver al Scheltens și colab., care a fost corect [37].
Concluzii
Nu am găsit nicio dovadă că atrofia lobului temporal medial este asociată cu scăderea în greutate la pacienții cu AD. Mai mult, contrar a ceea ce era de așteptat, pacienții cu AD nu au slăbit, ci s-au îngrășat în timpul urmăririi.
- Creșterea în greutate ca predictor al pierderii volumului lobului frontal și temporal în tulburarea bipolară A
- Creșterea în greutate ca predictor al pierderii volumului lobului frontal și temporal în tulburarea bipolară A
- Pierderea în greutate vă va schimba relația Stilul de viață - The Columbus Dispatch - Columbus, OH
- Scăderea în greutate va deveni un tratament viitor al adenomului hepatocelular la pacienții obezi Dokmak -
- Relația mea se va termina dacă slăbesc