Constantin A. Stratakis
a Section on Endocrinology and Genetics, Program in Developmental Endocrinology and Genetics, Eunice Kennedy Shriver National Institute of Child Health and Human Development, National Institutes of Health, Bethesda, MD 20892–1862, SUA
b Program de instruire în endocrinologie pediatrică, Institutul Național de Sănătate și Dezvoltare Umană a Copilului, Institutele Naționale de Sănătate, Clădirea 10, CRC, Sala 1–3330 Laboratoare de Est, 10 Center Drive, Bethesda, MD 20892, SUA
Abstract
Hormonul care eliberează corticotropina (ACTH) (CRH) este sintetizat în hipotalamus și transportat către hipofiza anterioară în sistemul portal. CRH stimulează eliberarea ACTH din hipofiza anterioară, care, la rândul său, stimulează cortexul suprarenal pentru a secreta cortizol (axa hipotalamo-hipofizo-suprarenală sau HPA). 1-4 Cortizolul inhibă sinteza și secreția atât a CRH, cât și a ACTH într-un sistem de reglare a feedback-ului negativ. În sindromul Cushing, axa HPA și-a pierdut capacitatea de autoreglare, datorită secreției excesive de ACTH sau cortizol și pierderii funcției de feedback negativ. Testele de diagnostic, pe de altă parte, profită de reglarea strânsă a axei HPA în stare normală și de perturbarea acesteia în sindromul Cushing pentru a ghida terapia către cauza principală a acestei tulburări.
Epidemiologie și etiologie
Prezentare clinică
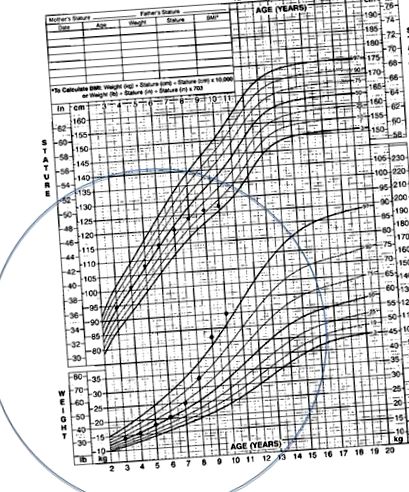
La majoritatea copiilor, debutul sindromului Cushing este insidios. 1,3,4,14 Cel mai frecvent simptom prezent este creșterea în greutate; în copilărie, lipsa creșterii în înălțime în concordanță cu creșterea în greutate este cea mai frecventă prezentare a sindromului Cushing. O diagramă de creștere tipică pentru un copil cu sindrom Cushing este prezentată în Fig. 1. Alte probleme frecvente raportate la copii includ pletora facială, durerile de cap, hipertensiunea arterială, hirsutismul, amenoreea și dezvoltarea sexuală întârziată. Copiii puberali pot prezenta virilizare. Manifestările cutanate, inclusiv acneea, striații violacee, vânătăi și acantoze nigricans sunt, de asemenea, frecvente. 2 Comparativ cu pacienții adulți cu sindrom Cushing, simptomele mai puțin frecvente la copii includ tulburări de somn, slăbiciune musculară și probleme cu memoria.
Grafic tipic de creștere pentru un pacient cu sindrom Cushing.
Liniile directoare de diagnosticare
Intervențiile terapeutice adecvate în sindromul Cushing depind de diagnosticarea exactă și clasificarea bolii. Istoricul medical și evaluarea clinică, inclusiv revizuirea datelor de creștere, sunt importante pentru a pune diagnosticul inițial al sindromului Cushing. La suspiciunea de sindrom Cushing, sunt necesare confirmări de laborator și imagistice. Un algoritm al procesului de diagnosticare este prezentat în Fig. 2 .
Algoritm diagnostic în sindromul Cushing.
Primul pas în diagnosticul sindromului Cushing este documentarea hipercortizolismului, 15,16, care se face de obicei în ambulatoriu. Datorită naturii circadiene a cortizolului și ACTH, măsurătorile izolate ale cortizolului și ACTH nu au o mare valoare în diagnostic. Un excelent test de screening pentru hipercortizolism este o excreție de cortizol urinar fără 24 de ore (UFC) (corectată pentru suprafața corpului). Cu toate acestea, este adesea dificil să se obțină o colectare de urină de 24 de ore în mod fiabil în ambulatoriu, în special în populația pediatrică. UFC fals ridicat poate fi obținut din cauza stresului fizic și emoțional, obezității cronice și severe, sarcinii, exercițiilor cronice, depresiei, controlului slab al diabetului, alcoolismului, anorexiei, sevrajului narcotic, anxietății, malnutriției și aportului ridicat de apă. Aceste condiții pot provoca UFC suficient de mari pentru a provoca ceea ce este cunoscut sub numele de sindrom pseudo-Cushing. Pe de altă parte, UFC fals scăzut poate fi obținut în mare parte cu o colectare inadecvată.
Tratament
Tratamentul de elecție pentru tumorile suprarenale benigne este rezecția chirurgicală. Această procedură se poate face fie prin abordări transperitoneale, fie retroperitoneale. În plus, suprarenalectomia laparoscopică este disponibilă și în multe instituții. Carcinoamele suprarenale pot fi, de asemenea, rezecate chirurgical, cu excepția cazului în stadii ulterioare. Dacă este posibil, metastazele solitare trebuie îndepărtate. 26 Terapia cu mitotan, care este un agent adrenocitolitic, poate fi utilizată ca terapie adjuvantă sau în cazul unei tumori inoperabile. Alte opțiuni chimioterapeutice includ cisplatină, 5-fluorouracil, suramin, doxorubicină și etopozid. Ocazional, au fost necesari antagoniști ai glucocorticoizilor și inhibitori ai sintezei steroizilor pentru a corecta hipercortizolismul. Radioterapia poate fi utilizată și în cazul metastazelor. Prognosticul pentru carcinomul suprarenalian este slab, dar de obicei copiii au un prognostic mai bun decât adulții.
Suprarenalectomia totală bilaterală este de obicei tratamentul la alegere în boala suprarenală bilaterală micronodulară sau macronodulară, cum ar fi PPNAD și MMAD. În plus, suprarenalectomia poate fi considerată un tratament pentru acei pacienți cu boală Cushing sau sindrom Cushing ectopic dependent de ACTH, care au suferit fie o intervenție chirurgicală nereușită, fie radioterapie, respectiv tumora lor nu a fost localizată. Sindromul Nelson, care include pigmentare crescută, niveluri crescute de ACTH și o tumoare hipofizară hipofizară producătoare de ACTH, se poate dezvolta la până la 15% dintre pacienții cu boală Cushing care sunt tratați cu adrenalectomie bilaterală. Este posibil ca copiii cu boala Cushing netratată să fie deosebit de vulnerabili la sindromul Nelson după suprarenalectomia bilaterală.
Farmacoterapia este o opțiune în cazul eșecului intervenției chirurgicale pentru boala Cushing sau în secreția ectopică de ACTH unde sursa nu poate fi identificată. Mitotanul inhibă biosinteza corticosteroizilor prin blocarea acțiunii 11-β-hidroxilazei și a enzimelor de scindare a lanțului lateral al colesterolului. De asemenea, acționează prin distrugerea celulelor suprarenale care secretă cortizol. Alți inhibitori ai enzimei suprarenale, cum ar fi aminoglutetimida, metirapona, trilostanul și ketoconazolul, pot fi de asemenea utilizați singuri sau în combinații pentru a controla hipercortizolismul. Aminoglutetimida blochează conversia colesterolului în pregnenolonă în cortexul suprarenal, inhibând sinteza de cortizol, aldosteron și androgeni. Metyrapone acționează prin prevenirea transformării 11-deoxicortizolului în cortizol. De asemenea, poate provoca hipertensiune secundară la acumularea de 11-deoxicorticosteron. Trilostanul inhibă conversia pregnenolonei în progesteron. Ketoconazolul este un agent care afectează mai multe etape ale căii și este excelent în blocarea steroidogenezei suprarenale.
În producția ectopică de ACTH, dacă sursa secreției de ACTH poate fi identificată, atunci tratamentul la alegere este rezecția chirurgicală a tumorii. Dacă rezecția chirurgicală este imposibilă sau dacă sursa de ACTH nu poate fi identificată, atunci farmacoterapia este indicată așa cum s-a discutat anterior. Dacă tumora nu poate fi localizată, atunci căutările repetate ale tumorii trebuie efectuate cel puțin anual. Suprarenalectomia bilaterală trebuie efectuată în caz de eșec al farmacoterapiei sau eșecul localizării tumorii după mulți ani.
Înlocuirea glucocorticoizilor
După finalizarea TSS de succes în boala Cushing sau excizia unui adenom suprarenal care funcționează autonom, va exista o perioadă de insuficiență suprarenală în timp ce axa suprarenală hipotalamică hipofizară se recuperează. În această perioadă, glucocorticoizii trebuie înlocuiți la doza sugerată de înlocuire fiziologică (12-15 mg/m2/zi de 2 sau 3 ori pe zi), așa cum am publicat recent. 27 În perioada imediat postoperatorie, trebuie inițiate doze de stres de cortizol. Acestea trebuie înțărcate relativ rapid până la o doză de înlocuire fiziologică; pacientul trebuie urmărit la fiecare câteva luni, iar funcția adrenocorticală trebuie evaluată periodic cu un test ACTH de 1 oră (răspunsul normal este un nivel de cortizol peste 18 ug/dL la 30 sau 60 de minute după stimularea ACTH).
Pacienții după adrenalectomia unilaterală pentru o singură tumoare adrenocorticală necesită același înlocuire și regim ca și pacienții cu boală de cushing post-TSS. După suprarenalectomia bilaterală, pacienții necesită înlocuirea pe viață atât cu glucocorticoizi (așa cum s-a descris anterior), cât și cu mineralocorticoizi (fludrocortizon 0,1-0,3 mg pe zi). Acești pacienți au nevoie și de doze de stres de glucocorticoizi imediat postoperator; sunt înțărcați pentru înlocuire fiziologică relativ repede. În plus, dozarea stresului pentru boli acute, traume sau proceduri chirurgicale este necesară atât pentru insuficiența suprarenală temporară, cât și permanentă.
Implicații psihosociale
Sindromul Cushing a fost asociat cu tulburări psihiatrice și psihologice multiple, cel mai frecvent labilitate emoțională, depresie și/sau anxietate. Alte anomalii au inclus mania, tulburarea de panică, ideea suicidară, schizofrenia, simptomatologia obsesiv-compulsivă, psihozele, stima de sine afectată și imaginea corporală distorsionată. Psihopatologia semnificativă poate rămâne chiar și după remisiunea hipercortizolismului și chiar după recuperarea axei HPA. Până la 70% dintre pacienți vor avea îmbunătățiri semnificative ale simptomelor psihiatrice treptat după corectarea hipercortizolismului. Autorul și colegii au raportat recent că copiii cu sindrom Cushing pot experimenta un declin al performanței cognitive și școlare la 1 an după vindecarea chirurgicală, fără nici o psihopatologie asociată. 28 Am raportat recent că sindromul Cushing activ, în special la copiii mai mici, a fost asociat cu scoruri fizice și psihosociale scăzute și că, în ciuda îmbunătățirii de până la 1 an după vindecare, afectarea reziduală a rămas în funcția fizică și în scorul de impact emoțional. Deși cele mai multe simptome auto-raportate ale sindromului Cushing au prezentat îmbunătățiri, uitare, gândire neclară și scăderea duratei de atenție nu s-au îmbunătățit după vindecare. 29
Puncte cheie
Sindromul Cushing în copilărie rezultă în principal din administrarea exogenă de glucocorticoizi; sindromul Cushing endogen este o boală rară.
Barierele pentru îngrijirea optimă a unui pacient pediatric cu sindrom Cushing sunt: necorespunzătoare urmăririi succesive adecvate a testelor pentru diagnosticarea acestei boli, care rezultă din lipsa de înțelegere a fiziopatologiei axei hipotalamo-hipofizo-suprarenale; lipsa accesului la un tratament chirurgical adecvat (adică cu experiență, de ultimă generație); și indisponibilitatea medicamentelor bine tolerate și eficiente pentru a controla hipercortizolemia.
Mulțumiri
Această lucrare a fost finalizată cu sprijinul Programului intramural al Institutului Național de Sănătate al Copilului și Dezvoltare Umană Eunice Kennedy Shriver, Institutele Naționale de Sănătate, Bethesda, MD 20892-1862.
- Cushing; cu sindrom
- Sindromul endogen Cushing cu pubertate precoce la un băiat de 8 ani din cauza unui mare
- Sindromul Cushing la copiii Cedars-Sinai
- SINDROMUL FREGOLI PharmaTutor
- Modificările dietetice rezolvă multe simptome ale sindromului Asperger WebWire