Abstract
fundal
Inflamația este acum cunoscută a fi un proces cheie de reglare, care este un numitor comun printre mai mulți factori de risc pentru ateroscleroză, în plus față de biologia arterială însoțitoare și asociată [1, 2]. Mai mult, se pare că atât brațele înnăscute, cât și cele adaptive ale sistemului imunitar pot fi, de asemenea, implicate în această tendință inflamatorie generală, care este implicată în ateroscleroză [3-7]. Am efectuat diverse studii terapeutice genetice bazate pe virusul adeno-asociat (AAV) într-un model animal de ateroscleroză (șoareci knock-out cu receptor de lipoproteine cu densitate scăzută în dieta cu colesterol ridicat, LDLR-KO HCD), către obiectivul specific de reglare starea celulelor imune arteriale se infiltrează cu citokine imuno-supresive și gene chemochine chemo-atractive/leucocitare și astfel inhibă ateroscleroza [8-15].
Recent am publicat un studiu care a demonstrat că livrarea genică sistemică AAV/Netrin1 a fost capabilă să inhibe ateroscleroza la șoarecii LDLR-KO de pe HCD [13]. Acest lucru a fost demonstrat prin măsurători cu ultrasunete de înaltă rezoluție (HRUS) ale secțiunii transversale a lumenului aortic, grosimea peretelui și viteza sanguină sistolică. Toate aceste măsurători au indicat faptul că livrarea genei Netrin1 a dus la ateroscleroză semnificativ mai mică. Cu toate acestea, la analiza expresiei diferitelor gene prin Q-PCR, am constatat că atât expresia Forkhead box P3 (FOXP3), cât și expresia CD25 au fost puternic reglementate în sus la animalele tratate cu AAV/Netrin1 [13]. Desigur, atât FOXP3, cât și CD25 sunt markeri distinctivi ai celulelor T reglatoare (Treg). Cu toate acestea, mecanismul exact prin care FOXP3 și CD25 sunt reglate în sus de Netrin1 în aortele contestate cu HCD rămâne de determinat.
Dintre aceste două gene, FOXP3, în special, factorul principal de transcripție a celulelor T reglatoare (Treg), este fascinant ca genă terapeutică, deoarece fenotipul Treg este legat de expresia FOXP3, iar Treg afectează atât imunitatea înnăscută, cât și adaptarea [3-7 ]. Este inducerea genei FOXP3 care are ca rezultat conferirea unei funcții imunosupresoare celulelor precursoare Treg, iar îndepărtarea expresiei aceleiași gene în celulele Treg mature are ca rezultat pierderea identității descendenței Treg și o reducere marcată a proprietăților imunosupresoare [16]. –19]. Aici caracterizăm efectul livrării genei umane (h) FOXP3 pe bază de AAV, prin injectarea sistemică a venei cozii, pentru a inhiba ateroscleroza în modelul animal LDLR-KO/HCD. În acest studiu, folosim transgena FOXP3 umană mai degrabă decât versiunea mousep (m) Foxp3, deoarece proteinele hFOXP3 și mFOXP3 sunt omologe în proporție de 86%, iar utilizarea versiunii umane ne aduce potențial cu un pas mai aproape de studiile clinice.
Metode
Declarație de etică
Toate procedurile experimentale au fost efectuate în conformitate cu protocoalele aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor din sistemul central de cercetare și dezvoltare a veteranilor din Arkansas Central, la Little Rock. Proiectul a fost finanțat printr-o subvenție pentru revizuirea meritelor administrată de veterani către PLH.
Construcția vectorului AAV și generarea de viruși
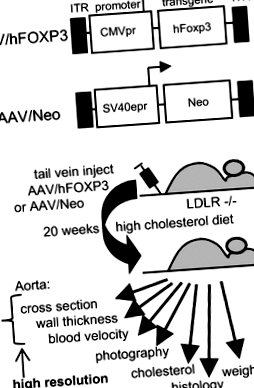
Am abordat direct ipoteza că livrarea genei hFOXP3 poate inhiba ateroscleroza utilizând ADN AAV2/8 [repetate terminale inversate AAV2 (ITR) ADN combinat cu livrarea genei AAV serotip 8 capsidă]. ADNc-ul FOXP3 uman (h) a fost obținut de la Open Biosystems și a fost ligat în aval de promotorul timpuriu imediat al citomegalovirusului (CMVpr) în cadrul vectorului AAV eviscerat dl3-97 pentru a genera AAV/hFOXP3. Vectorul AAV/Neo a fost descris anterior [8, 10-14]. Virusul AAV2/8 (ADN AAV2 în AAV8 virion) a fost produs folosind pDG8 helper și titrat prin analiza dot blot prin metodologii standard [8, 10-14].
Tratamente pentru animale
Șoareci LDLR-KO (B6; 129S7-Ldlr tm1Her/J) au fost achiziționate de la Jackson Laboratories (Bar Harbor, ME, SUA). Trei grupuri de șoareci masculi, compuși din zece animale fiecare la vârsta de 8 săptămâni, au fost injectați cu virus AAV/Neo (grup de control pozitiv) sau virus AAV/hFOXP3 la un titru de 1 × 10 10 de exemplu/ml prin vena cozii cu 200 μL virus pe șoarece, au fost urmate două injecții de rapel la un interval de 5-6 zile. Dieta cu colesterol ridicat (HCD) de 4% colesterol și 10% dieta cu unt de cacao (Harlan Teklad, Madison, Wis, SUA) a fost furnizată din prima zi de injecție și menținută pe întreaga perioadă de studiu. Un alt grup de șoareci hrăniți cu ND a fost folosit ca grup de control negativ. Chow-ul normal al mouse-ului de fundal a fost catalogul Harlan nr. 7012, iar HCD a fost # 7012, 4% colesterol/10% unt de cacao, formulat la comandă de Harlan. Toate procedurile experimentale sunt conforme cu protocoalele aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor din sistemul central de îngrijire a sănătății veteranilor din Arkansas din Little Rock.
Imagerie cu ultrasunete
Măsurarea colesterolului plasmatic
Colesterolul plasmatic total al șoarecilor AAV/Neo și AAV/FOXP3 a fost măsurat de VetScan VS2 (Abaxis, Union City, CA, SUA) la Veterans Animal Laboratory (VAMU).
Analiza leziunilor aterosclerotice prin vizualizare directă
Aorta întreagă disecată a fost fixată în formalină tamponată 10%, inspectată la microscopul de disecție și orice bucăți mici de grăsime aventurieră care au rămas atașate au fost îndepărtate foarte atent fără a perturba aorta în sine și acumulările/placa internă de lipide. Aortele mici de animale necolorate sunt în mod normal translucide, dar prezintă depunerea lipidelor ca zone albe [21, 22]. Aortele au fost apoi fotografiate sub lumină naturală folosind o cameră digitală de 10 megapixeli (Nikon, Japonia).
Observarea aterosclerozei prin histologie
La douăzeci de săptămâni după prima injecție de virus și pe HCD, șoarecii au fost uciși de expunerea la CO2. Au fost îndepărtate aorte întregi, inclusiv arcurile aortice, aorta toracică și abdominală. Aorta a fost spălată cu soluție salină și fixată în formalină tamponată 10% neutră (Sigma). După 24 de ore, țesutul fix a fost utilizat pentru încorporarea parafinei și secționarea pentru analize histologice. În cele din urmă secțiunile reprezentative au fost colorate cu hematoxilină și eozină.
Statistici
Parametrii au fost analizați cu software-ul de statistici SPSS 16.0 prin test ANOVA neparametric. Dacă s-au detectat diferențe între medii, testul Newman-Keuls a fost utilizat pentru comparații multiple. Diferența a fost considerată semnificativă dacă P
Rezultate
Vectorii AAV și tratamentele pentru animale
Structura vectorială și prezentare experimentală. A Structura vectorilor virusului AAV. b Structura generală a studiului. Detaliile experimentale sunt furnizate în secțiunea „Metode”.
- Efect anti-obezitate la șoareci obezi C57BL6 induși în diete cu conținut ridicat de grăsimi Studiul unui nou extract din
- Beneficiile terapiei cu vibrații
- Un alt studiu arată copiilor care mănâncă alimente mai sănătoase la școală, aruncând mai puține alimente USDA
- Eficacitatea anti-aterosclerotică a olmesartan Journal of Human Hypertension
- 5 Idei cu conținut scăzut de carbohidrați și cu conținut ridicat de proteine PBCo