Termeni asociați:
- Chitosan
- Acid alginic
- Enzime
- Polimeri
- Celule imobilizate
- Proteine
- Drojdii
- Nanoparticule
- Alginat de sodiu
Descărcați în format PDF
Despre această pagină
Pielea
Pansament cu alginat de calciu
Pansamentele cu alginat de calciu (de exemplu, Curasorb, Kendall Products) sunt cele mai utile în răni puternic exudative unde promovează formarea țesutului de granulare. Prin urmare, după dezvoltarea unui pat de granulație sănătos, pansamentele de alginat nu ar trebui utilizate, deoarece pot stimula dezvoltarea cărnii mândre. Deși contribuția componentei de calciu este slab înțeleasă, calciul contribuie, în general, la migrarea și remodelarea celulelor în timpul fazei de reparare. Alginatul interacționează cu sodiul prezent în răni, creând un gel care asigură un mediu optim de vindecare umedă. Pansamentele din alginat de calciu sunt foarte absorbante, având aproximativ 20 de ori greutatea pansamentului în exudat. Acestea nu aderă la patul plăgii subiacente și, prin urmare, îndepărtarea lor nu este inconfortabilă pentru pacienți.
Gestionarea rănilor superficiale
Pansamente cu alginat de calciu
Pansamentele cu alginat de calciu sunt utilizate în principal pentru faza de granulare a reparării plăgii. Sunt fabricate din alginat, un derivat al algelor marine. Calciul din pansament interacționează cu sodiul din rană, oferind un exudat al plăgii care stimulează miofibroblastele și celulele epiteliale și accelerează homeostazia plăgii. 53 Calciul modulează, de asemenea, proliferarea și migrația celulelor epiteliale. Pansamentele din alginat vin în tampoane nețesute și pansamente pentru frânghie. Se conformează bine plăgii, au proprietăți excelente de absorbție verticală și sunt proiectate pentru răni de la moderat la puternic exudative. Dacă o rană are un defect de țesut de granulație și nu are o cantitate moderată de exsudat, tamponul trebuie să fie pre-umezit cu soluție salină înainte de utilizare. Pansamentele pot fi schimbate la fiecare 3 până la 7 zile, în funcție de cantitatea de exsudat.
Sistemultegumentar
Christine L. Theoret, Ted S. Stashak, în Urgențe ecvine (ediția a patra), 2014
Alginat de calciu (CA)
CA este clasificat ca un dextranomer fibros.
Este disponibil dintr-o varietate de surse (Curasorb, 26 C-Stat, 27 Nu-Derm, 28 și Kaltostat 29). •
Fabricat din săruri de acid alginic obținute din algele Phaeophyceae găsite în algele marine
Poate absorbi până la 19 până la 30 de ori greutatea sa în lichidul plăgii
Promovează un mediu umed favorabil vindecării rănilor
Se pretinde că crește epitelizarea și formarea țesutului de granulare; acest lucru nu a fost găsit într-un studiu realizat la cai
Activează macrofagele în patul plăgii cronice, care favorizează formarea țesutului de granulație
Unele alginate au capacitatea de a „declanșa” cascada de vindecare provocând liza mastocitelor, rezultând eliberarea de histamină și 5-hidroxitriptamină.
Datorită acestor atribute, pansamentele cu alginat de calciu sunt considerate bioactive.
Plăgi moderate până la puternic exudante în timpul tranziției de la fazele inflamatorii acute la cele reparatoare ale vindecării
Plăgi cu pierderi substanțiale de țesut, cum ar fi leziuni de degloving
Începerea vindecării într-un pat de plăgi cronice •
Pansamentul trebuie să fie pre-umplut înainte de aplicare pe o plagă cronică uscată care are nevoie de stimulare pentru a continua cu formarea țesutului de granulare. O alternativă mai bună este mai întâi debridarea plăgii, apoi aplicarea pansamentului fără umezirea acesteia (Fig. 19-23 prezintă o plagă uscată a hockului dorsal). Un tampon semiocluziv neaderent trebuie plasat peste pansamentul de alginat de calciu, urmat de straturi de bandaj secundar și terțiar.
Noi perspective asupra științei și tehnologiei membranelor: membrane polimerice și biofuncționale
6.3.1 Prinderea în alginat
Pentru imobilizarea în alginat de calciu, o suspensie de celule concentrate a fost amestecată cu o soluție de alginat de sodiu (8% greutate/volum) [44] și s-au produs bile sferice prin scăderea amestecului într-o soluție de clorură de calciu 20 g/l printr-un ac 0,5 diametru mm. Diametrul mediu al mărgelelor obținute a fost de cca. 2 mm. Granulele au fost suspendate într-o soluție de glutaraldehidă 0,5% (v/v) sub agitare timp de 30 min. După spălare cu apă, mărgelele au fost depozitate la 4 ° C până la utilizare ulterioară. Această procedură asigură producerea unui gel moale, ceea ce este important pentru a minimiza rezistența la transferul de masă în acest sistem.
Celule imobilizate
C. Roisin,. J.-N. Barbotin., În progres în biotehnologie, 1996
Influența structurii supramacromoleculare a perlelor de alginat de calciu
Perlele de alginat de calciu prezintă structuri supramacromoleculare variabile în funcție de condițiile în care sunt preparate gelurile de perle. Concentrațiile de alginat și clorură de calciu sunt principalii parametri care afectează mecanismul de gelificare. Alți parametri precum vâscozitatea, timpul de gelificare și gradul de polimerizare afectează acest mecanism. Experimentele fără microorganisme au arătat că variația concentrațiilor de soluții de clorură de calciu și alginat implică diferențe semnificative în diametrul mărgelelor, conținutul de calciu, numărul de arbori, greutatea mărgelelor etc.
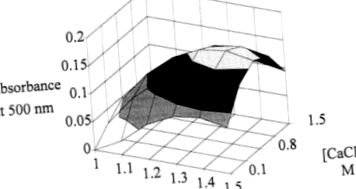
Pentru a reduce numărul de experimente și pentru a măsura efectul variației concentrației de alginat și clorură de calciu, a fost realizat un proiect experimental factorial. Suprafața de răspuns obținută ne permite să determinăm zona optimă de producție a pigmentului. Acest maxim este atins cu 1,35% alginat și 0,9 M clorură de calciu (Figura 4).
Figura 4. Evoluția absorbției la 500 nm în funcție de concentrațiile de alginat și clorură de calciu la 96 de ore de fermentare.
Tehnologii convenționale și alternative pentru extracția polizaharidelor algice
14.3.7 Conversia alginatului de calciu în acid alginic
Fermentarea celulelor imobilizate pentru producția de substanțe chimice și combustibili
2.3.1 Captarea gelului
Limitarea principală a gelurilor de alginat de calciu pentru mărgele este vulnerabilitatea lor la agenții chelatori, cum ar fi fosfatul, lactatul, citratul și EDTA, datorită decalcificării și pierderii rezultate a rezistenței gelului [39]. Instabilitatea mărgelelor de alginat de calciu și eliberarea consecutivă de celule întâlnite în imobilizarea ciupercilor filamentoase a devenit un factor care limitează funcționarea pe termen lung a fermentației celulare imobilizate [53]. Alți ioni, cum ar fi aluminiu, bariu și stronțiu, pot forma, de asemenea, geluri puternice cu alginat [76]; cu toate acestea, toxicitatea lor poate limita utilizarea lor în fermentație. Suplimentarea mediului de fermentație cu calciu a fost aplicată pentru a preveni dizolvarea granulelor de alginat de calciu [77]. Cu toate acestea, calciul este un factor declanșator important pentru multe procese metabolice și orice variație a concentrației sale în mediu va duce probabil la alterarea metabolismului celular.
κ-Carrageenanul este o altă polizaharidă naturală care s-a dovedit utilă pentru prinderea celulelor. Gelurile sunt prezente în săruri de metale alcaline, amine sau solvenți, iar ionii de potasiu sunt folosiți în general pentru stabilizarea gelului. Procedura de imobilizare este similară cu alginatul și se realizează prin adăugarea suspensiei de celule calde/caragenan în picături (3-4% g/v) la o soluție de clorură de potasiu (0,3 M) la temperatura camerei sau la o fază uleioasă urmat de răcire la temperatura camerei și incubare în soluție de clorură de potasiu [39]. Dimensiunea mărgelei poate fi controlată de condițiile de operare ale procesului de gelificare, cum ar fi rata de răcire. O stabilitate mecanică mai mare a mărgelelor poate fi obținută prin suplimentarea polimerului cu gumă de salcie [59, 60, 78] sau cu tratament de întărire utilizând Al (NO3) 3 [79]. În mod similar, alți polimeri naturali, cum ar fi agar, au fost de asemenea utilizați pentru imobilizarea celulelor. Cu toate acestea, rezistența mecanică a agarului este foarte slabă în comparație cu alginatul sau caragenanul și poate fi supusă deteriorării lente datorită sinerezei [3]. Recent, s-a sugerat că pectatul de calciu este o alternativă mai bună la alginatul de calciu datorită rezistenței chimice sporite a matricei sale [80, 81].
Alcoolul polivinilic (PVA) și HEMA sunt de asemenea utilizate pe scară largă pentru imobilizarea celulelor microbiene și sunt mai puțin toxice pentru celule. Aceste geluri sintetice sunt preparate prin polimerizare prin iradiere. N-izopropil acrilamida (N-IPAAM) poate fi utilizată pentru a lega încrucișat gelul PVA/HEMA pentru a proteja celulele de liză la 40 ° C [68]. O nouă metodă de imobilizare bazată pe PVA, LentiKats ®, a fost dezvoltată recent [67, 69, 83]. O suspensie de celule este amestecată în soluția de polimer (LentiKat ® Liquid) și gelificarea se efectuează prin uscare parțială controlată la temperatura camerei, rezultând particule în formă de lentilă care conțin celulele prinse. Hidrogelul LentiKat ® are proprietăți mecanice bune, nu este biodegradabil, iar celulele imobilizate nu sunt predispuse la contaminare, deoarece celulele contaminante nu vor putea intra în hidrogel și înlocui biocatalizatorul dorit.
Comparativ cu legarea purtătorului, o pierdere minoră a activității celulare este una dintre principalele caracteristici pozitive ale tehnicii de captare. Cu toate acestea, deoarece substanțele nutritive utilizate de celule, precum și produsele eliberate din celule trebuie să treacă prin matricea gelului și peretele celular, transferul de masă devine un factor important care trebuie luat în considerare. Limitarea nutrienților va duce la moartea celulelor și orice îmbogățire a produselor poate provoca efecte de inhibare și poate duce la o eficiență redusă a procesului. Prin urmare, limitarea difuziei este de obicei considerată ca fiind cea mai negativă caracteristică a acestei metode. Pentru a rezolva și a depăși problemele rezultate din rezistențele de transfer de masă, bioreactoarele cu celule imobilizate ar trebui să asigure caracteristici bune de amestecare și un transfer optim de masă între fazele gazoase, lichide și solide.
Celule imobilizate
S. Bielecki, R. Bolek și Progress in Biotechnology, 1996
Materiale și metode
Microorganism. Tulpina recombinantă de E. coli cu codificare genică pentru enzima TPL a fost inițial izolată din Citrobacter freundii și transformată în organism gazdă utilizând un sistem vector plasmidă [4] .
Condiții de cultură. Tulpina E. coli a fost cultivată timp de 20 de ore în culturi de agitare la 37 ° C. Mediul de creștere conținea 1,0% Bacto Triptonă, 0,5% extract de drojdie, 0,5% NaCl, 50 μl/ml ampicilină.
Testul enzimatic. Activitatea tirozinei fenol-liază a fost măsurată ca viteza de sinteză a L-dopa în amestecul de reacție constând din pirocatecol, piruvat, acetat de amoniac, PLP, Na2SO3, EDTA și borat de sodiu.
Metode de analiză. L-dopa format a fost estimată prin HPLC utilizând o coloană cu fază inversă eluată cu un tampon 0,01 M acetat de amoniu pH 3,5 la un debit de 1 ml-min - 1. L-dopa a fost detectată prin absorbția sa la 280 nm. Concentrația L-dopa a fost calculată prin referire la o curbă de calibrare.
Stabilitatea plasmidei. Stabilitatea plasmidei în celulele recombinante libere și imobilizate ale E. coli a fost determinată în conformitate cu metoda Vehmaanperä [5] .
Pregătirea celulelor imobilizate. Celulele recombinante E. coli au fost imobilizate în alginat de calciu, PVA, caragenan și poliacrilamidă după cum urmează:
Imobilizarea în alginat de calciu: Celulele au fost resuspendate în soluție de NaCI 0,9% și amestecate cu alginat de sodiu steril 1%. Suspensia a fost trecută prin picurare într-o soluție de CaCI2 de 4%. Margelele (1-2 mm diametru) au fost spălate cu apă distilată și depozitate în soluție de NaCI 0,9% la 4 ° C până când au fost utilizate.
Imobilizarea în caragenan: Celulele au fost resuspendate într-o soluție de 4% de caragenan (70 mg greutate celulă uscată per ml) la 55 ° C. Amestecul omogen a fost extrudat cu seringă, printr-un ac, într-o soluție 2% de KCl la 0 ° C. Mărgelele (diametru 3-5 mm) au fost spălate cu apă distilată și depozitate în soluție de NaCI 0,9% la 4 ° C până la utilizare.
Imobilizarea în PVA: Celulele au fost resuspendate într-o soluție de 12% alcool polivinilic (50 mg greutate celulă uscată per ml). Amestecul omogen a fost extrudat cu seringă, printr-un ac în ulei comestibil -20 ° C. Margelele au fost congelate în ulei (-30 ° C). După 24 de ore, mărgelele au fost decongelate și procesul a fost repetat de 5 ori. Mărgelele (diametru 1-2 mm) au fost spălate cu apă distilată și depozitate în soluție de NaCI 0,9% la 4 ° C până la utilizare.
Imobilizarea în gel de poliacrilamidă: celulele E. coli (100 mg greutate celule uscate pe ml) au fost resuspendate într-o soluție constând din: 10% acrilamidă, 5% N, N 'metilen bisacrilamidă, 0,04% N, N, N, N' tetrametilenă diamidă și 0,25% (NH4) 2S2O8. Polimerizarea a avut loc la 0 ° C timp de 30 de minute. Gelul rezultat a fost fracționat în bile de aproximativ 2 mm diametru. Margelele au fost spălate cu apă distilată și depozitate în soluție de NaCI 0,9% la 4 ° C până la utilizare.
Celule imobilizate
Stabilitate chimică - umflare
Limitarea majoră a utilizării alginatului de calciu ca matrice de imobilizare celulară este sensibilitatea sa față de compușii chelatori, cum ar fi fosfatul, citratul și lactatul sau cationii care nu gelifică, cum ar fi ionii de sodiu sau magneziu. Au fost sugerate diverse modalități de a depăși acest lucru. Cea mai simplă este păstrarea mărgelelor de gel într-un mediu care conține câțiva milimoli pe litru de calciu liber și menținerea raportului de calciu sodic mai mic de 25: 1 pentru alginat cu conținut ridicat de G și 3: 1 pentru alginat cu conținut ridicat de M. Cu toate acestea, gelurile de alginat pot fi stabilizate și prin înlocuirea ionilor de calciu cu alți cationi divalenți cu o afinitate mai mare pentru alginat. Seria de afinitate pentru diferiți cationi bivalenți este: Pb 2 +> Cu 2 +> Cd 2 +> Ba 2 +> Sr 2 +> Ca 2 +> Co 2 +, Ni 2 +, Zn 2 +> Mn 2 + .
O abordare comună pentru stabilizarea gelurilor de alginat este reticularea covalentă. Au fost aplicate diverse tehnici, inclusiv legarea încrucișată directă a grupărilor carboxil sau altoirea covalentă a alginatului cu polimeri sintetici. Acest lucru oferă geluri cu stabilitate și rezistență mecanică îmbunătățite, dar în majoritatea cazurilor condițiile de cuplare sunt dure pentru celulele fragile.
Biolistic și alte tehnologii non-Agrobacterium de transformare a plantelor
Tracie K. Matsumoto, Dennis Gonsalves, în Biotehnologia și agricultura plantelor, 2012
Transfer de gene mediate de margele bioactive
- Nevroza anxietății - o prezentare generală Subiecte ScienceDirect
- Antiandrogen - o prezentare generală a subiectelor ScienceDirect
- Butanol - o prezentare generală a subiectelor ScienceDirect
- Betulin - o prezentare generală Subiecte ScienceDirect
- Receptor adrenergic beta-2 - o prezentare generală a subiectelor ScienceDirect