Cuprins
- 1. Introducere:
- 2 Istorie:
- 3 Din factorul Willebrand:
- 4 Definiție:
- 5 Clasificarea bolii moștenite Von Willebrand:
- 5.1 Tipul 1 de boala Willebrand:
- 5.2 Tipul 2 de boala Willebrand:
- 5.2.1 Tipul 2A:
- 5.2.2 Tipul 2B:
- 5.2.3 Tipul 2M:
- 5.2.4 Tipul 2N:
- 5.3 Tipul 3 din boala Willebrand:
- 6 Manifestări clinice:
- 7 Instrumente de diagnosticare:
- 7.1 Teste de screening VWD
- 7.1.1 Antigen VWF (VWF: Ag):
- 7.1.2 Activitatea cofactorului ristocetin VWF (VWF: RCo):
- 7.1.3 Activitatea factorului VIII (FVIII: C):
- 7.1.4 VWF: RCo/VWF: Raport Ag:
- 7.2 Teste de confirmare VWD
- 7.1 Teste de screening VWD
- 8 Management medical:
- 8.1 Desmopresina:
- 8.2 Concentrate VWF și FVIII derivate din plasmă:
- 8.3 Antifibrinolitice:
- 8.4 Terapie hormonală:
- 9 Managementul terapiei fizice:
- 10 Evaluarea kinetoterapiei
- 10.1 Istorie și interviu [27]:
- 10.2 Evaluare subiectivă:
- 10.3 Evaluarea obiectivelor:
- 11 Tratament de kinetoterapie:
- 12 Resurse suplimentare
- 13 Referințe
Introducere:
Boala Von Willebrand (VWD) este considerată a fi cea mai frecventă tulburare de sângerare la om și la unele animale, cum ar fi câinii. VWD a fost numit după medicul finlandez care a descris boala în anii 1920. Se estimează că 1 din 100 până la 10.000 de persoane au VWD. Pacienții cu simptome ușoare de VWD sunt rareori diagnosticați, rezultând decalajul „100 până la 10.000” [1]. Se estimează că afectează 1% din toată populația SUA [2] .
Istorie:
În 1926 medicul finlandez Erik Von Willebrand a descris o nouă tulburare de sângerare pe care a numit-o „pseudohemofilie ereditară”. El a recunoscut că această nouă boală este diferită de hemofilie; dar nu a putut identifica factorul plasmatic responsabil. Mai târziu cu mulți ani; acest factor a fost identificat și a fost numit și după el și acum este cunoscut sub numele de Von Willebrand Factor (VWF) [3] .
De factorul Willebrand:
Factorul Von Willebrand (VWF) este o glicoproteină multifuncțională multimerică [4] care este sintetizată în celulele endoteliale [5]. VWF constă din subunități similare care conțin site-uri de legare pentru receptorii glicoproteinei. Activitatea adezivă a VWF depinde în principal de dimensiunea multimerilor săi [6]. Factorul Von Willebrand joacă un rol important în hemostaza primară și secundară, acționează ca un mediator pentru aderență și un purtător pentru coagularea FVIII. [5] Este, de asemenea, implicat în angiogeneză și în procesele inflamatorii. [7]
Definiție:
Boala Von Willebrand poate fi fie moștenită, fie dobândită.
- Ca boală moștenită autozomală, rezultă dintr-un defect al factorului proteic numit VWF. Tipul 1 și 2 sunt autosomale dominante, iar tipul 3 este transmis ca autosomal recesiv. Afectează bărbații și femeile în mod egal, deoarece este o boală legată de autozomul [3] [8] [9] .
- VWD dobândit este diferit de VWD moștenit, deoarece boala se dezvoltă mai târziu în viață și nu este ca urmare a moștenirii genetice. VWD dobândit se poate datora reacțiilor autoimune la persoanele cu defecte cardiace; anumite forme de cancer; diabetul zaharat; boală autoimună sau după utilizarea anumitor medicamente, cum ar fi acidul valpronic. [10]
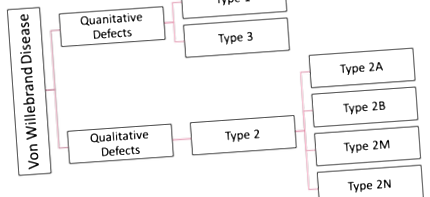
Clasificarea bolii moștenite Von Willebrand:
Există mai multe clasificări ale VWD (Figura de mai jos). VWD moștenit este clasificat în continuare în tipul 1, 2 și 3 și VWD achiziționat. Societatea internațională a trombozei și homeostaziei clasifică în continuare VWD în funcție de defectele calitative și cantitative ale VWF [11] .
Tipul 1 și 2 sunt ambii autosomali dominanți (imagine): cu acest model de moștenire, individul afectat are 1 copie a unei gene mutante și 1 genă normală pe o pereche de cromozomi autozomali. Acest lucru înseamnă că persoanele cu boli autosomale dominante au o șansă de 50/50 de a transmite gena mutantă și tulburarea fiecăruia dintre copiii lor. [12]
Tipul 1 de boala Willebrand:
VWD de tip 1 este cel mai frecvent. Aproximativ 75% dintre persoanele cu VWD sunt de tipul 1 [13] [14]. Este considerat a fi cel mai ușor tip și are un defect parțial cantitativ al VWF [13]. Datorită prezentării sale ușoare, este cel mai greu de diagnosticat. VWD de tip 1 este autosomal dominant. Cea mai frecventă manifestare a VWD de tip 1 este sângerarea dinților și sângerarea post-operatorie sau post-leziune. [13] [15]
Tipul 2 de boala Willebrand:
20-25% dintre persoanele cu VWD au tipul 2, făcându-l al doilea cel mai frecvent [14]. Este cunoscut prin defectul său calitativ de VWF. Cu tipul 2 există suficient factor VWF în sânge. Dar, factorul VWF nu funcționează corect din cauza unei mutații în VWF multimer [5] [16]. Acesta este împărțit în patru subtipuri care sunt tipul 2A, tipul 2B, tipul 2M și tipul 2N [4] .
Tipul 2A:
Tipul 2A este cel mai frecvent subtip din tipul 2. Cantitatea de VWF este normală, dar datorită unui defect mutațional al proteinei VWF, trombocitele nu se pot lega între ele în mod corespunzător. Acest lucru cauzează o problemă în procesul de coagulare [3]. Tipul 2A se manifestă prin hemoragie postoperatorie, menoragie și hemoragie de extracție post-dentară. [4]
Tipul 2B:
Tipul 2B este al doilea subtip cel mai frecvent în tipul 2. Are o mutație diferită în proteina VWF de tipul 2A. Acest defect duce la legarea VWF de trombocite în fluxul sanguin în loc de legare la locul rănit. Apoi corpul îndepărtează trombocitele legate anormal, provocând o scădere a cantității de trombocite [14]. Tipul 2B se manifestă prin vânătăi ușoare, sângerări prelungite din răni minore și sângerări nazale (epitaxis) [5] .
Tipul 2M:
M înseamnă Multimer. Tipul 2M se caracterizează printr-o mutație în multimerul proteinei VWF care duce la scăderea activității VWF și eșecul acesteia de a se lega de trombocite. Tipul 2 M se manifestă prin sângerări prelungite de la răni minore similare tipului 2B [10] .
Tipul 2N:
„N” se referă la Normandia sau în franceză Normaundie, un oraș din Franța unde a fost identificat pentru prima dată acest subtip. [14] Se caracterizează printr-un eșec al transportului factorului VIII pe VMF în ciuda legării normale a trombocitelor cu VWF. Acest lucru are ca rezultat niveluri scăzute de factor VIII. Tipul 2N este în mod obișnuit confundat cu hemofilia A datorită nivelurilor scăzute de factor VIII. [14]
Tipul 3 din boala Willebrand:
Cel mai sever și mai rar tip de VMD este VWD de tip 3. Se caracterizează prin absența completă a VWF în plasma sanguină și în trombocitele din sânge. Spre deosebire de tipul 1 și tipul 2, tipul 3 este autosomal recesiv. VWD de tip 3 se manifestă ca sângerări severe în țesuturile moi, articulații, mușchi, nas și intestin [13] .
Manifestari clinice:
Manifestarea clinică a VWD este diferită în funcție de tipul de VWD [13] .
Cele mai frecvente manifestări includ: [17]
- Hemoragie nazală
- Hemoragia cavității dentare și orale
- Vindecarea prelungită a rănilor
- Menoragia care este o hemoragie menstruală excesivă
- Hemoragie gastro-intestinală (cu tip sever)
Există câteva manifestări frecvente la populația pediatrică care includ: [18]
- Hemoragia butucului ombilical
- Hematom cefalic
- Hematom obraz
- Hemoragie conjunctivală
- După hemoragie cu circumcizie
- După hemoragia de punte venoasă
Unelte de diagnostic:
Boala Von Willebrand este cea mai frecventă tulburare de sângerare, dar este și cea mai greu de diagnosticat. [19] Din păcate, testele de laborator obișnuite de testare a coagulării sângelui, cum ar fi CBC, testul timpului de tromboplastină parțială activată (APTT), testul timpului de protrombină (PT) și testul fibrinogenului, toate sunt normale la pacienții cu VWD, în special la cei cu tipuri ușoare și moderate. [20]
Pentru a diagnostica VWD există teste de laborator de screening și diagnostic care pot fi utilizate. [21]
Teste de screening VWD
Antigen VWF (VWF: Ag):
Antigenul VWF este un instrument de evaluare cantitativă și fiabilă a nivelului de proteină VWF din plasmă24. Această metodă este eficientă în detectarea tipurilor de defecte cantitative VWD. Intervalul normal al VWF: Ag este de la 50 la 200 UI/dl. Orice mai mic de 50 poate indica prezența VWD. [22]
Activitatea cofactorului ristocetin VWF (VWF: RCo):
VWF: RCo este testul cel mai frecvent utilizat pentru a evalua capacitatea de legare a VMF24. Intervalele normale ale VWF: RCo sunt cuprinse între 50 și 200 UI/dL. [22]
Activitatea factorului VIII (FVIII: C):
Măsurarea FVIII: C este inclusă în testele de laborator de screening ale VWD. VWF este o proteină purtătoare pentru FVIII. Intervalele normale ale raportului FVIII: C/VWF: Ag este de aproximativ 1. În tipul 2N, acest raport este scăzut, iar în VWD de tip 3, FVIII: C este mai mic de 10 UI/dL [22] .
VWF: RCo/VWF: Raport Ag:
Raportul VWF: RCo/VWF: Ag este utilizat pentru a diagnostica tipul de VWD. În VWD de tip 1, nivelurile VWF: RCo și VWF: Ag scad și, ca atare, raportul dintre ele rămâne în jur de unul. În timp ce în VWD de tip 2 VWF: RCo scade în comparație cu nivelul VWD: Ag, deci VWF: RCo/VWF: Ag este de aproximativ 0,6 [22]
Teste de confirmare VWD
Odată diagnosticat VWD, se efectuează unele teste de confirmare pentru a indica tipul de VWD, cum ar fi [22]:
- Distribuția multimerică VWF care se constată că este anormală la tipul 2A și tipul 2B
- VWF: CB este anormal în tipul 2A și tipul 2B, unele tip 2M.
- VWF: PB crește în tipul 2
- LD-RIPA crește în tipul 2B.
- VWF: FVIIIB scade în tipul 2
- VWFpp/VWF: Raportul Ag crește în tipul 1
- Secvențierea genei VWF este cea mai utilă în diferențierea variantelor de tip 2
Managementul medical:
Tratamentul VWD se bazează pe severitatea simptomelor și cantitatea de hemoragie. Deoarece majoritatea pacienților cu VWD sunt de tip 1 (tip ușor); nu au nevoie de tratament regulat. Obiectivele tratamentului sunt creșterea activității circulante a VWF și reducerea hemoragiei. [23]
Unele medicamente sunt utilizate în tratarea și scăderea simptomelor VWD, cum ar fi:
Desmopresină:
Desmopresina poate fi administrată prin spray nazal, injecție intravenoasă sau subcutanată. Poate fi administrat ușor acasă și este utilizat pentru VWD de tip 1. Doza recomandată este de 0,3 mcg/kg intravenos sau subcutanat sau 2 pulverizări pe cale intranazală (pentru pacienții cu peste 50 kg) sau 1 pulverizare intranazală (pentru pacienții cu mai puțin de 50 kg). [24]
Concentrate VWF și FVIII derivate din plasmă:
Concentrate VWF și FVIII derivate din plasmă, cum ar fi Humate P (raport VWF: RCo: FVIII = 2,4: 1), Wilate (raport VWF: RCo: FVIII = 1: 1) și concentrat alfa VWF și FVIII derivat din plasmă (VWF: RCo: Raport FVIII 1: 3) sunt medicamente intravenoase care sunt utilizate ca tratament acut în tipurile severe de VWD. De asemenea, pot acționa ca profilaxie împotriva hemoragiei. Doza recomandată este de 50-60 unități de activitate a cofactorului ristocetin/kg pentru o intervenție chirurgicală majoră, în funcție de nivelul inițial de VWF și de nivelul dorit al obiectivului. [24]
Antifibrinolitice:
Antifibrinolitice precum acidul aminocaproic și acidul tranexamic inhibă fibrinoliza. Sunt utilizate ca tratamente active și profilactice, în special pentru suprafețele mucoasei. Sunt introduse pe cale orală sau intravenoasă. Doza recomandată pentru acidul aminocaproic este de 100 mg/kg, apoi de 50 mg/kg la fiecare 6 ore. Doza de acid tranexemic este de 1500 mg de 3 ori pe zi timp de 5 zile pentru cazurile de menoragie. [23] [24]
Terapia hormonală:
Terapia hormonală este, de asemenea, o opțiune în tratarea menoragiei. [25]
Managementul terapiei fizice:
Kinetoterapia are un rol important în promovarea abilităților funcționale în pediatrie și adulți cu VWD; de aceea Fundația Națională pentru Hemofilie a format un grup de lucru pentru kinetoterapie pentru a crea cea mai bună practică de kinetoterapie pentru tulburările de sângerare, cum ar fi VWD [26] .
Consiliul consultativ medical și științific (MASAC) a elaborat linii directoare și un cadru pentru gestionarea kinetoterapiei în tulburările de sângerare. MASAC a declarat că kinetoterapia este crucială în reabilitarea articulară și musculară după leziuni ale țesuturilor moi și hemartroze. Aceste prezentări clinice apar mai ales cu tipurile mai severe de VWD.
Evaluarea kinetoterapiei
Potrivit MASAC; evaluarea kinetoterapiei este un element important al managementului VWD. Scopul evaluării este de a detecta limitările musculo-scheletice și alte limitări cauzate de tulburarea de sângerare care afectează activitățile funcționale și activitățile de viață cotidiană (ADL) [27] .
Istorie și interviu [27]:
Acesta include intervievarea pacientului sau a îngrijitorului și luarea notelor despre:
- Istorie personala
- Istorie de familie
- Istoria sângerării
- Istoricul medical și chirurgical
- Istoria durerii
- Preocupări ADL
- Preocupări profesionale
Articulațiile care prezintă tulburări recurente de sângerare sunt cunoscute sub numele de „Articulații țintă”. Cele mai frecvente articulații țintă sunt genunchiul, cotul, glezna, șoldul și umerii. [26]
Evaluare subiectivă:
- Palparea articulațiilor în repaus și în timpul mișcării active pentru a detecta crepitus, sinovită, edem sau temperatură
- Măsurarea circumferinței (măsurarea circumferinței cu o măsurătoare cu bandă) pentru a evalua edemul/atrofia musculară
- Detectarea simțului atipic al capătului articulației prin raza de mișcare pasivă
- Testare manuală a mușchilor pentru evaluarea forței musculare
- Test de flexibilitate musculară
- Senzație și propriocepție
Evaluarea obiectivelor:
- Evaluarea echilibrului și a căderii
- Evaluarea posturii și alinierii
- Evaluarea activităților funcționale
- Analiza mersului
- Evaluarea neuromotorie
- Ecografie musculo-scheletică
Tratament de kinetoterapie:
Există un program de kinetoterapie recomandat de MASAC pentru mușchii și articulațiile care sângerează în diferite faze de recuperare (acută, subacută și cronică). Toți mușchii respectă aceleași linii directoare, cu excepția mușchiului iliopsoas, iar toate protocoalele sugerate de kinetoterapie sunt efectuate după medicația de înlocuire a factorilor după cum urmează: [28]
Prezentați dureri în repaus și cu mișcare
Limitări ale ADL fără creșterea durerii față de valoarea inițială
Limitarea ADL, dar fără durere
- Lucrați îndeaproape cu un hematolog
- Învățați pacientul să evite întinderea excesivă
- Educație privind modificarea activității
- Durata tratamentului va varia în funcție de nevoile individuale
- Ecografia pentru absorbția sângelui poate fi utilizată cu precauții.
- Atenție cu utilizarea compresiei pe mușchiul afectat.
- Utilizarea modalităților de căldură, inclusiv ultrasunete, cu precauții
- Fără compresie în caz de simptome neuromusculare.
- Nici o mișcare activă sau greutate până la oprirea sângerării.
- OREZ: odihnă, gheață, compresie și înălțime
- Dispozitive de atelare și asistență pentru a limita activitatea
- Atingerea degetelor de la picioare
- Gama activă de mișcare
- AAROM fără durere
- Rulment complet, fără dispozitive de asistare
- Exerciții Active Range of Motion
durerea prezentată în repaus și cu mișcare
Limitarea ADL fără creșterea durerii de la momentul inițial
Limitarea ADL, dar fără durere
- Întinderea flexorului șoldului cu precauție.
- Învățați pacientul să evite întinderea excesivă
- Durata tratamentului va varia în funcție de individ
- Rulment pentru atingerea degetelor de la picioare pentru mobilitatea gospodăriei
- Pompele pentru glezne ROM opuse au implicat membrul inferior cu evitarea durerii
- Degetele ating atingerea greutății fără creșterea durerii
- Exerciții active de mișcare la membrele inferioare implicate fără creșterea durerii
- Poziționarea cu creșterea extensiei șoldului Gama de mișcare în decubit dorsal și predispus la perne fără creșterea durerii.
- exerciții terapeutice pentru membrul neimplicat
- Rulment complet, fără dispozitive de asistare
- se întinde pozițional din poziția înclinată
- Gama activă de exerciții de mișcare
durerea prezentată în repaus și cu mișcare
Limitarea ADL fără creșterea durerii de la momentul inițial
Limitarea ADL, dar fără durere
- Lucrați cu un hematolog.
- RMN suplimentar pentru a determina prezența sinovitei cronice)
- Durata tratamentului va varia în funcție de nevoile individuale.
- Monitor pentru comprimarea nervilor
- Utilizarea modalităților de căldură, inclusiv ultrasunete, cu precauții
- Nu vă mai întoarceți la sport sau activitate până când nu aveți ROM completă și durere
- OREZ (gheață timp de 10-20 minute la fiecare 1-2 ore)
- Rulment fără greutate utilizând dispozitiv de asistență
- Continuați orezul pentru durere și după efort
- Atela de odihnă de noapte pentru protecție
- Începeți purtarea progresivă a greutății
- Modificarea activității pentru a evita durerea
- Fără dureri, blând activ Domeniu de mișcare
- Consolidare progresivă fără durere
- Așezare dinamică pentru creșterea ROM-ului
- Gama activă de mișcare Progresivă
- Întărire ca lanț deschis, lanț închis și bandă rezistivă
- Simptomele bolii Von Willebrand, cauze, diagnostic, tratament
- Von Willebrand; Boala s Tipuri, simptome, factori de risc și cauze
- Von Willebrand s Disease Michigan Medicine
- Boala Von Willebrand - NHS
- Descoperirea adevărului despre boala celiacă și sensibilitatea la gluten non-celiacă
- De ce nu este Dumnezeu; t Nebun că ți-ai încurcat dieta
- Contează apa spumantă pentru 8 ochelari pe zi Glamour
- Cele mai bune 10 alimente pentru creșterea cantității de lapte în timpul alăptării
- Natură; s Curățare secretă pentru pierderea în greutate de 15 zile; Culoare; Supliment uriaș
- 11 Beneficii dovedite ale postului (nr
- În interiorul antrenamentului de box și dietă pentru Jake Gyllenhaal pentru Southpaw - Men s Journal
- Budincă de semințe de chia și scorțișoară de vanilie - Bucătărie subțire
- Reddit - germania - slăbesc mereu mâncând ca un porc în Germania și mă îngraș mult
- 13 Cele mai bune rețete de orez 13 Cele mai bune rețete de orez Rețete ușoare de orez - NDTV Food
- Pachet de pierdere în greutate - HealthWisdom