Pishan Chang
a Center for Biomedical Sciences, School of Biological Sciences, Royal Holloway University of London, Egham, TW20 0EX, UK
Nicole Terbach
a Center for Biomedical Sciences, School of Biological Sciences, Royal Holloway University of London, Egham, TW20 0EX, UK
Nick Plant
b Centrul de toxicologie, Facultatea de Științe medicale și a sănătății, Universitatea din Surrey, Guildford, GU2 7XH, Marea Britanie
Philip E. Chen
a Center for Biomedical Sciences, School of Biological Sciences, Royal Holloway University of London, Egham, TW20 0EX, UK
Matthew C. Walker
c Departamentul de Epilepsie Clinică și Experimentală, Institutul de Neurologie, University College London, WC1N 3BG, Marea Britanie
Robin S.B. Williams
a Center for Biomedical Sciences, School of Biological Sciences, Royal Holloway University of London, Egham, TW20 0EX, UK
Abstract
Acest articol face parte din numărul special intitulat „Noi obiective și abordări ale tratamentului epilepsiei”.
Repere
► Acizii grași cu lanț mediu drept și ramificat au fost examinați pentru controlul convulsiilor in vitro. ► Specificitatea structurală a fost arătată pentru acești compuși. ► Efectele secundare au fost examinate pentru compușii activi de combatere a convulsiilor. ► Controlul convulsiilor in vivo, sedarea și neuroprotecția au fost prezentate pentru acești compuși. ► Acizii grași cu lanț mediu legați de dieta ketogenică MCT pot fi activi în controlul convulsiilor.
1. Introducere
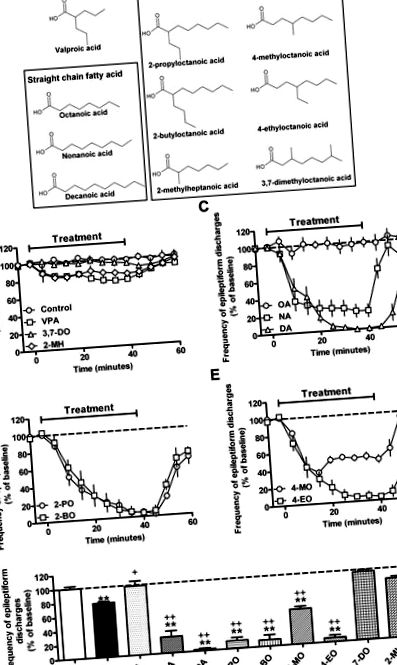
Dieta ketogenică cu trigliceride cu lanț mediu (MCT) a oferit una dintre cele mai eficiente abordări terapeutice pentru copiii cu epilepsie rezistentă la medicamente (Kossoff și colab., 2009; Liu, 2008; Neal și colab., 2009; Rho și Stafstrom, 2012; Sills și colab., 1986b; Vining și colab., 1998). Cu toate acestea, utilizarea sa a fost limitată de o toleranță slabă, în special la adulți, crescând necesitatea dezvoltării unor noi terapii bazate pe această dietă. Dieta MCT determină o creștere a formării corpului cetonic, dar aceasta se corelează slab cu controlul convulsiilor (Likhodii și colab., 2000; Thavendiranathan și colab., 2000). De asemenea, provoacă acumularea de acizi grași cu lanț mediu în plasma sanguină (în special acizi octanoici și decanoici, Fig. 1 A) (Haidukewych și colab., 1982; Newport și colab., 1979; Sills și colab., 1986a), deși rolul acestor acizi grași, dacă este cazul, în controlul convulsiilor rămâne neclar.
Acidul valproic cu acizi grași cu lanț scurt (VPA, acid 2-propilpentanoic), este un medicament antiepileptic cu spectru larg utilizat în mod obișnuit, dar este sub-optim datorită numeroaselor efecte secundare: Cele două cele mai semnificative dintre acestea sunt teratogenitatea (Jentink și colab.)., 2010; Koren și colab., 2006), care a fost corelată cu inhibarea activității histone deacetilazei (Gottlicher și colab., 2001; Gurvich și colab., 2004; Phiel și colab., 2001), deși aici pot funcționa și alte mecanisme; și hepatotoxicitate (Lagace și colab., 2005; Stephens și Levy, 1992), potențial datorată efectelor asupra β-oxidării (Elphick și colab., 2011; Silva și colab., 2008). În plus, acizii grași cu structuri legate de VPA au fost, de asemenea, asociați cu proprietăți sedative semnificative, împiedicând adesea transpunerea în studii clinice (Bojic și colab., 1996; Keane și colab., 1983; Palaty și Abbott, 1995). Aceste efecte au influențat căutarea unor noi structuri de acizi grași cu potență crescută împotriva convulsiilor și cu un profil de efecte secundare mai bun decât VPA.
În căutarea unor noi tratamente de control al convulsiilor, un studiu recent a sugerat că acțiunea VPA implică modificarea fluctuației fosfoinozitolului în amiba socială Dictyostelium discoideum (Chang și colab., 2011). Pe baza acestui mecanism, un grup de acizi grași cu lanț mediu, incluzând atât compuși asociați cu dieta MCT, cât și o nouă familie de acizi grași ramificați înrudiți au fost identificați ca potențiale noi terapeutice pentru epilepsie. O mai bună înțelegere a acestor compuși ar putea, prin urmare, ajuta la producerea de tratamente mai eficiente pentru epilepsie.
În acest studiu, am investigat potența unei game de acizi grași cu lanț mediu drept și ramificat în controlul crizelor folosind un sistem model in vitro, permițând o dozare precisă a medicamentului, evitarea confundătorilor, cum ar fi bariera hematoencefalică și fluxul rapid, în comparație către VPA. Am folosit un model in vitro în care VPA la doze mari (2 mM) arată doar eficacitate parțială (Armand și colab., 1998) pentru a identifica compușii care sunt potențial superiori VPA. Apoi am evaluat compușii activi rezultați pentru inhibarea histonei deacetilazei și toxicitatea ficatului pentru a identifica doi acizi grași cu lanț mediu promițător pentru investigații suplimentare. Acești doi compuși au prezentat controlul convulsiilor dependente de doză în modelul in vitro (PTZ) și un control al convulsiilor mai puternic decât VPA in vivo, folosind un statut epileptic rezistent la medicamente (modelul de stimulare a căii perforante) (Holtkamp și colab., 2001). Mai mult, arătăm că unul dintre acești compuși provoacă mai puțină sedare și are un efect neuroprotector (potențial modificator al bolii) mai mare decât VPA. Datele noastre indică astfel o serie de acizi grași care prezintă o potență crescută în controlul convulsiilor și efecte secundare potențial reduse comparativ cu medicamentul antiepileptic disponibil în prezent, VPA.
2. Materiale și metode
2.1. Animale
Șobolanii Sprague-Dawley masculi (SD) au fost ținuți în condiții de mediu controlate (24-25 ° C; 50-60% umiditate; 12 h ciclu lumină/întuneric) cu acces gratuit la alimente și apă. Toate experimentele au fost efectuate în conformitate cu liniile directoare din Legea privind animalele (proceduri științifice) din 1986. S-au făcut toate eforturile pentru a reduce la minimum suferința animalelor și pentru a reduce numărul de animale utilizate.
2.2. Electrofiziologie in vitro
2.3. Analiza activității HDAC
Activitatea histonei deacetilazei (HDAC) a fost analizată folosind un test comercial in vitro, setul de activitate HDAC pentru descoperirea medicamentului (Biomol, Plymouth Meeting, PA). Testele au fost efectuate la temperatura camerei în conformitate cu protocolul producătorului, folosind Trichostatin A (inhibitor HDAC; 1 μM) ca control pozitiv. Datele au fost normalizate la controale (fără VPA sau compuși de testare) pentru fiecare experiment.
2.4. Test de toxicitate hepatică
Testul de toxicitate hepatică a utilizat celule Huh7, furnizate cu amabilitate de către dr. Steve Hood (GlaxoSmithKline), cultivate în mediul de vultur modificat Dulbecco (DMEM) cu l-glutamină și roșu fenol, conținând 10% ser fetal bovin, 1% aminoacizi neesențiali, 100 U/ml penicilină și 100 μg/ml streptomicină. Toți reactivii de cultură celulară au fost cumpărați de la Invitrogen (Paisley, Marea Britanie). Celulele au fost însămânțate la 1 × 104 celule per godeu în plăci cu 96 de godeuri peste noapte și crescute până la aproximativ 80% confluență celulară înainte de expunerea la 0,01-5 mM compus de testare (sau controlul vehiculului menținut sub 0,5%) (v/v) pentru toate condițiile). După expunerea la compusul de testat timp de 24 de ore, s-a adăugat 0,5 mg/ml bromură de 3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazoliu (MTT) și celulele incubate încă 2 h pentru a permite dezvoltarea culorii . Mediul a fost apoi aspirat și înlocuit cu 100 μL DMSO per godeu și absorbanță citită la 540 nm.
2.5. Model in vivo de epilepticus
Datele in vivo au fost analizate prin analize repetate ANOVA cu timpul de măsurare ca factor subiect și tratamentul ca factor între subiect. Analiza post-hoc a tratamentelor împotriva controlului a fost efectuată utilizând testul Dunnett t față-verso și comparația între tratamente a fost efectuată utilizând testul Tukey HSD în SPSS (versiunea 20).
Pentru histologie, animalele au fost sacrificate la 2 luni după SSSE, cu o supradoză de pentobarbital sodic (500 mg/kg ip) (Fort dodge Animal Health, Southampton, Marea Britanie), iar creierele au fost scufundate în paraformaldehidă 4% în tampon fosfat 0,1 M soluție salină pH 7,4 (PBS) timp de peste 24 de ore și apoi stocată la 4 ° C înainte de transferul la PBS cu zaharoză 30% ca soluție post-fixare. Secțiunile creierului (40 μm grosime grosime) au fost tăiate folosind un vibroslicer (Leica VT 1000S Microsystems, Wetzlar, Germania) și colorarea Nissl a fost utilizată pentru a confirma poziția electrozilor și a examina gradul de neurodegenerare în hilus utilizând analiza particulelor în software-ul ImageJ aceasta calculează proporția hilului în care sunt prezenți nucleii celulari) în secțiuni comparabile de la fiecare animal (date medii din patru felii pe tratament).
2.6. Experiment de sedare
VPA, acid 4-metiloctanoic și acid nonanoic au fost administrați (i.p.) la 200, 400 sau 600 mg/kg șobolanilor SD masculi. Gradul de sedare a fost evaluat utilizând o scară bine stabilită: 0, mișcare spontană; 1, mișcare spontană intermitentă; 2, fără mișcare spontană; 3, pierderea reflexului auditiv; 4, pierderea reflexului corneean; 5, pierderea răspunsului la ciupirea cozii (Fisher și colab., 2004; Holtkamp și colab., 2001; Lee și colab., 1998). Nivelul de sedare a fost înregistrat la 10 minute după i.p. injecție și apoi la fiecare 30 de minute timp de 3 ore.
2.7. analize statistice
În toate datele furnizate, rezultatele sunt prezentate ca medie ± SEM. Comparațiile statistice au fost efectuate utilizând testul Mann-Whitney și un mod ANOVA urmat de Dunnett pentru analiza post hoc folosind SPSS.
3. Rezultate
3.1. Efectul acizilor grași cu lanț mediu asupra activității de control a convulsiilor in vitro
În legătură cu dieta ketogenică MCT, trebuie remarcat aici că concentrația de acid decanoic în serul pacienților aflați în dietă (concentrația medie 157 μM (Haidukewych și colab., 1982)) este mai mică decât cea utilizată în in vitro test. Repetând aceste experimente de control al descărcării epileptiforme folosind o concentrație mai mică de acid decanoic (100 μM), am constatat o reducere semnificativă a frecvenței descărcărilor epileptiforme (Fig. S2 suplimentar) care a fost superioară VPA echimolar. În plus, potența acidului decanoic a fost, de asemenea, mai mare decât cea a valnoctamidei (VCD; vezi Fig. S1 suplimentară pentru structură) - un nou derivat VPA de a doua generație (Bialer și White, 2010). Aceste date indică faptul că acidul decanoic, la concentrațiile găsite la pacienți în timpul tratamentului cu dieta ketogenică, poate oferi un control îmbunătățit al convulsiilor comparativ cu tratamentele actuale și de nouă generație.
3.2. Efectul acizilor grași cu lanț mediu asupra activității histonei dezacetilazei umane (HDAC)
VPA și acizii grași înrudiți au fost bine documentați pentru a inhiba activitatea HDAC (Gottlicher și colab., 2001; Gurvich și colab., 2004; Phiel și colab., 2001), care este probabil să provoace teratogenitate și astfel să limiteze utilizarea lor în timpul sarcinii. (Jentink și colab., 2010; Koren și colab., 2006). Astfel, am analizat această importantă răspundere a efectelor secundare la compușii care prezintă o inhibare îmbunătățită a activității epileptiforme în modelul PTZ comparativ cu VPA (Fig. 2). Așa cum era de așteptat, VPA a arătat o inhibare dependentă de doză a activității HDAC, crescând la 82,9 ± 1,8% inhibare la 10 mM. Acidul decanoic nu a prezentat inhibiții HDAC la concentrații scăzute, ci o potență inhibitoare similară cu VPA la 10 mM (79,3 ± 16,5% inhibare). În schimb, acidul nonanoic a prezentat o activitate inhibitoare minimă la toate concentrațiile testate (până la 10 mM). Așa cum s-a prezis în alte studii (Eikel și colab., 2006), acizii grași cu lanț mediu ramificați pe cel de-al doilea carbon prezintă, de asemenea, o activitate inhibitorie ridicată a HDAC (acid 2-propiloctanoic și acid 2-butiloctanoic); cu toate acestea, compușii cu ramificare pe cel de-al patrulea carbon nu au prezentat inhibarea HDAC până la 10 mM. Aceste date arată că acidul decanoic și compușii ramificați pe al doilea carbon prezintă o inhibare nedorită a HDAC, în timp ce acest lucru nu este evident în compușii înrudiți care conțin o ramură pe al patrulea carbon.
- Strategii pentru realizarea unei diete sănătoase și reducerea sănătății grăsimilor trans și a acizilor grași saturați -
- Acizi grași omega-3 și obezitate SciTechnol
- Suplimentarea cu vitamine B sau acizi grași n-3 și simptome depresive în cardiovasculare
- Fiziopatologie și aspecte evolutive ale grăsimilor dietetice și acizilor grași polinesaturați cu lanț lung
- Obezitate și acizi grași liberi (FFA)