Abstract
Introducere
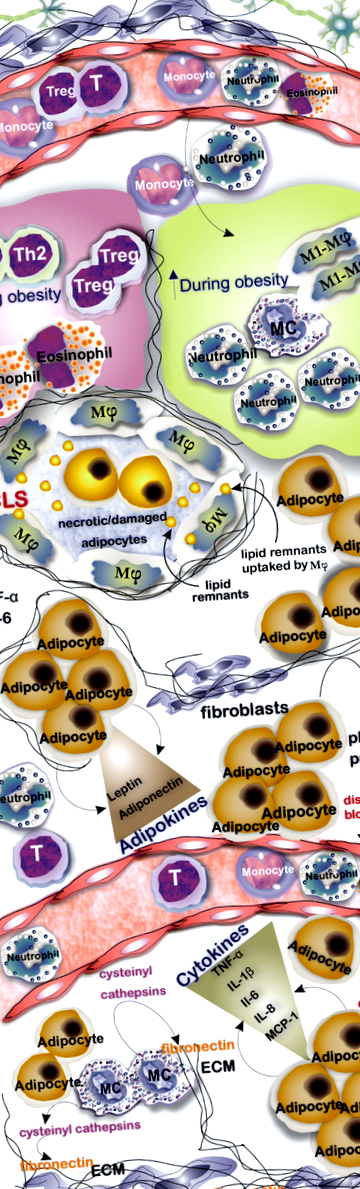
Adipocitele sunt principala populație de celule din AT. Cu toate acestea, mai multe tipuri de celule se găsesc frecvent în AT, care numărul acestora variază în AT slab și obez, de exemplu, în timp ce numărul de macrofage M1, MC și neutrofile crește în obezitate, numărul de rezidenți AT Th2, Treg și eozinofile. scade. AT în obezitate este infiltrat de celulele inflamatorii, iar formarea structurilor asemănătoare coroanei caracterizate prin adipocite necrotice/deteriorate în cerc cu macrofage este o constatare obișnuită. Adipocitele nu numai că stochează lipidele, ci și eliberează mai multe citokine și adipokine care influențează răspunsurile imune și hemostaza țesutului. O creștere a numărului și mărimii adipocitelor care înconjoară sistemul vasculatură are ca rezultat formarea presiunii fizice și perturbarea consecventă a fluxului sanguin. MC prin inducerea eliberării cisteinil catepsinelor din endotelial și adipocite joacă un rol în catabolizarea fibronectinei
Un număr tot mai mare de cercetători au raportat acumularea de MC în AT a persoanelor obeze [8, 9]. MC stimulează eliberarea cisteinil catepsinelor din celulele vasculare și adipocite pentru a cataboliza proteina fibronectină ECM pentru a susține adipogeneza [10]. S-a raportat că injectarea intraperitoneală de cromoglicat disodic (DSCG; un inhibitor utilizat pe scară largă al activării și degranulării MC) la șoareci de tip sălbatic (WT) împiedică capacitatea de a crește greutatea corporală [11]. Interesant este faptul că investigațiile recente au legat efectele pozitive ale alimentelor tradiționale precum pepenele amar chinezesc și quercetina (un bioflavonoid găsit în plantele dietetice) cu capacitatea de a reduce creșterea în greutate corporală și rezistența la insulină (IR) la MC în care utilizarea acestor alimente reduce infiltrarea de MC în AT și previne formarea unui microambient inflamator [12, 13]. A avea o înțelegere moleculară a diafragmei dintre celulele rezidente AT și celulele infiltrate, inclusiv monocitele și macrofagele, poate arunca o lumină asupra unui tratament mai bun al obezității și al bolilor conexe, cum ar fi IR și diabetul.
Originea, dezvoltarea și funcția mastocitelor
A MC exprimă un spectru larg de receptori pentru chemokine și citokine. Receptorii lor principali pentru IgG, IgE și SCF sunt descriși. b Adipocitele sunt derivate din celulele progenitoare adipocite. Sunt arătați principalii lor receptori de suprafață și molecule implicate în recunoașterea celulelor. c Mecanismul molecular al UCP1 în producerea căldurii
Structura și biologia țesutului adipos
Deși AT a fost considerat inițial un organ inert de depozitare a grăsimilor, această viziune s-a schimbat în ultimele decenii. Acum este definit ca un țesut foarte metabolic și activ, care reacționează la anumite substanțe chimice și produce multe adipokine (care acționează ca un organ endocrin) care reglează metabolismul [22]. AT este un țesut conjunctiv liber compus dintr-o varietate de celule, în principal adipocite, care sunt înconjurate de o matrice de fibre de colagen, fibroblaste, vase de sânge și celule imune [23]. Aportul caloric în exces este însoțit de depunerea grăsimii și creșterea adipocitelor, urmată de activarea stresului reticulului endoplasmatic și orchestrarea răspunsurilor la stresul oxidativ [24]. Activarea acestor căi are ca rezultat producerea și eliberarea de citokine pro-inflamatorii în principal IL-6 și TNF-α [24]. Formarea unui astfel de mediu proinflamator susține activarea leucocitelor rezidente și infiltrarea altor celule inflamatorii, inclusiv macrofage, neutrofile, celule dendritice, limfocite și MC [24, 25]. ECM joacă un rol cheie în homeostazie și reglarea AT. Acumularea de proteine ECM, inclusiv colagen în stadiile incipiente ale obezității, contribuie la remodelarea țesuturilor prin care se promovează fibroza și infiltrarea leucocitelor pro-inflamatorii în AT [26].
AT produce o gamă largă de adipokine care joacă roluri cheie în reglarea metabolismului glucozei și lipidelor [27], iar neregularitatea acestora a fost legată de inflamația sistemică [28]. (Tabelul 1).
AT de indivizi slabi produce și eliberează adipokine cu proprietăți antiinflamatorii în principal adiponectină și apelină, în timp ce AT de indivizi obezi eliberează citokine pro-inflamatorii, cum ar fi rezistină, leptină și visfatină [43]. În plus, unele investigații relevă proprietățile imunoreglatorii ale adipokinelor, cum ar fi adiponectina, care suprimă activarea macrofagelor M1, promovând în același timp proliferarea subtipului M2 [44]. Proliferarea și diferențierea celulelor progenitoare ale preadipocitelor sau adipocitelor în cadrul fracției vasculare stromale duc la formarea de noi adipocite [45]. În adipogeneză sunt implicați progenitori adipocitari albi murini cu CD31 -, CD45 -, CD29 +, CD34 +, Sca-1 + și CD24 +/− fenotip [45] (Fig. 2b).
Celulele imune din țesutul adipos
Celulele imunității înnăscute
Rolul monocitelor și macrofagelor în cadrul AT
O caracteristică distinctă a inflamației de grad scăzut în AT este formarea structurilor asemănătoare coroanei (CLS) care sunt aranjamente sincițiale compuse din adipocite necrotice/deteriorate înconjurate cu macrofage. Prezența CLS este asociată cu niveluri crescute de mediatori inflamatori, în principal TNFα și prostaglandină E2 [53]. Investigațiile au arătat că aceste macrofage pot resorbi resturile lipidice ale adipocitelor moarte înconjurate și, de asemenea, pot contribui la inflamație [54]. O diferență între cele două tipuri de AT alb este numărul mai mic de CLS prezent în AT subcutanat în comparație cu AT visceral atât la șoareci obezi, cât și la șoareci slabi [55]. Numărul de macrofage F4/80 + CD11b + crește în WAT obez. Acestea produc IL-6, TNFα și metaloproteinaze (MMP) care sunt asociate cu dezvoltarea IR și stabilirea unui microambient inflamator [24, 56].
Rolul neutrofilelor în cadrul AT
Neutrofilele se numără printre primele celule care se infiltrează la AT la începutul unei diete bogate în grăsimi (HFD) la șoareci [64]. Aceștia pot fi atrași de AT de IL-8 secretată de adipocite și de CXCL2 secretată de macrofage [24, 58]. Elastaza secretată de neutrofile contribuie la polarizarea macrofagelor M1 prin TLR-4 și degradează substratul receptorului de insulină-1, ceea ce duce la scăderea sensibilității la insulină a AT [24]. În cadrul AT, neutrofilele eliberează citokine pro-inflamatorii, inclusiv IL-8, CCL2, MMP-9 și mieloperoxidază, care agravează starea inflamatorie [58]. Dovezile pentru rolul activării neutrofilelor în obezitate includ expresia crescută a markerului de activare CD66b și creșterea mieloperoxidazei și calprotectinei eliberate de neutrofile circulatorii. Mieloperoxidaza contribuie la dezvoltarea obezității, iar ablația sau inhibarea acesteia previne creșterea în greutate și IR [65]. În plus, superoxizii eliberați de neutrofile induc apoptoza și activează macrofagele prin care acestea contribuie la formarea unei stări pro-inflamatorii [29]. Elastaza în rândul mediatorilor eliberați de neutrofile este importantă în inducerea IR și inhibarea elastazei îmbunătățește sensibilitatea la insulină [64].
Celulele de imunitate adaptivă
Implicarea celulelor de imunitate înnăscută și adaptativă în orchestrarea răspunsurilor în AT. Sunt prezentate activitățile inflamatorii și antiinflamatorii ale macrofagelor M1 și M2
Mastile reziduale ale țesutului adipos
Imunomarcarea secțiunilor AT pentru triptază și CD117 este o abordare comună utilizată pentru a determina prezența populațiilor de MC în cadrul AT [11]. MC cu profilul lor pro-inflamator de mediatori promovează starea de inflamație și participă la apoptoză și angiogeneză și pot contribui la progresia obezității și a intoleranței la glucoză prin eliberarea IL-6 și IFN-γ [11] (Tabelul 2).
Populația de MC din țesutul adipos are o natură dinamică, prezentând modificări asociate remodelării țesuturilor în obezitate. Atât maturarea, cât și diferențierea MC-urilor ar putea apărea în WAT, deoarece celulele c-Kit + Thy - 1 lo Lin - Sca + găsite în tampoanele de grăsime subcutanată ale mouse-ului se diferențiază în MMC in vitro [22, 68]. Pe baza pozițiilor anatomice ale tampoanelor de grăsime, cum ar fi grăsimea subcutanată și epididimă, MC prezintă activitate și distribuție diferite [31]. De exemplu, WAT visceral al șoarecilor obezi prezintă un număr mai mare de MC comparativ cu cei ai șoarecilor slabi. Mai mult, nu există nicio diferență semnificativă în numărul MC în WAT subcutanat între șoareci obezi și slabi [68]. S-au constatat diferențe profunde la compararea MC în țesutul adipos la obezitatea morbidă și după pierderea în greutate indusă de chirurgia bariatrică. În mod surprinzător, a existat o creștere dramatică a MC rezidente adipoase în grupul de pierdere în greutate, cu o creștere de zece ori a creșterii viscerale și de patru ori a țesutului adipos subcutanat [70]. Șoarecii cu deficit de MC și agenții stabilizatori ai MC, cum ar fi cromoglicatul disodic, au servit pentru a încerca să definească rolurile MC rezidente la AT în obezitate și IR. În plus, s-a raportat reducerea farmaceutică a MC atunci când a fost aplicată pioglitazona, un agonist PPARγ [4, 11].
MC Crosstalk cu celule de țesut adipos
Funcția mediatorilor MC în țesutul adipos - lecții din modele animale
Rezumatul grafic al a trei modele animale pentru a arăta implicarea MC în obezitatea indusă de dietă. (WT: tip sălbatic, AT: țesut adipos, HFD: dietă bogată în grăsimi, HSC: celule stem hematopoietice, CLODs: lipozomi de sodiu clodronat, DSCGs: lipozomi de sodiu cromoglicat disodic, BMMC: mastocite derivate din măduva osoasă)
Rolul MC în AT Browning
Discutie si concluzie
Deși o privire de ansamblu asupra rezultatelor indică faptul că absența MC nu previne obezitatea, investigațiile au avut ca scop dezvăluirea interacțiunilor MC și adipocitelor arată că MC se acumulează în AT a persoanelor obeze, incluzând atât modelele de șoarece, cât și oamenii. Mai mult, MC rezidenți la AT sub influența citokinelor derivate din AT devin activate și eliberează citokine pro-inflamatorii care agravează starea inflamatorie. În plus, MC joacă un rol în remodelarea AT ECM și contribuie la recrutarea leucocitelor cu activitate inflamatorie. Sunt necesare investigații suplimentare pentru a defini pe deplin diafragma dintre MC și alte celule rezidente la AT și modul în care aceasta afectează inflamația, homeostazia energetică și inducerea adipocitelor bej.
- Condiții congenitale de hipofosfatemie la copii SpringerLink
- Disabilitate și condiții legate de sănătate CDC
- Descoperirea modului în care celulele simt nivelul de oxigen câștigă Premiul Nobel
- Efectul Giardia duodenalis la șoarecii proteici subnutriți și re-hrăniți SpringerLink
- Polimorfismele genei FTO și riscul de obezitate în populația chineză o meta-analiză SpringerLink