Ryan A. Selleck
1 Departamentul de farmacologie celulară și moleculară, Universitatea de Medicină și Științe Rosalind Franklin, 3333 Green Bay Rd. North Chicago, IL 60064
Brian A. Baldo
2 Departamentul de Psihiatrie, Universitatea din Wisconsin-Madison Școala de Medicină și Sănătate Publică, 6001 Research Park Blvd. Madison, WI 53719
Abstract
Raţional
În timp ce acțiunile opioidelor modulatoare de recompensă au fost studiate intens în siturile subcorticale, cum ar fi nucleul accumbens (Acb), rolul transmiterii opioidelor corticale a primit relativ puțină atenție.
Obiective
Pentru a descrie descoperirile recente privind acțiunile motivaționale ale opioidelor din cortexul prefrontal (PFC), subliniind studiile privind motivația și ingestia alimentelor. Efectele opioide pe bază de PFC vor fi comparate/contrastate cu cele obținute din Acb, pentru a culege posibile principii funcționale comune. În cele din urmă, efectele motivaționale ale opioidelor vor fi plasate într-un context de rețea care implică PFC, Acb și hipotalamus.
Rezultate
Stimularea receptorului Mu-opioid (μ-OR) atât în Acb, cât și în PFC induce alimentația și îmbunătățește comportamentele instrumentale de căutare a alimentelor; Semnalizarea μ-OR îmbunătățește, de asemenea, reactivitatea gustului într-o zonă foarte circumscrisă a cochiliei mediale Acb. Atât în Acb, cât și în PFC, zonele sensibile la opioide sunt aliniate topografic cu sectoarele care se proiectează către zonele modulatoare de hrănire ale hipotalamusului, iar transmisia intactă a glutamatului în zonele hipotalamice laterale/perifornicale (LH-PeF) este necesară atât pentru Acb- și alimentarea cu PFC. În schimb, răspunsurile de hrănire mediate de opioide obținute din PFC sunt modulate negativ de semnalizarea AMPA în învelișul Acb.
Concluzii
Semnalizarea opioidelor din PFC implică circuite PFC opal opțional → hipotalamus și circuite PFC → Acb, care conduc și limitează hrănirea non-homeostatică, producând un model dezorganizat și „fragmentat” de comportamente impulsive în căutarea alimentelor și hiperactivitate. În plus, opioidele acționează direct în Acb pentru a facilita motivația alimentară și gustul hedonic. Studiul suplimentar al acestui circuit cortico-striato-hipotalamic și încorporarea unor structuri telencefalice suplimentare cu sensibilitate la opioide ar putea oferi informații cu relevanță tradițională pentru tulburările de alimentație și obezitate.
Introducere
În spiritul acestui număr special, discutăm un subiect care a apărut proeminent în aclamata și extrem de impactantă carieră științifică a regretatului Dr. Athina Markou: substraturile neuronale care stau la baza funcției de recompensare. Deși Dr. Interesele lui Markou se referă la mai multe domenii ale psihiatriei biologice, munca ei a fost unificată de ideea că studierea funcției de recompensare centrală (adesea folosind tehnica extrem de adaptabilă și informativă de stimulare-recompensare a creierului) ar putea oferi o „fereastră” către întrebări provocatoare privind componentele afective ale recompensă de droguri, retragere sau afecțiuni psihiatrice, cum ar fi schizofrenia. Aici, explorăm mecanismele de rețea care stau la baza acțiunilor hrănitoare-modulatoare ale opioidelor telencefalice. Niciunul dintre acești subiecți (hrănirea sau opioidele) nu au fost focare particulare ale Dr. Cercetările lui Markou. Cu toate acestea, sperăm că această discuție poate îmbunătăți înțelegerea principiilor generale prin care rețelele telencefalice modulează funcția motivațională, care poate avea o relevanță largă pentru problemele pe care Dr. Markou a studiat atât de productiv și cu succes în cariera ei.
Acțiuni opioide modulatoare de hrănire în Acb
S-a emis mult timp ipoteza că funcția opioidă endogenă modulează un aspect al recompensei alimentelor, posibil experiența hedonică a consumului de alimente preferate. Studiile timpurii au arătat că blocarea receptorilor opioizi reduce plăcerea percepută a alimentelor gustoase, fără a modifica semnificativ sentimentele de foame, percepția gustului de bază sau intensitatea gustului (Drewnowski și colab. 1992; Fantino și colab. 1986; Yeomans și Gray 1996). În mod similar, tratamentul sistemic cu agoniști sau antagoniști opioizi la șobolani crește selectiv, respectiv scade, respectiv, consumul de soluții gustabile și diete preferențial față de chow-ul standard (Apfelbaum și Mandenoff 1981; Cooper 1983; Giraudo și colab. 1993; Levine și colab. 1982) S-a constatat că administrarea antagonistă opioidă sistemică împiedică formarea și exprimarea preferințelor gustative (Cooper 1983; Cooper și Turkish 1989; Evans și Vaccarino 1990; Lynch 1986). În consecință, Levine și colegii săi au demonstrat că eficacitatea naloxonei la reducerea consumului de alimente (1) este invers legată de nivelul de privare a hranei la care este supus animalul (Levine și colab. 1995; Rudski și colab. 1994; Weldon și colab. 1996 ) și (2) depinde de preferințele dietetice individuale (Glass și colab. 1996). Deoarece privarea alimentară sporește gustul și evaluarea recompensei alimentare (Berridge 1991; Cabanac și Duclaux 1973; Cameron et al. 2014), ambele constatări ar putea fi interpretate ca indicând faptul că funcția endogenă opioidă modulează impactul satisfăcător al alimentelor.
Încercările de localizare a acțiunilor opioide care modulează hrănirea în creier au dezvăluit site-uri receptive la opioide la niveluri neuronale variind de la cortex până la trunchiul cerebral (Giraudo și colab. 1998; Kim și colab. 2004; Leibowitz și Hor 1982; Mena și colab. 2011; Wilson și colab. 2003; Woods și Leibowitz 1985; Zhang și Kelley 2000). Unul dintre cele mai studiate zone de acțiuni opioide modulatoare de hrănire este Acb, iar manipulările medicamentelor din această structură au aruncat o oarecare lumină asupra proceselor motivaționale distincte care contribuie la modularea opioidelor de hrănire. Studiile timpurii au descoperit că infuziile de morfină intra-Acb (injecțiile au fost localizate în miezul medial) au crescut aportul de alimente și că naloxona a inversat acest efect (Majeed și colab. 1986; 1986). Mai mult, stimularea intra-Acb μ-OR a crescut aportul de soluții gustabile, indiferent de modalitatea gustului sau de conținutul caloric (zaharoză, zaharină sau soluții saline) (Zhang și Kelley 2002) și un studiu care utilizează diete special formulate în care aroma variază, dar conținutul de macronutrienți a fost menținut constant, a arătat că blocarea intra-Acb μ-OR a redus aportul de aromă preferat la momentul inițial (Woolley și colab. 2006). Aceste constatări converg către interpretarea conform căreia funcția opioidă endogenă (cel puțin în Acb) modulează impactul satisfăcător al alimentelor sau gusturilor preferate intrinsec, mai degrabă decât să afecteze selectiv un anumit gust, o caracteristică orosenzorială sau o consecință post-ingestivă.
Acțiuni opioide modulatoare de hrănire în PFC
Efectele motivaționale ale opioidelor telencefalice: un model de rețea cortico-striato-hipotalamic
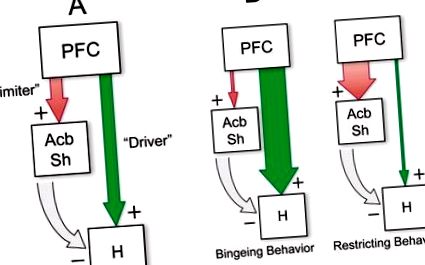
Luarea în considerare a organizării topografice a gradienților corticali și striați ai sensibilității la opioide sugerează posibile căi eferente prin care opioizii telencefalici modulează motivația apetitivă. În primul rând, siturile corticale frontale din care pot fi obținute cele mai puternice răspunsuri de hrănire induse de μ-OR sunt grupate într-un „coridor ventromedial” format din situri atât în cortexul medial, cât și în orbitofrontal, care inervează zonele sensibile la opioide din Acb și striatul dorsal ( Heilbronner și colab. 2016; Schilman și colab. 2008; Thompson și Swanson 2010; Vertes 2004). În special, zona infralimbică se proiectează puternic către coaja Acb (Heilbronner și colab. 2016; Thompson și Swanson 2010), inclusiv zona anteromedială care joacă un rol specializat în medierea hedonicii gustului (Pecina și Berridge 1995). S-au dovedit, de asemenea, că siturile sensibile la opioide din cortexul frontal se îndreaptă spre hipotalamus, incluzând zone laterale și perifornicale ale hipotalamusului tuberal, din care pot fi obținute răspunsuri intense de hrănire prin infuzii locale de agoniști de glutamat sau neuropeptidă Y (Floyd și colab. 2001; Gabbott și colab., 2005; Reppucci și Petrovich 2016; Vertes 2004). În mod similar cu PFC ventromedial, AcbSh medial se proiectează în zonele modulatoare de hrănire ale hipotalamusului, atât direct, cât și indirect, prin palidul ventral (Groenewegen și colab. 1993; Haber și colab. 1985; Heimer și colab. 1991; Mogenson și colab. 1983 ).
Pentru a rezuma principiile principale ale modelului de rețea, activitatea μ-OR din PFC sau Acb pare să conducă alimentarea printr-un nod de ieșire obligatoriu în PeF-LH, deși prin mecanisme distincte. Proiecțiile glutamatergice PFC stimulează sistemele de hrănire hipotalamică, în timp ce inhibarea efectelor GABA-ergice Acb dezinhibă aceste sisteme. Dimpotrivă, activarea Acb prin stimularea receptorului AMPA (posibil care rezultă din proiecțiile glutamatergice PFC) inhibă hrănirea, parțial prin control inhibitor descendent asupra hipotalamusului, dar și prin recrutarea comportamentelor nedorite. Angajarea incoerentă a acestor căi paralele de „conducere-hrănire” și „limitare a hrănirii” prin semnalizare opioidă ar putea duce la comportamente dezorganizate, impulsive de căutare a alimentelor, precum cele generate de stimularea μ-OR în PFC ventromedial (Mena și colab. 2011 Selleck și colab., 2015). FIG. 1 prezintă o schemă care rezumă acest model, împreună cu posibile patologii de hrănire care decurg din diferite tipuri de disfuncții ale rețelei.
Împreună, studiile discutate mai sus sugerează căi multiple prin care prelucrarea amigdalară se poate integra cu circuitele de „conducător” și „limitator” de alimentare descrise mai sus, incluzând, dar fără a se limita la: (1) convergența paralelă pe un nod efector hipotalamic comun; (2) reglarea răspunsurilor la opioide la nivelul Acb și/sau PFC, fie prin proiecții monosinaptice, fie prin căi în mai multe etape prin intermediari precum neuronii orexină sau neuroni dopaminici VTA; (3) controlul descendent al funcției amigdalei de către PFC. Tachinarea acestor interacțiuni în rețea, folosind abordări optogenetice și chimiogenetice contemporane, reprezintă o direcție interesantă pentru cercetările viitoare.
- Efectele postului intermitent și ale dietelor cu restricții energetice asupra profilului lipidic O revizuire sistematică
- Efectele postului religios ortodox asupra sănătății umane o revizuire sistematică SpringerLink
- Efectele AINS asupra factorilor de risc ai cancerului colorectal o mini revizuire Gene și mediu complet
- Cistinoza O trecere în revistă a diferitelor forme și a progreselor recente SpringerLink
- Efectele suplimentării cu Spirulina asupra obezității O revizuire sistematică și meta-analiză a randomizate