Hipoplazia (hipomineralizarea) este o perturbare a formării smalțului care se manifestă adesea în linii transversale, gropi sau alte nereguli pe suprafața smalțului.
Termeni asociați:
- Imagistică prin rezonanță magnetică
- Receptor Eicosanoid
- DAX1
- Displazia
- Agenesis
- Cerebel
- Fenotip
- Deficiență mentală
- Proteină
- Cromozom
Descărcați în format PDF
Despre această pagină
Tulburări pontocerebeloase
Etiologie și Fiziopatologie
PCH este moștenit într-o manieră autosomală recesivă. Mai multe mutații genetice au fost izolate în rândul persoanelor afectate de PCH, inclusiv TSEN54, RARS2, EXOSC3 și PCLO. 1 PCH2 este cel mai frecvent subtip PCH și este cauzat de o mutație în TSEN54; alte tulburări de PCH legate de TSEN includ PCH4 și 5. 4 De remarcat, TSEN54, TSEN2 și TSEN34 codifică subunitățile complexului endonucleaz de acid ribonucleic de transfer (ARNt), în timp ce mutația RARS2, care este implicată în PCH6, codifică arginil tRNA sintetaza mitocondrială. Cu toate acestea, nu este clar de ce cerebelul și pons sunt cel mai grav afectate, spre deosebire de alte structuri care se bazează, de asemenea, foarte mult pe sinteza proteinelor. 5
Cerebelul: tulburări și tratament
Tally Lerman-Sagie,. Gustavo Malinger, în Manualul de neurologie clinică, 2018
Hipoplazie pontocerebeloasă
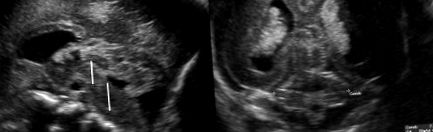
PCH este un grup de tulburări neurodegenerative autozomale-recesive cu debut prenatal, caracterizat prin hipoplazie a cerebelului și a ponsului (Bosemani și colab., 2015) (Fig. 1.21 și 1.22). Semnele clinice includ întârzieri motorii și de dezvoltare severe și letalitate precoce postnatală. Multe modificări genetice au fost identificate în PCH. Asocierile genetice sugerează mecanisme patogene legate de defecte în procesele fundamentale precum sinteza proteinelor și splicarea ARN (Basson și Wingate, 2013). Au fost identificate peste 10 subtipuri de PCH cu fenotipuri și patogeneze diferite.
FIG. 1.21. Hipoplazie pontocerebeloasă la 24 de săptămâni la un făt cu ventriculomegalie, disgeneză a corpului calos și chist caudat. În planul median (A) vermisul și al patrulea ventricul sunt anormale ca mărime și formă; fisurile vermiene nu sunt observate. Ponsul este mic în comparație cu creierul mediu; tectumul nu este bine reprezentat. Diametrul transvers cerebelos este sub a doua percentilă (B).
FIG. 1.22. Secțiuni midagittale ale imaginilor de rezonanță magnetică ponderate T2 ale unui făt cu hipoplazie pontocerebelară la 22 (A) și 30 de săptămâni gestaționale (GW)B), și la urmărirea postnatală la 16 luni (C). (A) La 22 GW pons este modelat normal; cu toate acestea, diametrul pontinului midsagittal (săgeți albe cu cap dublu) și zona vermiană midsagittal (săgeți negre) sunt ambele ușor sub intervalul normal de vârstă. (B) La 30 GW ambii parametri sunt încă mici pentru vârsta gestațională. Rețineți că la urmărirea postnatală (C), lungimea rostrocaudală a ponsului ventral este aproximativ aproximativ aceeași lungime cu lungimea rostrocaudală a creierului mediu, unde ar trebui să fie de fapt de două ori mai lungă (paranteze albe). Rețineți, de asemenea, edemul glabelei (vârfurile săgeții) ca o constatare accesorie.
Anomalia cerebeloasă se caracterizează prin hipoplazie cu atrofie suprapusă de debut prenatal. În unele cazuri de PCH există o afectare mai severă a emisferelor cerebeloase. Pe imaginile coronare, această implicare are un aspect de „libelula” care este creat de emisfere cerebelare turtite și mici și de un vermis relativ conservat. Absența sau reducerea semnificativă a proeminenței pontine este caracteristică unei boli ale creierului central cu debut prenatal (figurile 1.21 și 1.22).
PCH este foarte rar diagnosticat în uter. Leibovitz și colab. (2014b) au descris două cazuri diagnosticate la 29 de săptămâni de gestație. Ambele cazuri au arătat o reducere a tuturor măsurătorilor creierului mijlociu și ale creierului posterior, sugerând că creierul mediu este, de asemenea, implicat în PCH. Unul dintre fetiți avea microcefalie asociată. Graham și colab. (2010) nu au reușit să diagnosticheze PCH tip 2 la gemenii cărora li s-au efectuat ecografii consecutive între 20 și 30 de săptămâni de gestație. Autorii au concluzionat că imagistica prenatală nu a fost de încredere în diagnosticarea acestei tulburări in utero.
Tulburări dermatologice primare și secundare ale sânului
Ryan J. Carr,. Sara B. Peters, în The Breast (Ediția a cincea), 2018
Hipoplazie și afecțiuni asociate
Mameloanele rudimentare (absente sau mal dezvoltate) pot fi prezente ca un defect congenital izolat sau ca o componentă a sindroamelor, cum ar fi sindromul scalp-ureche-mamelon (SEN), complexul de displazie ectodermică sau Al-Awadi/Rass-Rothschild/Schinzel phocomelia sindroame. 13-16 Manifestările cutanate pot include aplazie cutisă congenitală a scalpului, urechi exterioare protuberante cupate sau pliate și păr axilar rar; cu toate acestea, manifestările variabile sunt frecvente.
Tulburări degenerative ale nou-născutului
Hipoplasie pontocerebeloasă tip 2
Sistemul de reproducere masculin
Hipoplasie testiculară.
Hipoplazia testiculelor este o afecțiune și o tulburare comună a dezvoltării sexuale. Testiculul este mai mic decât în mod normal pentru vârsta animalului și este adesea prezent în afecțiuni precum criptorhidia și alte DSD. Hipoplazia testiculului și a epididimului la un bărbat altfel normal este în centrul atenției aici.
Este dificil să se distingă hipoplazia de atrofia testiculară prin utilizarea caracteristicilor morfologice. Atât hipoplazia testiculară, cât și atrofia pot apărea singure, fără factori care să contribuie sau să influențeze aparent; fie poate fi, de asemenea, asociat cu, secundar sau parte a unei alte leziuni. Hipoplazia testiculară și epididimală (Fig. 19-14, A și B) este legată cauzal de o nutriție generală deficitară, deficiență de zinc, gene specifice rasei de roșu și alb suedez și anomalii endocrine și citogenetice. Tulburările endocrine care cauzează hipoplazie testiculară sunt cele care reduc producția de hormon luteinizant de către glanda pituitară, care la rândul său influențează producția de testosteron de către celulele endocrine interstițiale (Leydig) sau FSH de către glanda pituitară, care stimulează funcția de hrănire a Sertoli celule.
O gamă largă de anomalii citogenetice, de la translocații și mozaicuri până la nedisjuncții care provoacă polizomi ai cromozomilor sexuali, duc la hipoplazie testiculară. Cel mai cunoscut exemplu de polizomie este cariotipul XXY al sindromului Klinefelter observat la armăsari, tauri, mistreți, câini și pisici tricolore. La pisici, sindromul este recunoscut la bărbații cu tipuri tricolor, de coajă de broască țestoasă sau de calico. Aceste pisici pot fi XXY, XX/XXY sau himere sau mozaicuri mai complexe cu doi sau mai mulți cromozomi X și unul sau mai mulți cromozomi Y. Gena pentru negru și gena pentru portocaliu sunt purtate una pe cromozomul X, astfel încât o pisică masculină normală nu ar trebui să aibă păr de ambele culori.
Hipoplazia testiculului poate apărea teoretic atunci când numărul sau lungimea tubilor seminiferi este redusă sau când nu există sau sunt insuficiente celule germinale. De obicei, înainte de pubertate, tubii seminiferi au numai celule Sertoli și spermatogonie (vezi Fig. 19-14, B). La pubertate, tubulii testelor hipoplazice suferă o scleroză progresivă neregulată și devin colagene, probabil din cauza degenerescenței concomitente. Celulele endocrine interstițiale par a fi mai numeroase și grupate.
Hipoplazia testiculelor nu este evidentă decât după pubertate. Hipoplazia unilaterală este mai frecventă decât hipoplazia bilaterală, dar această diferență de prevalență ar putea fi o reflectare a ușurinței relative de a recunoaște o diferență de mărime atunci când testiculul contralateral normal este disponibil pentru o comparație rapidă. Hipoplazia unilaterală este dificil de explicat, deoarece majoritatea cauzelor par să acționeze sistemic și, prin urmare, ar trebui să producă un efect bilateral.
Studiu de caz arheologic
Tim D. White,. Pieter A. Folkens, în Osteologie umană (ediția a treia), 2012
25.8 Stresul fiziologic
Hipoplaziile dentare sunt markeri nespecifici de oprire a creșterii la dinți care dau dovadă de periodicitatea și intensitatea stresului (capitolul 19). Două treimi din persoanele studiate au prezentat cel puțin o hipoplazie, concentrată la vârsta de 3-4 ani. În ansamblu, seria Stillwater a prezentat niveluri relativ scăzute de prevalență a hipoplaziei în comparație cu alte populații. Doar 16% dintre indivizi au prezentat inflamație periostală, cea mai mare parte a tibiei. Acest lucru a fost, de asemenea, scăzut în comparație cu majoritatea celorlalte serii de nutrețuri din America de Nord. Deși stresul nu a fost sever, a fost prezent la niveluri apreciabile. Anchetatorii propun că hipoplaziile înguste și datele privind masa osoasă sugerează că populațiile Stillwater au suferit de stres nutrițional episodic.
Sistemul hepatobiliar și pancreasul exocrin
Hipoplasie pancreatică
Hipoplazia pancreasului exocrin apare sporadic la viței. Țesutul pancreatic endocrin este normal. Gros, organul este mic, palid și poate să apară doar ca mici învelișuri de țesut alb-crem în mezenter. Microscopic, țesutul acinar este prezent, dar rar, organizat în grupuri mici de celule. Multe dintre celule sunt slab diferențiate și nu au granule de zimogen. Vițeii afectați au semne clinice de insuficiență pancreatică exocrină.
Distincția dintre atrofie și hipoplazie poate fi dificil de determinat, deoarece ambele procese conduc la un organ anormal de mic cu funcție diminuată. Celulele pancreasului exocrin hipoplazic nu conțin de obicei lipofuscină, care poate fi observată în celulele atrofice.
Tulburări neuromusculare neonatale
Niranjana Natarajan, Cristian Ioniță, în Avery's Diseases of the Newborn (Ediția a X-a), 2018
Hipoplasie pontocerebelară Plus Atrofie musculară spinală
Hipoplazia pontocerebeloasă (PCH) este un grup eterogen de tulburări moștenite care împărtășesc hipoplazia sau atrofia cerebelului și a ponsului. Alte anomalii ale SNC sunt frecvente. PCH tip 1 are, ca trăsături distinctive, slăbiciune musculară și hipotonie cauzate de o boală a neuronilor motori. Până în prezent, mutațiile din trei gene sunt identificate ca provocând PCH de tip 1: VRK1, EXOSC3 și EXOSC8 (Renbaum și colab., 2009; Wan și colab., 2012; Boczonadi și colab., 2014). Toate sunt moștenite într-un model autosomal recesiv. Deși severitatea și vârsta de debut variază, mulți dintre acești pacienți prezenți în perioada neonatală cu hipotonie, slăbiciune, contracturi și suferință respiratorie, precum și encefalopatie. Supraviețuirea variază de la câteva luni la câțiva ani. Managementul este de sprijin. Diagnosticul genetic este important pentru planificarea familială.
Pubertate
Hipoplasie suprarenală Congenita
AHC, caracterizată prin insuficiență suprarenală primară și HH, este o tulburare recesivă legată de X datorată mutațiilor DAX-1 (inversare sexuală sensibilă la dozare, regiune critică AHC a cromozomului X, gena 1, cunoscută și sub numele de NROB1 ) genă localizată la Xp21.1. În AHC, dezvoltarea zonei fetale a cortexului suprarenal în timpul dezvoltării fetale și regresia acesteia în primul an de viață postnatală apar în mod normal. Zona adultă a cortexului suprarenal, pe de altă parte, nu reușește să se dezvolte. Astfel, simptomele insuficienței suprarenale în AHC nu se manifestă în general decât după vârsta de 6 până la 8 săptămâni, iar bărbații afectați se pot prezenta în copilărie sau în copilărie cu insuficiență suprarenală primară. Poate să apară o suprarență întârziată.
În plus, poate apărea HH complet sau parțial. HH reflectă o combinație de secreție hipotalamică inconsistentă de GnRH și/sau o reacție anormală a hipofizei la GnRH. 595 HH izolat datorat mutațiilor NROB1 poate apărea rar în absența insuficienței suprarenale sau a unui istoric familial de hipogonadism. Femelele heterozigotice pot avea întârzierea pubertății, dar arată fertilitate normală. 595
Gena NROB1 codifică o proteină receptoră exprimată în hipotalamus, hipofiză, suprarenale și gonade. Deoarece niciun ligand nu a fost identificat până acum pentru receptor, acesta este clasificat ca receptor nuclear orfan. Prin domeniul său de reprimare transcripțională C-terminal, proteina tace transcrierea multor gene implicate în metabolismul hormonilor steroizi. Majoritatea mutațiilor detectate la pacienții cu cluster AHC din regiunea care codifică terminalul C al proteinei. 596 Mutațiile din această regiune a cromozomului X pot face parte dintr-un sindrom contigu de deleție a genei, care include deficit de glicerol kinază și distrofie musculară Duchenne.
Tulburări ale glandei suprarenale
Hipoplasie suprarenală Congenita
AHC, o afecțiune familială rară în care cortexul suprarenal a oprit dezvoltarea, apare la aproximativ 1 din 12.500 de nașteri (Jones și colab., 1995; Laverty și colab., 1973). Tulburarea se poate manifesta ca patru forme clinice de insuficiență suprarenală primară: (1) o formă sporadică asociată cu hipoplazie hipofizară; (2) o formă autosomală recesivă cu o morfologie suprarenală miniatură adultă distinctă, caracterizată prin glande mici cu o zonă corticală permanentă, dar cu o zonă fetală diminuată (baza genetică a formei recesive a AHC este necunoscută); (3) o formă citomegalică legată de X asociată cu hipogonadismul hipogonadotrop; și (4) o formă legată de X asociată cu deficit de glicerol kinază și distrofie musculară Duchenne (Bartley și colab, 1982). Mutațiile din DAX1 sunt responsabile pentru ambele forme legate de X.
- Agricultura insectelor - o prezentare generală Subiecte ScienceDirect
- MacConkey Agar - o prezentare generală a subiectelor ScienceDirect
- Maltodextrina - o prezentare generală a subiectelor ScienceDirect
- Lactobacillus - o prezentare generală Subiecte ScienceDirect
- Stomatita herpetică - o prezentare generală Subiecte ScienceDirect