Abstract
fundal
Acest studiu pilot a urmărit să investigheze dacă postul modificat pe termen scurt (mSTF) reduce incidența toxicităților induse de chimioterapie și dacă o dietă inițială ketogenică (KD) ca dietă de susținere a postului reduce disconfortul legat de post și îmbunătățește conformitatea.
Metode
În acest studiu controlat încrucișat, pacienții cu cancer ginecologic supuși chimioterapiei cu minimum 4 cicluri au postit 96 de ore în jumătate din ciclurile lor de chimioterapie și au consumat o dietă normocalorică în timpul celorlalte cicluri de chimioterapie. Aportul caloric în timpul mSTF a fost limitat la 25% din necesarul zilnic al fiecărui pacient. În plus, jumătate dintre pacienți ar trebui să mănânce un KD normocaloric de 6 zile înainte de fiecare perioadă mSTF pentru a investiga efectul de suprimare a foamei KD. La fiecare chimioterapie au fost evaluate toxicitățile induse de chimioterapie, disconfortul postului, compoziția corpului, calitatea vieții, valorile de laborator și conformitatea.
Rezultate
Treizeci de pacienți cu vârste cuprinse între 30 și 74 de ani (mediană de 54 de ani) au finalizat studiul. În timpul mSTF, frecvența și severitatea scorului stomatitei [- 0,16 ± 0,06; IC 95% -0,28 - (- 0,03); P = 0,013], dureri de cap [- 1,80 ± 0,55; IC 95% -2,89 - (- 0,71); P = 0,002], slăbiciune [- 1,99 ± 0,87; IC 95% -3,72 - (- 0,26); P = 0,024] și scorul total al toxicităților a fost semnificativ redus [- 10,36 ± 4,44; IC 95% -19,22 - (- 1,50); P = 0,023]. De asemenea, am observat semnificativ mai puține amânări de chimioterapie după mSTF, reflectând o toleranță îmbunătățită la chimioterapie [- 0,80 ± 0,37; IC 95% -1,53 - (- 0,06); P = 0,034]. O reducere semnificativă a greutății corporale medii cu - 0,79 ± 1,47 kg în timpul mSTF nu a fost compensată și a rămas până la încheierea studiului (P
fundal
Perioadele de post intenționat sunt practicate la nivel mondial, de obicei din motive tradiționale, culturale sau religioase. Postul este definit ca încetarea parțială sau totală a consumului de alimente pentru o anumită perioadă. Există numeroase dovezi empirice și observaționale că postul modificat supravegheat din punct de vedere medical care durează una până la 3 săptămâni este eficient în tratamentul mai multor boli cronice și acute, de exemplu, reumatism, hipertensiune și sindrom metabolic [1]. Experimente recente pe animale au arătat că postul pe termen scurt (STF) înainte de chimioterapia cu doze mari scade dramatic toxicitățile induse de chimioterapie, fără a slăbi efectul terapeutic [2]. Toxicitățile acute induse de chimioterapie pot declanșa întreruperea prematură și reducerea dozelor în chimioterapie și ambii sunt factori de risc pentru un rezultat terapeutic mai slab. Terapiile nutriționale metabolice adjuvante în timpul tratamentului cancerului, cum ar fi STF sau o dietă ketogenică (KD), au fost recent discutate și promovate în ziarele majore, în programe de televiziune și online, făcându-l un subiect popular.
În 2012, Safdie și colab. [3] a demonstrat că postul de 48 de ore a sensibilizat celulele murino, șobolan și gliom uman, dar nu celulele glia primare mixte, la chimioterapie. În același an, Lee și colab. [4] a demonstrat că tratamentul în condiții de post a sensibilizat 15 din 17 linii celulare de cancer la mamifere la agenți chimioterapeutici și a fost la fel de eficient ca agenții chimioterapeutici în întârzierea progresiei diferitelor tumori. La modelele de șoareci cu neuroblastom, ciclurile de post plus medicamentele pentru chimioterapie - dar nu și singurul tratament - au condus la supraviețuirea pe termen lung fără cancer [3]. Un articol recent de Brandhorst și colab. [2] a descris rezistența la stres la șoarecii hrăniți fie cu o dietă standard ad libitum, fie cu restricție alimentară definită de macronutrienți timp de 3 zile sau 60 de ore de post înainte de tratamentul cu doxorubicină în doză mare. Spre deosebire de șoarecii hrăniți ad libitum, marea majoritate a șoarecilor cu post (60 de ore) au supraviețuit până în ziua 25 după chimioterapie (16% față de 89%) și nu au prezentat semne vizibile de stres sau durere, cum ar fi mobilitatea redusă, părul zburlit, și postura încovoiată. Raffaghello și colab. [5] au arătat rezultate similare, și anume că postul de 48-60 de ore înainte de tratamentul cu etopozidă a sporit rezistența la șoareci.
Postul induce modificări pe scară largă în căile metabolice și procesele celulare, inclusiv scăderea factorului de creștere insulinic-1 (IGF-1) și a glucozei. Acest lucru afectează diferite oncogene, inclusiv RAS și calea de semnalizare AKT, și duce la reglarea descendentă a proliferării și creșterii celulare [6]. Experimentele de cultură celulară au arătat că celulele sănătoase sunt protejate de tratamentul toxicității, în timp ce celulele tumorale devin mai vulnerabile la chimioterapie în timpul postului pe termen scurt. Acest fenomen este descris ca rezistență diferențială la stres. Celulele normale intră într-o stare alternativă caracterizată prin reducerea sau lipsa diviziunii celulare și rezistență la tensiuni multiple, reglarea în sus a reparării ADN-ului și autofagia indusă. Celulele tumorale sunt incapabile să activeze un răspuns protector, iar căile de creștere rămân persistente supraactivate. Celulele tumorale sunt astfel mai sensibile la chimioterapie [4,5,6,7].
Michalsen și colab. [12] a demonstrat într-un studiu non-randomizat cu 209 pacienți care sufereau de dureri cronice, că STF nu are efecte secundare grave. Plângerile tipice raportate în perioada inițială de post la un nivel care nu a interferat cu activitățile zilnice includ foamea, oboseala, iritabilitate, cefalee și amețeală [8, 12, 13]. Disconfortul legat de post a apărut în special în zilele de post 2 și 3, când metabolismul trece la cetoza fiziologică [13]. Postul duce la adaptări neuroendocrine puternice care seamănă cu răspunsurile metabolice la o KD [14]. KD implică aportul unui regim bogat în grăsimi, proteine adecvate și foarte scăzut în carbohidrați (
Metode
Populația de studiu
Am recrutat femei adulte cu primul diagnostic sau prima recurență a cancerelor ginecologice confirmate histologic în toate etapele și supuse chimioterapiei neoadjuvante sau adjuvante cu un minim de 4 cicluri din același protocol de chimioterapie la un interval de 3 până la 4 săptămâni administrat în decurs de 24 de ore. Criteriile noastre de excludere au fost: o stare actuală de malnutriție (screening-ul riscului nutrițional> 3, scădere în greutate> 5% în ultimele 3 luni, indicele de masă corporală 2), tulburări de alimentație, diabet zaharat supus terapiei medicamentoase, gută, boli cardiovasculare severe, sarcină sau alăptarea, nutriția parenterală, administrarea de steroizi sau blocanți ai receptorilor IGF-1. Pacienții au fost înscriși în perioada martie 2017 - decembrie 2017 la Departamentul de ginecologie și oncologie ginecologică de la Centrul Medical al Universității din Freiburg de angajații Departamentului de Medicină Nutritivă și Dietetică. Toți participanții la studiu și-au dat consimțământul scris în cunoștință de cauză. Protocolul de studiu a fost revizuit și aprobat de Comitetul de Etică al Universității Albert-Ludwig din Freiburg (313/16), iar studiul a fost înregistrat la germanctr.de sub numele de DRKS00011610.
Proiectarea și intervenția studiului
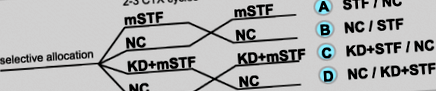
Proiectarea studiului încrucișat pentru a testa efectul postului modificat pe termen scurt (mSTF) în timpul a 2 sau 3 cicluri de chimioterapie (CTX) în funcție de regimul CTX privind toxicitățile induse de CTX comparativ cu o dietă normocalorică (NC) în timpul a 2 sau 3 cicluri de CTX ca control și pentru a testa efectul unei diete ketogenice normocalorice (KD) urmată de mSTF asupra disconfortului constatat în post comparativ cu mSTF singur
În timp ce pacienții din loturile de studiu A și B au primit doar un mSTF, pacienții din grupele de studiu C și D au obținut suplimentar o KD normocalorică de 6 zile înainte de fiecare perioadă de mSTF. Atât K, cât și cel normocaloric duc la modificări metabolice similare [21], inclusiv o stare de cetoză care poate suprima foamea [16,17,18]. În consecință, metabolismul în repaus alimentar a fost indus printr-o KD înainte de fiecare perioadă de 4 zile mSTF. Pacienții din grupele de studiu C și D au primit sfaturi și rețete pentru a urma un KD ad libitum în funcție de propriile preferințe alimentare. Pacienții au fost încurajați să-și limiteze aportul de carbohidrați la maximum 20-40 g/zi și să obțină cel puțin 75% din energia totală consumată din grăsimi. Conținutul de macronutrienți în timpul KD a fost același ca și în perioada mSTF, cu excepția conținutului de energie.
Evaluarea rezultatelor
Măsurile noastre de siguranță s-au bazat pe recomandările publicate în 2013 de actualizarea grupului de experți a Ghidurilor de consens pentru 2002 pentru terapia de repaus alimentar [26]; acestea includ valori de laborator ale electroliților (sodiu, potasiu, calciu, magneziu), renale (creatinină, azot ureic, acid uric) și funcții hepatice (bilirubină, alanină aminotransferază [ALT], aspartat aminotransferază [AST], fosfatază alcalină [ALP ] și gamma-glutamiltransferază [GGT]). Pentru a documenta conformitatea cu regimul mSTF și a verifica dacă grupul de control nu a postit, pacienții au fost obligați să înregistreze consumul zilnic de alimente și să-și monitorizeze starea de cetoză prin documentarea măsurilor zilnice ale cetonelor urinare prin benzi de auto-testare (Ketostix®, Bayer AG, Elveția) în timpul fiecărui ciclu de post. Nivelurile de cetonă din sânge au fost, de asemenea, verificate la fiecare chimioterapie printr-un dispozitiv de testare numit FreeStyle Precision Neo Glucose din sânge și sistem de monitorizare a cetonelor cu benzi de testare β-cetonă din sânge (Abbott GmbH & Co. KG, Germania). Înregistrările semicantitative ale alimentelor au fost analizate prin software profesional (PRODI®expert v6.5, Nuri-Science GmbH, Germania). La vizita de urmărire, a fost distribuit un chestionar special dezvoltat pentru a evalua sentimentele subiective ale pacienților și fezabilitatea acestui studiu pilot.
Calculul mărimii eșantionului și statistici
Deoarece acesta este un test pilot, nu s-a putut face un calcul precis al mărimii eșantionului. Cu toate acestea, următoarele considerații cu privire la utilitatea sa pot justifica alegerea a 40 de pacienți într-un design încrucișat cu 2 grupuri (NC vs. mSTF sau mSTF + KD) și un rezultat binar: probabilitatea evenimentelor adverse gradul III sau mai mare. Presupunem o probabilitate pentru evenimente adverse de gradul 3 sau mai mari de 0,60 (sursa de date: GOIM 9902 studiu [27]) cu NC și de 0,30 cu post, adică o diferență în proporții de 0,30. Mai mult, presupunem că proporția pacienților cu rezultate diferite între NC și mSTF sau mSTF + KD ar fi de 0,40 (perechi discordante). O dimensiune a eșantionului de 30 de perechi ar avea o putere de 80% pentru a detecta o diferență în proporțiile de 0,30 atunci când proporția de perechi discordante este de așteptat să fie 0,40 și metoda de analiză este un test McNemar de egalitate a proporțiilor împerecheate cu o 0,05 față-verso nivel de semnificație. Luând în considerare posibilitatea abandonului, am avea nevoie de 40 de pacienți pentru a asigura o putere suficientă.
Toate variabilele au fost testate pentru distribuție normală (testul Kolmogorow-Smirnow). Variabilele distribuite în mod normal sunt prezentate ca medie ± deviație standard și comparate folosind două eșantioane t-test pentru diferențele dintre grupurile de intervenție sau asociate t-teste pentru diferențele dintre valoarea inițială (T0) și urmărirea (FU). Variabilele care nu sunt distribuite în mod normal sunt afișate ca mediană (minim - maxim). Testul Mann-Whitney a fost utilizat pentru grupurile independente, iar testul Wilcoxon cu sumă de rang pentru grupurile asociate.
Obiectivul nostru principal a fost să evaluăm influența postului modificat pe termen scurt (mSTF) asupra toxicităților induse de chimioterapie pe baza probabilității evenimentelor adverse de gradul III și mai mare. În mod neașteptat, am observat doar o incidență foarte scăzută a CTCAE grad ≥ III în timpul perioadei de studiu, astfel am decis să analizăm probabilitatea toxicităților gradul I sau II ca variabilă binară. În plus, am analizat probabilitatea evenimentelor adverse raportate de sine ca o variabilă continuă pe baza unui sistem de punctare a punctelor. Variabilele măsurate în mai multe momente în timp (toxicități induse de chimioterapie, compoziția corpului, chestionare validate, parametri de siguranță și conformitate) au fost analizate ca rezultate cu un model mixt liniar adecvat pentru proiectarea încrucișată, unde tratamentul (NC vs. post), perioada și secvența au fost tratate ca efecte fixe, iar pacienții sunt considerați ca efecte aleatorii. De asemenea, am ajustat analiza pentru atribuirea grupului și agenții chimioterapeutici. Rezultatele sunt prezentate ca estimări ale parametrilor (PE), erori standard (SD) și intervale de încredere de 95%. PE reprezintă diferența pentru fiecare variabilă între ciclurile NC și cele ale mSTF. Numărul de cicluri de chimioterapie au fost modelate ca o variabilă continuă. Semnificația statistică a fost stabilită la P
Rezultate
Caracteristicile pacientului
Diagrama de flux a participanților la studiu de la screening-ul criteriilor de eligibilitate până la finalizarea studiului
Compoziții de conformitate și dietă
Cetoza fiziologică a sângelui (cetonă din sânge ≥ 0,6 mmol/l) a fost detectată în 71,4% (n = 40) din cele 56 de cicluri de chimioterapie. Starea cetozei a diferit semnificativ între mSTF și NC (mSTF 1,27 ± 1,18 mmol/l, NC 0,21 ± 1,98 mmol/l; P Tabelul 2 Toxicități legate de chimioterapie conform CTCAE (gradul I/II) comparând ciclurile de mSTF (n = 56) cu ciclurile de NCn = 62)
În plus față de incidența efectelor secundare documentate CTCAE de către medici, pacienții au raportat efectele secundare induse de chimioterapie în săptămâna următoare chimioterapiei (Tabelul 3). Pe lângă frecvența mai mică și scorurile de severitate ale durerilor de cap auto-raportate [- 1,80 ± 0,55; IC 95% -2,89 - (- 0,71); P = 0,002], scorul de frecvență și severitate al sentimentului de auto-raportat slab a scăzut semnificativ în timpul ciclurilor mSTF comparativ cu cele ale NC [- 1,99 ± 0,87; IC 95% -3,72 - (- 0,26); P = 0,024]. Mai mult, scorul de frecvență și severitate al toxicităților totale auto-raportate a fost redus semnificativ în timpul ciclurilor mSTF comparativ cu ciclurile NC [- 10,36 ± 4,44; IC 95% -19,22 - (- 1,50); P = 0,023]. Nu am detectat diferențe semnificative în incidența și severitatea evenimentelor adverse între mSTF singur sau în combinație cu o KD anterioară, fie în CTCAE documentate, fie în toxicitățile auto-raportate induse de chimioterapie.
În ciuda faptului că mSTF a fost sigur, pacienții au raportat efecte secundare de nivel scăzut legate de post. În general, cele mai frecvente efecte secundare raportate legate de post au inclus foamea (n = 8), amețealăn = 5), slăbiciunen = 4) și dureri de capn = 4).
Din păcate, toxicitățile induse de chimioterapie determină frecvent pacienții să amâne chimioterapia, un factor de stres suplimentar și extrem de împovărător pentru pacienți. Am comparat numărul de zile de amânări în timpul ciclurilor mSTF cu cele ale NC. Pacienții au prezentat semnificativ mai puține amânări de chimioterapie în timpul ciclurilor mSTF [- 0,80 ± 0,37; IC 95% -1,53 - (- 0,06); P = 0,034], reflectând o toleranță mai bună la chimioterapie.
Greutatea și compoziția corpului
Comparând ciclurile mSTF cu ciclurile NC, am observat o pierdere semnificativă a masei medii de grăsime BIA [- 0,63 ± 0,23; IC 95% -1,09 - (- 0,17); P = 0,008], ducând la pierderea semnificativă în greutate în timpul mSTF [- 0,84 ± 0,26; IC 95% -1,35 - (- 0,33); P = 0,002]. În afară de masa grasă BIA, compoziția corpului a rămas în medie constantă. Spre deosebire de măsurile noastre inițiale, greutatea corporală și masa de grăsime pierdute în timpul mSTF nu au fost contrabalansate și au rămas semnificativ reduse la sfârșitul studiului (P Tabelul 4 Parametrii sanguini ai ciclurilor de chimioterapie cu post pe termen scurt sau dieta normocalorică comparând ciclurile de mSTF (n = 56) cu cicluri de NCn = 62)
Deși nivelul mediu de sodiu din sânge a fost semnificativ mai scăzut în timpul ciclurilor mSTF decât în timpul ciclurilor NC [- 1,17 ± 0,42; IC 95% -2,0 - (- 0,33); P = 0,007], nivelurile medii de sodiu au rămas în intervalul de referință. Toți ceilalți electroliți au rămas neschimbați pe tot parcursul intervenției. Monitorizând funcția renală, am identificat niveluri semnificative de acid uric semnificativ crescute, depășind valoarea de referință, în timpul mSTF [1,35 ± 0,17; IC 95% 1,01-1,68; P
Discuţie
Obiectivul principal al acestui studiu clinic a fost de a evalua efectele unui mSTF de 4 zile cu o compoziție ketogenică de macronutrienți asupra toxicităților induse de chimioterapie CTCAE gradul III și mai mare la pacienții cu cancer ginecologic. Obiectivele secundare au fost evaluarea toxicităților CTCAE I/II, toxicitățile auto-raportate, compoziția corpului, parametrii sângelui și bunăstarea subiectivă (QoL, CIPN și oboseală). Acesta este primul studiu clinic care explorează efectele unui KD normocaloric de 6 zile înainte de mSTF ca dietă de susținere a postului asupra disconfortului și a conformității legate de post.
În conformitate cu studiile anterioare de post la adulți sănătoși, am observat o scădere ușoară în greutate (
Concluzie
Pe scurt, rezultatele noastre arată că mSTF este sigur și fezabil pentru pacienții cu cancer ginecologic, cu toate acestea, această intervenție necesită o motivație ridicată. Mai mult, mSTF în timpul chimioterapiei are potențialul de a reduce toxicitățile induse de chimioterapie și de a îmbunătăți toleranța chimioterapiei. Diferiti parametri sanguini si parametri metabolici, in special IGF-1 si insulina, au fost influentati pozitiv de mSTF. Un KD normocaloric de 6 zile înainte de mSTF nu a evidențiat efecte benefice nici asupra toxicităților induse de chimioterapie, nici a disconfortului și a complianței legate de post. În mod clar, este nevoie de studii controlate randomizate mai mari, axate pe confirmarea eficacității chimioterapiei însoțitoare de mSTF ca o abordare inovatoare și de susținere.
Disponibilitatea datelor și a materialelor
Seturile de date generate și analizate în timpul studiului sunt disponibile de la autorul relevant, la cerere rezonabilă.
- Raport privind impactul nutriției umane, dietei și sănătății 2017 - Alabama Cooperative Extension System
- Strategiile de sincronizare a meselor vă pot ajuta să pierdeți în greutate Sfaturi de dietă intermitentă de post - NDTV Food
- Planuri de dietă sănătoasă care funcționează cel mai bine pentru postul intermitent
- Pentru cât este suficient postul; Dieta de post; să lucreze Știrile sănătății consumatorilor HealthDay
- Dieta Jennifer Aniston Iată cum urmează fostul lui Brad Pitt postirea intermitentă - Micky News