Abstract
fundal
Cașexia cancerului este un sindrom metabolic progresiv și multifactorial caracterizat prin pierderea țesutului adipos și a mușchiului scheletic. Se propune lipoliza țesutului adipos alb (WAT) și transdiferențierea alb-maronie a WAT (rumenirea WAT) pentru a contribui la atrofia WAT în cașexia cancerului. S-a raportat că inflamația cronică, mediată de citokine, cum ar fi factorul de necroză tumorală alfa (TNF-α) și interleukina-6 (IL-6), promovează cașexia cancerului. Cu toate acestea, rămâne neclar dacă inflamația cronică promovează cașexia cancerului prin reglarea metabolismului WAT și a mecanismului de bază.
Metode
În acest studiu, am analizat mai întâi asocierea dintre inflamația cronică și metabolismul WAT la pacienții cahectici cu cancer gastric și colorectal. La șoarecii cahectici tratați cu anticorp anti-receptor IL-6, am clarificat dacă lipoliza WAT și rumenirea au fost reglementate de IL-6.
Rezultate
Analizele clinice au arătat o asociere pozitivă semnificativă între IL-6 seric și acidul gras liber (FFA) atât în cașexia cancerului în stadiu incipient, cât și în stadiu târziu. Cu toate acestea, TNF-α seric a fost asociat pozitiv cu FFA seric în cașexia în stadiu incipient, dar nu în stadiu târziu. Lipoliza WAT a fost crescută în cașexia în stadiu timpuriu și târziu, în timp ce rumenirea WAT a fost detectată numai în cașexia în stadiu târziu. Anticorpul anti-receptor IL-6 a inhibat lipoliza WAT și rumenirea la șoarecii cahectici.
Concluzii
Pe baza acestor constatări, concluzionăm că inflamația cronică (în special cea mediată de IL-6) ar putea promova cașexia cancerului prin reglarea lipolizei WAT în cașexia în stadiu incipient și rumenirea în cașexia în stadiu târziu.
fundal
Cașexia cancerului este un sindrom de irosire definit de pierderea continuă a mușchilor scheletici și a masei grase care nu poate fi complet inversată prin sprijinul nutrițional convențional [1]. Cașexia cancerului apare la aproximativ 80% dintre pacienții cu cancer și este principala cauză de deces la 22-30% dintre toți pacienții cu cancer [2, 3]. Cașexia cancerului reduce semnificativ toleranța la terapia antineoplazică și scade calitatea vieții [4, 5]. Cu toate acestea, pacienții cu cancer nu sunt diagnosticați de obicei cu cașexie până când nu au pierdut mai mult de 5-7% din masa corporală din cauza lipsei unor markeri eficienți de detectare timpurie [6]. Prin urmare, există o nevoie urgentă de a înțelege mecanismele care stau la baza cașexiei cancerului pentru a informa dezvoltarea de noi ținte diagnostice și terapeutice.
Deși pierderea mușchilor este semnul distinctiv al cașexiei cancerului, factorul de bază catabolic al cașexiei cancerului cuprinde mai mult decât simpla descompunere proteolitică a proteinelor musculare contractile. Epuizarea țesutului adipos contribuie, de asemenea, la impactul devastator al cașexiei cancerului [7]. S-a raportat că pierderea țesutului adipos este asociată cu o calitate a vieții redusă și o supraviețuire mai scurtă, independent de indicele de masă corporală (IMC), la pacienții cu cancer avansat [8, 9]. Creșterea lipolizei și a oxidării grăsimilor, scăderea lipogenezei, afectarea depunerii lipidelor și a adipogenezei, precum și rumenirea țesutului adipos alb (WAT) pot sta la baza atrofiei adipoase în cașexia cancerului [10].
Inflamația cronică mediată de interleukina-6 (IL-6) și factorul de necroză tumorală alfa (TNF-α) a fost investigată pe scară largă ca un important regulator al irosirii grăsimilor în cașexia cancerului [3, 10]. Cu toate acestea, relația dintre citokinele inflamatorii și lipoliza WAT și rumenirea la pacienții cu cahectică a fost, de asemenea, rar raportată. Rămâne însă neclar dacă citokinele inflamatorii contribuie la epuizarea adiposului în cașexia cancerului prin accelerarea lipolizei WAT și a rumenirii.
În studiul de față, am detectat lipoliza și rumenirea WAT în WAT subcutanat la pacienții cahectici cu cancer gastric și colorectal. Relația dintre citokinele inflamatorii și lipoliza WAT și rumenire au fost, de asemenea, analizate la pacienții cu cahectică. Efectul IL-6 asupra lipolizei și rumenirii WAT a fost analizat la șoareci cahectici.
Metode
Pacienți și colectarea probelor
WAT subcutanat au fost colectate în timpul intervenției chirurgicale de la pacienții cu cancer gastric și colorectal la Spitalul Zhongshan al Universității Fudan în perioada 1 ianuarie 2014 - 31 decembrie 2016. Diagnosticele bolii maligne au fost confirmate prin examinări patologice postoperatorii. Criteriile de excludere au fost după cum urmează: 1) pacientul în vârstă de 10% în ultimele 6 luni.
WAT-urile subcutanate au fost tăiate în jumătăți și o bucată a fost imediat înghețată în azot lichid și depozitată la -80 ° C până la o analiză ulterioară, în timp ce cealaltă jumătate a fost fixată în formalină 10% și încorporată în parafină. Probele de sânge ale tuturor pacienților au fost colectate înainte de operație și imediat centrifugate la 3000 rpm timp de 15 minute la 4 ° C. Probele de ser au fost conservate la -80 ° C pentru analize suplimentare. S-au înregistrat caracteristicile clinice ale fiecărui pacient înainte de operație, inclusiv vârsta, sexul și IMC.
Model experimental și tratamente de cașexie
Șoarecii masculi BALB/c (6-8 săptămâni) cu o greutate de 16-20 g au fost achiziționați de la Shanghai Laboratory Animal Center, Academia Chineză de Științe. Șoarecii au fost adăpostiți la 22 ± 1 ° C cu un ciclu de lumină/întuneric de 12 ore și au avut acces gratuit la apă și la dieta convențională. Șoarecii au fost aclimatizați la mediu timp de 1 săptămână înainte de începerea studiului. Toate manipulările animalelor au fost efectuate în conformitate cu liniile directoare și reglementările privind utilizarea animalelor experimentale de către Academia Chineză de Științe. S-au făcut toate eforturile pentru a reduce la minimum suferința animalelor și pentru a utiliza doar numărul de animale necesar pentru a produce date științifice fiabile.
Celulele 26 din colon/clonă 20, despre care s-a raportat că induc cașexie severă la șoareci BALB/c prin inoculare subcutanată, au fost cultivate în mediu Roswell Park Memorial Institute (RPMI) -1640 suplimentat cu 5% ser fetal bovin și 1% penicilină-streptomicină la 37 ° C și 5% CO2. Șoarecii au fost repartizați aleatoriu în trei grupuri experimentale: grupul de control, grupul purtător de tumori Colon 26 și grupul purtător de tumori tratat cu anticorpi anti-receptor IL-6 (eBiosciences, CA, SUA). În ziua de studiu 0, 1,0 × 106 celule suspendate în 100 μl soluție salină tamponată cu fosfat (PBS) au fost injectate subcutanat în axila dreaptă a șoarecilor din grupul tratat cu anticorpi purtători de tumori și anti-IL-6. Un volum egal de PBS fără celule tumorale a fost injectat în grupul de control. În grupul tratat cu anticorp anti-receptor IL-6, fiecare șoarece a primit o injecție intraperitoneală de 10 μg anticorp monoclonal al receptorului anti-IL-6 diluat în 200 μl soluție salină normală la fiecare 2 zile. Grupurile martor și purtătoare de tumori au primit 200 μl PBS. În ziua 16, șoarecii au fost sacrificați prin dislocare cervicală. Au fost colectate și cântărite WAT subcutanat inghinal și epididimal, BAT interscapulară și mușchiul gastrocnemius. Probele au fost tăiate în jumătăți, prelucrate și depozitate așa cum s-a efectuat cu probe WAT umane.
Imunohistochimie și analiză morfologică
WAT-urile subcutanate umane și de șoarece încorporate în parafină au fost tăiate în secțiuni de 5 μm. Imunomarcarea UCP1 a tuturor țesuturilor a fost efectuată așa cum s-a descris anterior [19]. Pe scurt, lamelele au fost deshidratate în alcooli clasificați și xilen. Recuperarea antigenului a fost efectuată cu tampon citrat 0,01 M la 95 ° C timp de 20 min la pH 6,0. Diapozitivele au fost incubate cu anticorpi primari diluați (anti-UCP1, diluții 1: 100) timp de 12 ore. Diapozitivele au fost apoi incubate cu anticorp secundar biotinilat timp de 1 oră, streptavidină marcată cu peroxidază timp de 15 min și diaminobenzidină și peroxid de hidrogen substrat cromogen plus amplificator de diaminobenzidină timp de 10 min, urmată de contracolorare cu hematoxilină Mayer. Imaginile au fost obținute cu un obiectiv obiectiv × 40. Dimensiunile adipocitelor WAT au fost urmărite și cuantificate manual cu ajutorul software-ului ImageJ.
Analiza PCR în timp real
ARN-ul total a fost izolat din WAT subcutanat uman și de șoarece folosind reactiv TRIzol (Invitrogen, CA, SUA) conform recomandărilor producătorului. Concentrațiile de ARN au fost cuantificate prin spectrofotometru NanoDrop 2000 și integritatea a fost determinată prin electroforeză pe gel. ADN-ul complementar a fost sintetizat dintr-un ARN total de 1 μg folosind kitul de sinteză ADNc (Takara, Dalian, Japonia) urmând protocoalele producătorului. Analiza expresiei genei a fost efectuată folosind mixul master PrimeScript RT (Takara, Dalian, Japonia) în sistemul StepOnePlus în timp real (Applied Biosystems, CA, SUA). Nivelurile relative de expresie genică au fost calculate folosind 2 -∆∆Ct și comparate cu 18sRNA ca control intern. Exemplele utilizate sunt prezentate în Tabelul 1.
Determinări serice
Concentrațiile serice umane de albumină, trigliceride și acizi grași liberi (FFA) au fost determinate în departamentul de laborator al Spitalului Zhongshan al Universității Fudan folosind truse enzimatice comerciale. Concentrațiile serice de IL-6 și TNF-α au fost evaluate folosind kitul de testare imunosorbentă legată de enzimă IL-6 și TNF-α (ELISA) conform protocoalelor producătorului.
Analiza Western blot
Pregătirea lizatelor proteice totale și analiza Western blot au fost efectuate așa cum s-a descris anterior [19]. Au fost utilizați anticorpi primari (diluție 1: 1000) împotriva Cgi58 și Tbx1 (Abcam, UK). Expresia tubulinei a fost utilizată ca control endogen.
Analize statistice
Rezultatele sunt exprimate ca medie ± eroare standard a mediei (de exemplu). Nivelurile de ARNm ale genelor relevante au fost comparate între grupuri cu cele cu două cozi ale lui Student t Test. Corelațiile FFA serice cu IL-6 și TNF-α în cașexia în stadiu incipient și târziu au fost analizate folosind teste de corelare a rangului Spearman. Toate analizele statistice au fost efectuate folosind GraphPad Prism 5.0. Semnificația statistică a fost definită ca P
Rezultate
Caracteristicile clinice ale pacienților și asocierea dintre citokinele inflamatorii și lipoliza WAT
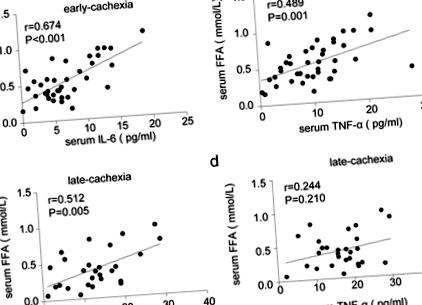
În primul rând, am comparat caracteristicile clinice ale diferitelor grupuri de pacienți din studiu. Așa cum se arată în Tabelul 2, concentrațiile serice ale IL-6 au fost mai mari la pacienții cu cașexie în stadiu târziu decât cei fără cașexie și cașexie în stadiu incipient. Interesant este că concentrația serică de TNF-α a crescut numai în cașexia în stadiu târziu. Mai mult, albumina serică și IMC au fost semnificativ reduse la pacienții cu stadiul tardiv cachectic. Deși nu au existat diferențe în trigliceridele serice între cele trei grupuri, concentrația serică a FFA a fost semnificativ crescută la pacienții cu cahectică, în special în cașexia în stadiu incipient. Analizele de corelație au arătat o asociere semnificativ pozitivă între IL-6 seric și FFA atât în cașexia în stadiu incipient, cât și în etapa tardivă (Fig. 1). Cu toate acestea, TNF-α seric a fost asociat pozitiv doar cu FFA serică în cașexia în stadiu timpuriu, dar nu tardiv (Fig. 1).
Asocierea dintre citokinele inflamatorii serice și lipoliza WAT la pacienții cahectici. A Analiza de corelație între IL-6 seric și FFA în cașexia în stadiu incipient (n = 40). b Analiza corelației între TNF-α și FFA serice în cașexia în stadiu incipient (n = 40). c Analiza corelației dintre IL-6 seric și FFA în cașexia în stadiu târziu (n = 28). d Analize de corelație între TNF-α și FFA serice în cașexia în stadiu târziu (n = 28)
Lipoliza WAT a crescut atât în cașexia în stadiu incipient, cât și în cea tardivă, în timp ce rumenirea WAT a fost detectată numai în cașexia în stadiu târziu
Pentru a determina dacă WAT subcutanat uman suferă lipoliză și rumenire, am investigat morfologia WAT și expresia UCP1 în WAT subcutanat a diferitelor grupuri de pacienți. A existat atrofie evidentă a WAT la cachectic în comparație cu pacienții non-cachectici (Fig. 2a). Cu toate acestea, nu a fost detectată nicio diferență semnificativă în dimensiunile adipocitelor între cașexia cancerului în stadiu incipient și în stadiul târziu (Fig. 2b). Interesant este faptul că genele asociate lipolizei WAT (Atgl, Cgi58, și Hsl) au fost reglate în sus în cașexia timpurie, dar nu în stadiul târziu (Fig. 2c).
Pentru a determina dacă rumenirea WAT a apărut la pacienții cu cahectică, am găsit mARN-ul UCP1 suprareglementat la pacienții cu cașexie în stadiu târziu, comparativ cu celelalte două grupuri (Fig. 2c). Imunohistochimia a confirmat, de asemenea, expresia ridicată a proteinei UCP1 în cașexia cancerului în stadiu târziu (Fig. 2a). De asemenea, am detectat „celule bej” clasice, care au fost caracterizate ca fiind UCP1-pozitive și morfologic prin depuneri de lipide multiloculare, la 6 din 28 de pacienți cu cahectică în stadiu târziu. Pentru a confirma apariția rumenirii WAT, am examinat mai mulți markeri stabiliți asociați cu grăsimea maro și bej în WAT subcutanat. Interesant, genele bej asociate grăsimii (Tmem26 și Tbx1), dar nu genele asociate grăsimii brune (Eva1 și Pdk4) au fost supra-reglementate la pacienții cu cașexie în stadiu târziu (Fig. 2a).
În plus, am constatat o creștere semnificativă a concentrațiilor serice de IL-6 și TNF-α la 6 pacienți cu, comparativ cu 22 de pacienți fără celule grase bej (date neprezentate), indicând că IL-6 și TNF-α ar putea fi asociate cu rumenirea WAT.
Anticorpul anti-receptor IL-6 a inhibat lipoliza WAT și rumenirea la șoarecii cahectici
Discuţie
O caracteristică cheie a cașexiei cancerului este pierderea WAT din cauza lipolizei crescute a adipocitelor și a altor mecanisme. Având în vedere că FFA serică provine în principal din lipoliza WAT, am examinat mai întâi modificările FFA serice la pacienții cahectici. Interesant este faptul că nivelurile serice de FFA au fost mai mari în cașexia precoce decât în stadiul târziu, indicând faptul că lipoliza WAT ar putea fi mecanismul dominant în cașexia cancerului în stadiu incipient.
În ciuda lipolizei WAT crescute, rumenirea WAT a fost propusă ca un alt factor care contribuie la atrofia WAT în timpul cașexiei cancerului [10]. În acest studiu, raportăm pentru prima dată apariția rumenirii WAT în cașexia cancerului în stadiu târziu, dar nu în stadiu incipient, la oameni. Rezultatele sugerează că rumenirea WAT ar putea fi un fenomen terminal care accelerează atrofia WAT în cașexia cancerului în stadiu târziu.
Este bine stabilit că există o legătură între cașexie și inflamația sistemică. Cu toate acestea, mecanismele și efectele acestui răspuns inflamator nu sunt clare. Citokinele pro-inflamatorii (de exemplu, TNF-α și IL-6) produse de tumoare sau de țesutul gazdă datorită prezenței tumorii duc atât la inflamația sistemică, cât și la cea locală în cancer [20, 21]. Cu toate acestea, datele despre inflamația țesutului adipos local în cancer sunt inconsistente, fiind raportate fie crescute, fie neschimbate [22, 23]. Există, de asemenea, rezultate contradictorii cu privire la creșterea nivelului de TNF-α la pacienții cu cancer cu pierderea în greutate [3]. Un studiu cu anticorpi anti-TNF-α la pacienții cu cașexie canceroasă nu a arătat niciun beneficiu [24]. În studiul nostru, TNF-α seric a crescut odată cu scăderea greutății corporale. Cu toate acestea, TNF-α seric a fost asociat pozitiv cu FFA seric în cașexia cancerului în stadiu incipient, dar nu în stadiu târziu, ceea ce sugerează că TNF-α poate accelera lipoliza WAT în cașexia în stadiu incipient, cu efect redus în cașexia în stadiu târziu.
Spre deosebire de TNF-α, nivelurile circulante de IL-6 s-au dovedit a fi corelate cu pierderea în greutate la pacienții cu cancer și, important, nivelurile de IL-6 corelate cu supraviețuirea redusă [3]. De asemenea, am găsit o asociere pozitivă între IL-6 seric și FFA atât în cașexia în stadiu incipient, cât și în cea târzie, sugerând că IL-6 ar putea induce pierderea în greutate în cașexia cancerului prin accelerarea lipolizei WAT. Cu toate acestea, studiile unui anticorp monoclonal anti-IL-6 la pacienții cu cancer pulmonar care scad în greutate nu au arătat niciun efect semnificativ asupra pierderii masei corporale slabe [25]. Prin urmare, dacă efectul pierderii în greutate induse de IL-6 în cașexia cancerului este în principal prin WAT, dar nu și pierderea musculară, trebuie studiat în continuare.
Mai multe studii au raportat apariția rumenirii WAT la modelele șoarecilor de cașexie canceroasă [18, 26]. Cu toate acestea, rămâne neclar dacă rumenirea WAT apare la pacienții cu cancer gastric și colorectal cahectic. În acest studiu, am găsit celule bej clasice la doar 6 pacienți cu cașexie în stadiu târziu. Din câte știm, acesta este primul raport despre prezența rumenirii WAT la un eșantion mare de pacienți cu cancer gastric și colorectal. Rezultatele noastre indică că rumenirea WAT ar putea să nu fie un fenomen comun la pacienții cu cașexie cu cancer. De asemenea, am constatat că concentrațiile serice de IL-6 și TNF-α au crescut semnificativ la 6 pacienți, comparativ cu 22 de pacienți fără celule grase bej, indicând IL-6 și TNF-α care ar putea accelera rumenirea WAT.
Se consideră că pierderea de grăsime observată la pacienții cu cahectică se produce prin descompunerea țesutului adipos (în principal WAT) [13]. În cașexia cancerului, lipoliza și risipa lipidelor pot apărea într-o anumită măsură înainte de pierderea musculară [27]. În concordanță cu descoperirile unui model de șoarece de cancer de colon care au demonstrat o creștere a lipolizei mediate de protein kinază-A în cașexia în stadiu incipient [28], am găsit, de asemenea, gene asociate lipolizei WAT reglate în cașexia cancerului în stadiu incipient. Genele asociate lipolizei WAT nu au fost reglate în mod sus în cașexia în stadiu târziu, ceea ce poate explica nivelurile mai scăzute ale FFA serice la sfârșitul anului, comparativ cu cașexia în stadiu incipient.
Date recente sugerează că există două tipuri distincte de grăsime brună: BAT clasice derivate din celulele descendente ale factorului miogen 5 (myf-5) și celulele UCP1-pozitive denumite adipocite bej care apar în grăsimea albă dintr-o descendență non-myf-5 29, 30]. S-a crezut cândva că BAT este prezentă doar la rozătoare și la nou-născuți [31]. Cu toate acestea, BAT puternic activă din punct de vedere metabolic a fost identificată la omul adult prin scanare tomografică cu emisie de pozitroni și tomografie computerizată (PET/CT) [32, 33]. Datele recente au sugerat că BAT umană constă în principal din adipocite bej, indicând că rumenirea WAT are loc la omul adult [11, 34]. În studiul nostru, markerii adipocitelor bej au caracterizat celulele UCP1-pozitive detectate la pacienții cahectici în stadiu târziu. Deși atât genele bej, cât și genele asociate grăsimii brune au fost reglate în sus la șoarecii cachectici, markerii adipocitelor bej au fost mai semnificativ crescute decât cele ale adipocitelor maronii. Luate împreună, celulele UCP1-pozitive detectate în WAT atât la pacienții cu cancer cachectic, cât și la șoareci au fost adipocite bej.
La șoarecii cachectici cu cancer, am constatat că inhibarea IL-6 a păstrat semnificativ greutățile WAT inghinale și epididimale. Cu toate acestea, greutățile BAT și ale mușchilor nu au fost păstrate în mod semnificativ prin inhibarea IL-6. Aceste descoperiri, în combinație cu inhibarea lipolizei WAT și a genelor asociate rumenirii în WAT inghinală a șoarecilor tratați cu anticorpi anti-receptor IL-6, sugerează că IL-6 ar putea induce atrofia WAT inghinală prin accelerarea lipolizei și rumenirii WAT. Cu toate acestea, dacă acest mecanism propus apare la oameni are nevoie de investigații suplimentare.
Concluzie
Rezultatele noastre oferă dovezi confirmatoare directe pentru apariția rumenirii WAT la pacienții cu cancer gastric și colorectal cahectic. De asemenea, sugerăm că IL-6 ar putea induce atrofia WAT în timpul cașexiei cancerului prin accelerarea lipolizei WAT și a rumenirii. Aceste date sugerează că inhibarea IL-6 ar putea fi o abordare promițătoare pentru ameliorarea pierderii de grăsime în cașexia cancerului, cel puțin pentru pacienții cu cancer gastric și colorectal.
- Pierderea în greutate intenționată și riscul de cancer Niciodată prea târziu pentru a pierde în greutate JNCI Cancer Spectrum Oxford
- Simptomul cancerului pulmonar Scăderea în greutate poate fi un semn al acestui cancer comun
- Cum combate cafeaua efectele canabisului, induce pierderea în greutate The Guardian Nigeria News - Nigeria
- Hamsterul meu alb de iarnă are căderea părului, burtă și merge amuzant Blana lui este pierdută strălucire
- Călătoria mea uimitoare de pierdere în greutate pierzând 117 kilograme chiropractică de stejar alb