1 Grup de Științe Analitice, Kings College, 150 Stamford Street, Londra SE1 9NH, Marea Britanie
2 Departamentul de patologie și microbiologie, Spitalul Memorial Kings Edward VII, 7 Point Finger Road, Paget DV04, Bermuda
Abstract
Atât spondilita anchilozantă (AS), cât și boala Crohn (CD) sunt afecțiuni cronice și potențial invalidante, care au fost incluse în grupul de spondiloartropatii. Rezultatele unui număr mare de studii susțin ideea că un agent patogen enteropatic, Klebsiella pneumoniae, este cel mai probabil factor declanșator implicat în inițierea și dezvoltarea acestor boli. Consumul crescut de amidon de către indivizii susceptibili genetic, cum ar fi cei care posedă alelotipuri HLA-B27, ar putea declanșa boala atât în AS, cât și în CD, sporind creșterea și perpetuarea Klebsiella microbi în intestin. Expunerea la niveluri crescute ale acestor microbi va duce la producerea unor niveluri crescute de anti-Klebsiella anticorpi precum și autoanticorpi împotriva autoantigenelor cu reactivitate încrucișată cu leziuni patologice rezultante în intestin și articulații. Prin urmare, o scădere a produselor care conțin amidon în aportul alimentar zilnic ar putea avea un efect terapeutic benefic asupra bolii, mai ales atunci când este utilizat împreună cu terapiile medicale disponibile în prezent în tratamentul pacienților cu SA și CD.
1. Introducere
Spondilita anchilozantă (AS) este considerată prototipul spondiloartropatiilor seronegative (SpA) care cuprind un grup de afecțiuni asociate spondilitei. Alte entități de boală ale SpA includ artrita reactivă, artrita psoriazică, SpA nediferențiată și artrita asociată cu boala inflamatorie intestinală (IBD), care include boala Crohn (CD) și colita ulcerativă (UC) [1]. SpA-urile sunt afecțiuni corelate care împărtășesc anumite manifestări clinice, de laborator, radiologice și genetice asociate, cum ar fi durerile inflamatorii de spate cauzate de spondilită/sacroiliită, precum și oligoartrita asimetrică, entesopatie, uveită anterioară, antecedente familiale pozitive și asocierea cu genele HLA-B27, dar fără pozitivitate pentru factorii reumatoizi.
Deși pacienții cu DC prezintă de obicei trăsături clinice ale afectării intestinului, prezentarea caracteristică la cei cu SA și CD asociată cu spondilita este durerea inflamatorie progresivă cu sau fără alte caracteristici asociate SpA [2].
Atât AS cât și CD afectează grupele de vârstă timpurie și au o distribuție la nivel mondial. Există cel puțin un milion de persoane în Regatul Unit care suferă de unele caracteristici ale AS. Impactul negativ al SA asupra ocupării forței de muncă [3] și starea psihologică [4] a pacienților cu această boală a fost bine stabilit. Boala în CD poate avea, de asemenea, un impact asupra statutului social și a abilităților de muncă ale pacienților, în special la femei [5]. Datorită acestor efecte negative asupra stării generale de sănătate și bunăstare a pacienților cu SA și CD, cu anumite dezavantaje ale tratamentelor medicale utilizate în prezent, o căutare a factorului cauzal și o măsură terapeutică alternativă care implică eradicarea cauzei ar putea fi de ajutor în managementul pacienților cu aceste boli.
2. Contextul genetic al AS și CD
Un istoric familial pozitiv este unul dintre punctele cheie în definirea caracteristicilor pacienților cu SpA. Într-un studiu familial al probanților AS și al controalelor sănătoase la o populație islandeză, s-a demonstrat că există dovezi care ar putea susține existența componentelor genetice comune pentru AS și IBD. Studiul a demonstrat un raport de risc de 3,0 și 2,1 la rudele de gradul I și respectiv, respectiv, pentru apariția SA în familiile probanților cu IBD și cu apariția IBD în familiile pacienților cu SA [6]. Într-un studiu mai recent, s-a demonstrat că există suprapuneri genetice între bolile autoimune, inclusiv AS și IBD [7]. Se pare, prin urmare, că anumiți factori genetici comuni ar putea acționa în dezvoltarea ambelor boli în AS și CD.
Frecvența asocierii alelotipurilor HLA-B27 la pacienții cu SA este considerată a fi cea mai puternică legătură genetică cu orice boală care a fost întâlnită în domeniul reumatologiei [8]. Această legătură genetică a fost descoperită la începutul anilor 1970, unde s-a constatat că peste 95% dintre pacienții cu SA posedă HLA-B27, în timp ce frecvența acestei gene în populația generală era sub 10% [9, 10]. Alte boli din grupul SpA au grade mai mici, dar diferite de asocieri cu acest alelotip. De exemplu, frecvența acestui alelotip la pacienții cu IBD/CD fără artrită asociată este comparabilă cu cea a populației normale, dar crește la 40% -60% la acei pacienți cu spondilită/sacroiliită [11]. Aceste date arată că un pacient spondiloartropatic care prezintă afectarea coloanei vertebrale are șanse mai mari de a deține gene HLA-B27 decât cei care prezintă doar implicarea articulațiilor periferice. În afară de HLA-B27, alte gene, indiferent dacă sunt localizate în interiorul sau în afara regiunii complexe majore de histocompatibilitate, au fost, de asemenea, implicate în etiopatogeneza atât a AS [12] cât și a CD [13].
3. Legătura dintre AS și CD
Din aceste rezultate ar rezulta că atât HLA-B27, cât și inflamația intestinului joacă un rol esențial în dezvoltarea SpA, în special a AS și a CD, și că principalul proces etiopatogenetic este declanșat de factori genetici și de mediu (în principal microbieni).
4. Dovezi ale infecțiilor microbiene subclinice în SA și CD
Primele dovezi ale legăturii epidemiologice dintre infecție și SpA au fost detectate la începutul secolului al XX-lea, unde o triadă de simptome constând din uretrită, conjunctivită și artrită, denumită sindromul Reiter, a fost detectată la un grup de soldați care trăiau în condiții neigienice în timpul primul război mondial în urma mai multor crize de infecții [23]. Cu toate acestea, această afecțiune a fost recunoscută ulterior ca o formă de artrită reactivă, despre care se știe că este precedată de infecții cu bacterii enterogene sau urogenitale [24].
Analizele de revizuire anterioare au arătat că rezultatele studiilor moleculare, imunologice și microbiologice ar putea stabili legătura dintre subclinice Klebsiella infecții și etiopatogenia atât a AS [25, 26], cât și a CD [14, 27]. Dovezile pentru aceste legături sunt rezumate după cum urmează.
4.1. Klebsiella si ca
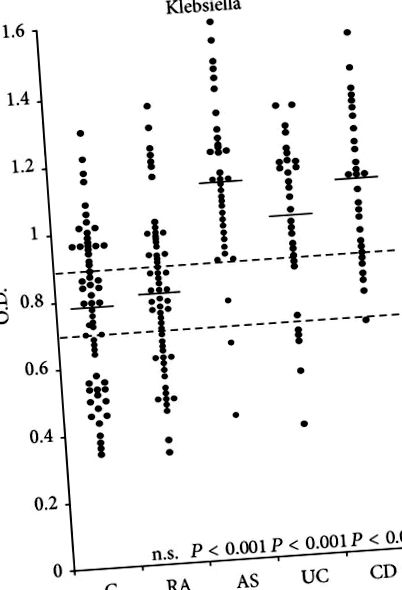
Este bine documentat că există o legătură puternică între inflamația intestinală [46] și/sau AS [47, 48]. Nivelul imunoglobulinelor totale [49] și secretorii de IgA [50] a crescut la majoritatea pacienților cu SA. Mai mult, există dovezi pentru niveluri crescute de IgA, în special anticorp IgA secretor împotriva Klebsiella antigen [51-53] sau Klebsiella antigene reactive încrucișate [54] la pacienții activi cu SA. Rezultatele acestor studii se leagă Klebsiella, colagen și HLA-B27 până la AS ar putea explica unele dintre caracteristicile clinice, genetice și imunologice caracteristice predominante prezente la pacienții cu această boală (Tabelul 1).
4.2. Klebsiella și CDMai mult, studiile experimentale efectuate de Nagakute în Japonia au arătat că enterocolita indusă de colagen [63] și artrita [64] au fost observate la animale la imunizarea cu extracte de coloni omologi și colageni împreună cu Klebsiella lipopolizaharide. 5. Legarea mecanismului etiopatogen Klebsiella la AS și CDMimetismul molecular sau ipoteza reactivității încrucișate este sugerat a fi principalul mecanism care se poate lega Klebsiella odată cu inițierea și dezvoltarea AS și CD asociate cu spondilita [65]. Dovezile obținute din alte boli, cum ar fi febra reumatică [66] și ciroza biliară primară [67], indică faptul că mimica moleculară este mai mult decât un epifenomen, prin care răspunsurile imune umorale și/sau celulare sunt detectate în mod constant împotriva țesuturilor vizate la locurile patologice la pacienții cu aceste condiții. Tipurile de anticorpi cu reacție încrucișată produse în continuare Klebsiella infecțiile vor determina localizarea anatomică a leziunilor patologice, în special în AS. Unii anticorpi reacționează cu HLA-B27, un antigen care se exprimă în majoritatea țesuturilor articulare din interiorul articulațiilor sinoviale, în timp ce alți anticorpi reacționează cu tipurile I, III și IV de colagen, care formează o componentă importantă a țesuturilor spinale unde se localizează leziunile patologice. Legarea acestora Klebsiella anticorpii cu reactivitate încrucișată, atunci când sunt prezenți în titruri ridicate, declanșează cascade inflamatorii, cum ar fi sistemul complementului, împreună cu producerea de diferite citokine, rezultând modificări patologice, cu fibroza, calcificarea și formarea osoasă nouă, care duc la dezvoltarea AS clasic. Mai mult, nivelul crescut al expresiilor antigenului HLA-B27 pe țesuturile vizate la pacienții cu SA [68] va face aceste molecule mai accesibile și, prin urmare, va crește șansa de legare a acestora la anti-Klebsiella anticorpi cross-reactivi. 6. Microbi de amidon și intestinSubstratul principal necesar creșterii agenților microbieni colonici include amidonul și carbohidrații complecși care sunt de obicei disponibili în cantități considerabile în intestin. Într-un studiu, efectuat de un grup din Minnesota, folosind teste de respirație cu hidrogen ca indice de absorbție a carbohidraților la indivizi sănătoși, până la 20% dintr-o masă de testare a amidonului s-a dovedit a fi disponibilă pentru metabolism de către microflora colonică [69] . De asemenea, s-a constatat că până la 10% din amidonul consumat poate scăpa de absorbția intestinului subțire [70], indicând că o proporție considerabilă de amidon alimentar ajunge în intestinul gros. Într-un alt studiu experimental s-a arătat că s-a observat o creștere semnificativă a populației bacteriene totale de agenți microbieni enterobacterieni la fecalele șobolanilor care au fost hrăniți cu diete care conțin amidon de cartofi rezistent în comparație cu cei care iau amidon de porumb ceros rapid digerabil [71]. 7. Klebsiella și enzime de amidon-desbranșareAmidonul sau polizaharidele macromoleculare trebuie inițial hidrolizate pe substraturi mai mici pentru a fi transportate în celule. Pentru a realiza acest proces hidrolitic și de transport, bacteriile își folosesc de obicei enzimele care degradează carbohidrații, cum ar fi pullulanazele și izoamilazele [72]. Moleculele de amidon, care constau în aproximativ 20% amiloză și 80% polimeri glucoză amilopectină (Figura 2), sunt catalizate de amilaze, ciclodextrinaze, glucozidaze și alte enzime de ramificare a amidonului, cum ar fi pullulanazele bacteriene [73]. Amiloza este un polimer liniar format din α-(1 → 4) legături între reziduurile de glucoză și acestea pot fi ușor hidrolizate de amilazele prezente în enzimele digestive. Cu toate acestea, amilopectina este un polimer ramificat format din secvențe liniare de lanțuri asemănătoare amilozei legate de α-(1 → 6) lanț lateral care dă naștere unei structuri ramificate (Figura 3), care poate fi defalcat prin Klebsiella pullulanază dar nu de enzime digestive. Prin urmare, digestia amidonului din intestinul subțire este limitată de incapacitatea enzimelor digestive luminale din intestin să se rupă α-(1 → 6) legături ale amilopectinei și astfel rezultând formarea „amidonului dur” care se acumulează în colon. Klebsiella poate supraviețui în medii dure exploatând unii dintre produsele sale degradante enzimatice, care sunt necesare pentru protecția, întreținerea și supraviețuirea acestor microbi. În afară de alte produse enzimatice, cum ar fi azotaza reductaza, Klebsiella poate produce, de asemenea, enzime pullulanază de hidrolizare și de ramificare a amidonului. Klebsiella poate utiliza amidonul ca singură sursă de carbon și energie prin două căi metabolice. Primul implică degradarea extracelulară în maltodextrine liniare prin hidroliza legăturilor glicozidice prin pullulanaza asociată suprafeței celulare și apoi scindarea ulterioară a legăturilor glicozidice prin acțiunea glicoziltransferazei extracelulare [74]. O fracțiune din totalul amidonului alimentar consumat zilnic la om rezistă digestiei de către amilaza pancreatică din intestinul subțire, ajungând astfel la colon [75]. Această formă de amidon nedigerat sau rezistent este de obicei fermentată de microflora intestinală umană, oferind o sursă de energie și carbon pentru mai mult de 400 de specii de bacterii prezente în colon [76]. Un grup din Los Angeles a arătat că numărul mediu de fecale Klebsiella concentrațiile la persoanele care iau o dietă bogată în carbohidrați/sărace în proteine au fost de patruzeci de ori mai mari decât la cei care au o dietă scăzută în carbohidrați/proteine [77]. În mod similar, numărul mediu de Klebsiella s-a dovedit a fi de zece ori mai mare atunci când a fost incubat cu produse glucidice simple precum zaharoza, lactoza și glucoza decât cu unsprezece aminoacizi diferiți [78]. Aceste rezultate indică faptul că carbohidrații complecși, cum ar fi produsele care conțin amidon, sunt necesare pentru creșterea, replicarea și persistența multor agenți enterobacterieni, inclusiv Klebsiella microbi în intestinul gros. 8. Potențial pentru utilizarea dietei scăzute de amidon la pacienții cu AS și CDAgenții terapeutici curenți utilizați la pacienții cu SA [79] și CD [80] includ medicamente antiinflamatoare nesteroidiene și imunosupresoare, precum și agenți biologici. Cu toate acestea, aceste tratamente nu pot inversa leziunile distructive existente ale coloanei vertebrale și ar putea fi asociate cu efecte secundare dăunătoare [81, 82]. Prin urmare, punerea în aplicare a altor măsuri terapeutice, în special a celor care implică mijloacele de eradicare eficientă a agenților cauzali prin utilizarea unui aport scăzut de amidon și, eventual, a antibioticelor, împreună cu tratamentele medicale utilizate în prezent, ar putea avea un efect benefic în gestionarea pacienților cu SA și CD. Aceste date susțin efectul cauzal al consumului ridicat de amidon și efectul benefic al aportului scăzut de amidon la pacienții cu SpA, în special la cei cu SA sau IBD. De exemplu, într-un studiu anterior pe un grup de pacienți cu UC, analizele conținutului regiunilor ileocaecale îndepărtate chirurgical au arătat că lichidul ileostomic conținea o cantitate semnificativă de monozaharide și dizaharide [83]. Aceste produse simple de carbohidrați detectate în lichidul ileostomic par să fie derivate din amidon. Într-un alt studiu longitudinal prospectiv, influența factorilor dietetici a fost examinată la un grup de pacienți italieni cu IBD și la un grup de controale sănătoase, potrivite pentru vârstă, sex și locația de trai. Rezultatele au arătat că pacienții cu CD și UC au un consum crescut de carbohidrați și amidon total cu un risc relativ semnificativ mai mare în comparație cu persoanele sănătoase [84]. Într-o analiză ulterioară de revizuire a literaturilor cu privire la aportul zilnic de diete și relația lor cu flora microbiană intestinală la pacienții cu IBD, s-a arătat că o cantitate considerabil mare de date arată o asociere între aportul crescut de alimente cu carbohidrați occidentalizați, microbian intestinal ridicat. sarcină și apariția IBD [85]. Într-un studiu deschis longitudinal efectuat la un grup de 36 de pacienți cu SA activă în „London AS Clinic”, majoritatea pacienților au prezentat reduceri ale ratelor de sedimentare a eritrocitelor și ale concentrațiilor totale de IgA, precum și o scădere a aportului lor pentru medicamente antiinflamatoare după un control de nouă luni după o scădere a aportului alimentar de amidon [86]. Se pare că atât în IBD, cât și în AS, o interacțiune între microflora intestinală și mucoasa este un posibil contribuitor la dezvoltarea acestor boli. Aceste rezultate ale datelor susțin ideea că o creștere a volumului de organisme potențial patogene, cum ar fi Klebsiella în microflora fecală datorită consumului ridicat de amidon ar putea ajuta la inițierea și dezvoltarea atât a AS cât și a CD. Se pare, prin urmare, că excluderea unei diete care conține carbohidrați complecși, cum ar fi amidonul, dar nu și alimente simple care conțin carbohidrați, cum ar fi glucoza sau zaharoza, ar putea inhiba creșterea Klebsiella și ar putea ameliora procesul și activitatea bolii la pacienții cu SA și CD. 9. ConcluziiAS și CD se dovedesc a fi două afecțiuni corelate în principal pe baza caracteristicilor genetice și imunologice existente. Principalul mecanism patogenetic care poate explica această legătură este „mimica moleculară” sau „reactivitatea încrucișată” între Pneumonie Klebsiella și țesuturile țintă. Se pare că amidonul este principala sursă de Klebsiella creșterea în colon. Prin urmare, consumul crescut de alimente care conțin amidon de către indivizii susceptibili genetic, cum ar fi cei care posedă gene HLA-B27, ar putea duce la inițierea și dezvoltarea AS sau a CD asociate cu spondilita. Manipularea dietetică sub formă de aport scăzut de amidon poate fi inclusă în gestionarea pacienților cu SA sau CD, mai ales atunci când este utilizată împreună cu măsurile terapeutice medicale actuale. MulțumiriAcest studiu a fost susținut de Trustees of Middlesex Hospital și American Friends of King’s College din Londra. Referințe
Popular
Citesc acum
|