SeungHye Han
1 Departamentul de Medicină, Centrul de excelență pentru leziuni pulmonare acute și
Rama K. Mallampalli
1 Departamentul de Medicină, Centrul de excelență pentru leziuni pulmonare acute și
2 Departamentul de biologie celulară și fiziologie, Universitatea din Pittsburgh, Pittsburgh, Pennsylvania; și
3 Linii de servicii de specialitate medicală, Veterans Affairs Pittsburgh Healthcare System, Pittsburgh, Pennsylvania
Abstract
S-a stabilit că surfactantul pulmonar reduce tensiunea superficială la interfața aer - apă din alveole, prevenind astfel colapsul acestor structuri la expirarea finală. În acest mod, agentul tensioactiv reduce activitatea asociată cu respirația. Deși surfactantul și proprietățile sale active de suprafață au fost descoperite relativ devreme în anii 1920 (1), componentele și mecanismul său de acțiune au început să fie elucidate abia în anii 1950 de Pattle (2) și Clements (3). Descoperirea realizată de Avery și Said a ajutat la identificarea unei descoperiri fundamentale care leagă deficitul de surfactant pulmonar de sugarii care au murit din cauza sindromului de detresă respiratorie (RDS) (4). Într-adevăr, aceste descoperiri critice au ajutat la propulsia terapiei de înlocuire a surfactanților ca o abordare care a revoluționat tratamentul RDS. Cu toate acestea, în timpul anilor 1990, anchetatorii au descoperit câteva proprietăți biologice importante suplimentare ale acestui material activ de suprafață în zona imunității gazdei împotriva infecției microbiene și a activității imunomodulatoare.
Compoziția și funcția surfactantului
Compoziţie
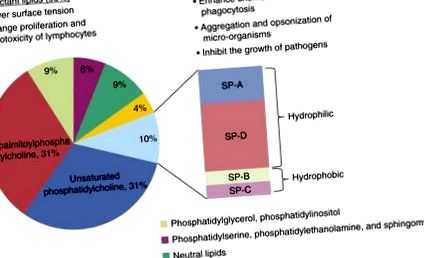
Surfactantul pulmonar este compus în principal din fosfolipide și proteine cheie (5). Lipidele compun 80-90% din greutatea sa moleculară, dintre care cele mai abundente specii sunt fosfatidilcolină, fosfatidilglicerol și fosfatidilinozitol (Figura 1); în mod specific, fosfatidilcolina constituie aproximativ 70% din porțiunea lipidică a agentului tensioactiv și există ca o formă relativ unică, cunoscută sub numele de dipalmitoilfosfatidilcolină (DPPC). Împreună cu proteinele surfactant, DPPC asigură activitatea de suprafață a surfactantului (6-8). Celelalte tipuri de lipide, inclusiv fosfatidilserină, fosfatidiletanolamină și sfingomielină, par a fi prezente în cantități relativ mici. Această compoziție lipidică este bine conservată în rândul vertebratelor (7).
Compoziția și funcția surfactantului. Surfactantul este compus din 90% lipide și 10% proteine. Conținutul de lipide conține în principal fosfolipide, în special dipalmitilfosfatidilcolină, care este responsabilă pentru funcția biofizică a surfactantului. Proteinele hidrofile mari, proteinele surfactante (SP) -A și SP-D, joacă un rol important în apărarea gazdei și modularea imunitară, în timp ce SP-B și SP-C participă în principal la modularea proprietăților biofizice.
Surfactantul conține patru proteine asociate, proteina surfactantă (SP) -A, SP-B, SP-C și SP-D. Două dintre aceste proteine, SP-A și SP-D, sunt hidrofile, iar celelalte sunt hidrofobe (9). SP-A și SP-D sunt membri ai unei familii de proteine imune înnăscute, denumite colectine (10, 11). Aceste proteine au în comun o regiune asemănătoare colagenului NH2-terminal și un domeniu de lectină C-terminal care leagă carbohidrații într-o manieră dependentă de calciu. Siturile de legare pentru aceste domenii de lectină se găsesc pe suprafețe bacteriene și virale (12), iar acest lucru este parțial responsabil pentru rolul pe care îl joacă colectinele în imunitatea înnăscută și adaptativă.
Proteinele hidrofobe surfactante, SP-B și SP-C, sunt stocate și secretate împreună cu fosfolipide surfactante (13, 14). SP-B este o proteină indispensabilă care joacă un rol în creșterea tensiunii superficiale - reducând proprietățile surfactantului (14) și, de asemenea, pare să aibă o anumită activitate antimicrobiană (15-17). Rolul SP-C, una dintre cele mai hidrofobe peptide cunoscute, este incert, dar gradul său ridicat de conservare în rândul speciilor sugerează o funcție integrală (17).
Componentele surfactantului sunt sintetizate în principal de celula alveolară de tip II, care produce lipide surfactante și proteine surfactante (5, 18), și celula clubului căilor respiratorii, care sintetizează proteinele surfactante SP-A, SP-B și SP-D (19- 21) (Figura 2).
Ciclul de viață al surfactanților - sinteză, secreție și reciclare. Celulele alveolare de tip II, care acoperă aproximativ 7% din suprafața epitelială alveolară, sunt în principal responsabile de producerea surfactantului folosind substraturi dietetice (1). Surfactantul este sintetizat în reticulul endoplasmatic (ER) (2) al celulelor alveolare de tip II și transportat la Golgi (3) pentru modificări ulterioare. Majoritatea componentelor surfactantului sunt depozitate în corpurile lamelare (4) până când sunt secretate în hipofază lichidă pe alveole prin exocitoză (5). Surfactantul formează o structură asemănătoare rețelei, numită mielină tubulară (6), care este transportată către interfața aer - lichid pentru a forma un monostrat de film surfactant (7). Fosfolipidele sunt fie internalizate și degradate de macrofage (8), fie reciclate înapoi în celulele de tip II pentru reutilizare (8 ′). Rețineți că proteina surfactantă (SP) -A, SP-B și SP-D sunt, de asemenea, sintetizate în celulele club în bronhiolii terminali.
Funcţie
Funcțiile principale ale agentului tensioactiv sunt următoarele: (1) scăderea tensiunii superficiale la interfața aer - lichid și astfel prevenirea colapsului alveolar la expirarea finală, (2) interacțiunea cu și ulterior uciderea agenților patogeni sau prevenirea diseminării acestora și modulând răspunsurile imune.
Schimbarea drastică a suprafeței alveolelor de-a lungul ciclului respirator dictează faptul că tensiunea superficială alveolară trebuie să fie mai mică de 2 mN/m la expirarea finală pentru a preveni colapsul alveolar (22). Această funcție critică a agentului tensioactiv se realizează prin menținerea unui film extrem de îmbogățit în DPPC, care produce tensiune superficială extrem de scăzută (Tabelul 1. Se credea anterior că componentele tensioactivelor existau doar în plămâni. Modelele animale și studiile de observare umană au arătat, cu toate acestea, proteinele surfactante se scurg în spațiul vascular atunci când membranele alveolocapilare sunt rănite (43-46). Important, nivelurile circulante ale proteinelor surfactante pot avea utilitate clinică. Rezultatele infecțiilor virale H1N1 (47) Nivelurile -D sunt crescute la cei cu fibroză pulmonară comparativ cu voluntarii sănătoși (48).
tabelul 1.
Nivelurile de SP-A și SP-D din spălarea bronhoalveolară în boala pulmonară
| RDS la nou-născuți | ↓ | n/A | ↓ | 140–143 |
| PAP | ↑ | ↑ | ↑ | 144–146 |
| SDRA | ↓ | n/A | ↓ | 40, 147 |
| IPF | ↓ | = | ↓ | 145, 148-150 |
| Sarcoidoză | ↑ | = | = | 145, 149, 151, 152 |
| Pneumonie bacteriană | ↓ | n/A | ↓ | 153, 154 |
| Fumători | ↓ | ↓ | = | 155, 156 |
| Astm | ↓ | n/A | = | 157 |
Definiția abrevierilor: ARDS = sindrom de detresă respiratorie acută; IPF = fibroză pulmonară idiopatică; N/A = nu este disponibil; PAP = proteinoză alveolară pulmonară; RDS = sindrom de detresă respiratorie.
↓ indică scădere; ↑ indică creșterea; = indică neschimbat.
Se știe că polimorfismele genetice ale proteinelor surfactante sunt asociate cu o prevalență mai mare a fibrozei pulmonare idiopatice (49, 50), dar și cu o prevalență redusă a bolii pulmonare interstițiale în scleroza sistemică (51). În plus, mai multe studii descriu, de asemenea, asocierea dintre polimorfismele genetice pentru proteinele surfactante și edemul pulmonar la altitudine mare (52), ARDS (53), carcinomul pulmonar (54) și displazia bronhopulmonară (55). O rară mutație cu sens greșit în SFTPA2, gena care codifică SP-A2, este asociată cu dezvoltarea fibrozei pulmonare idiopatice familiale și a cancerului pulmonar (56).
Pe de altă parte, s-a demonstrat că numeroase infecții respiratorii modifică compoziția surfactantului. De exemplu, P. aeruginosa inhibă biosinteza surfactantului (57, 58), își reduce apărarea gazdei și funcția biofizică (59) și secretă elastază pentru a degrada proteinele surfactante A și D (60, 61). De asemenea, LPS, o componentă majoră a peretelui celular al bacteriilor gram-negative, inhibă sinteza și secreția fosfolipidelor (57, 58). Inhibarea surfactantului de către bacterii pare să fie asociată cu citokinele celulei gazdă, cum ar fi factorul de necroză tumorală-α, ceea ce duce la degradarea enzimelor biosintetice ale surfactantului. Adenovirusul uman perturbă traficul de surfactant fosfatidilcolină (62), în timp ce A. fumigatus reglează în jos proteina SP-B și SP-C și expresia ARNm la șoareci (63). Celulele epiteliale bronșice infectate cu virusul sincițial respirator (RSV) au scăzut nivelul proteinelor SP-A prin eficiență redusă a traducerii ARNm (64).
Funcția antimicrobiană
Bacterii
Proteinele hidrofile SP-A și SP-D joacă un rol major în apărarea gazdei prin inhibarea creșterii bacteriene, facilitarea absorbției bacteriene de către celulele gazdă și agregarea și opsonizarea agenților patogeni (65). Aceste proteine tensioactive se pot lega atât de bacteriile gram-negative, cât și de bacteriile gram-pozitive. SP-A și/sau SP-B interacționează cu LPS derivate de la K. pneumoniae (30, 66), E. coli (30, 67), P. aeruginosa (68-70) și Legionella pneumophila (71), care în consecință rezultă în aglutinare, îmbunătățirea absorbției agentului patogen și inhibarea creșterii. Aceste proteine tensioactive se leagă, de asemenea, de peptidoglican, o componentă a peretelui celular al bacteriilor gram-pozitive derivate din Staphylococcus aureus (72) și Streptococcus pneumoniae (26, 27), precum și Mycobacterium avium, Mycobacterium tuberculosis și Mycoplasma pneumoniae pentru a spori absorbția de către fagocite. și le inhibă creșterea (73-78).
Ciuperci
Atât SP-A cât și SP-D sunt capabili să se lege de o varietate de ciuperci, în mare parte agenți patogeni oportunisti, pentru a facilita aglutinarea și fagocitoza de către celulele gazdă. Studiile pe animale demonstrează că colectinele pulmonare (SP-A și SP-D) cresc permeabilitatea membranei celulare a H. capsulatum, inhibând creșterea acesteia direct (31). Se leagă, de asemenea, de A. fumigatus (79), Blastomyces dermatitidis (80), Coccidioides posadasii (81), Cryptococcus neoformans (82, 83) și Pneumocystis jiroveci (carinii) (84, 85), ceea ce are ca rezultat aglutinarea și absorbția sporită . Interesant, acest efect pare a fi specific microbului, deoarece legarea colectinelor pulmonare de Candida albicans inhibă fagocitoza de către macrofagele alveolare, inhibând în același timp creșterea fungică (86, 87).
Virus
Colectinele pulmonare (SP-A și SP-D) se leagă de viruși pentru a facilita îndepărtarea agentului patogen. Virușii sunt unici în comparație cu multe microorganisme prin faptul că necesită intrarea în celulele gazdă pentru a se replica. Deoarece SP-A și SP-D sunt prezente în stratul de mucus și suprafața alveolară, acestea sunt bine poziționate pentru a preveni infecția celulelor epiteliale prin neutralizare virală, aglutinare și fagocitoză îmbunătățită. SP-A și/sau SP-D se leagă de hemaglutinina și neuraminidaza virusului gripal A pentru a le inhiba activitatea (88-90). Interesant este că hemaglutinina virusurilor gripale pandemice are o activitate de legare scăzută pentru proteina surfactant D, comparativ cu cea a unei tulpini gripale sezoniere (91). Colectinele pulmonare se leagă, de asemenea, de glicoproteinele virușilor, inclusiv HIV (92, 93), RSV (94) și coronavirusul sindromului respirator acut sever (95). Studii recente indică faptul că, pe lângă colectinele pulmonare, componentele lipidice tensioactive inhibă, de asemenea, infecția cu RSV (96).
Aplicații terapeutice și implicații
Surfactantul exogen a fost, de asemenea, examinat într-o varietate de boli pulmonare, cum ar fi astmul și pneumonia (116). Deși un studiu pilot pentru surfactant natural aerosolizat a arătat o funcție pulmonară îmbunătățită în timpul exacerbării acute a astmului (117), nu a arătat beneficii clinice la pacienții cu astm bronșic stabil (118). Un raport de caz a demonstrat îmbunătățirea oxigenării cu instilarea intrabronșială a surfactantului la un pacient adult cu pneumonie lobară gram-negativă (119). Alte rapoarte de caz demonstrează îmbunătățiri similare ale oxigenului la sugarii infectați cu HIV cu pneumonie cu P. carinii (120, 121) sau pneumonie cu VSR (122). Un ECA al unui curs de tratament de 2 săptămâni cu surfactant sintetic aerosolizat a arătat o funcție pulmonară îmbunătățită la pacienții adulți cu bronșită cronică stabilă (123). Aceste observații trebuie confirmate cu studii mai bine controlate la subiecți cu boli respiratorii.
O posibilă implicație terapeutică a terapiei de substituție a surfactanților este imunosupresia. Studiile la animale și datele limitate la om arată că surfactantul exogen scade eliberarea de citokine (124), sinteza ADN a mediatorilor inflamatori (125, 126), proliferarea limfocitelor (127), producția de imunoglobuline (128) și expresia moleculelor de aderență (129). Administrarea intratraheală a unui amestec de surfactant - amikacină la șobolani cu pneumonie Pseudomonas a arătat efecte antiinflamatorii îmbunătățite comparativ cu amikacina în monoterapie (130). Aceste observații sugerează posibilitatea ca surfactantul să poată fi utilizat pentru a modula răspunsurile imune în timpul bolilor inflamatorii pulmonare, dar sunt necesare studii suplimentare.
În afara terapiei cu surfactant exogen, există, de asemenea, dovezi că anumiți agenți farmacologici pot spori nivelurile de surfactant endogen, deși datele actuale sunt limitate. Corticosteroizii au fost folosiți pe scară largă la femeile cu risc de naștere prematură, deoarece reduc morbiditatea și mortalitatea neonatală din cauza RDS. Steroizii prenatali accelerează dezvoltarea pneumocitelor de tip 2 și cresc astfel producția de proteine tensioactive și enzime necesare pentru sinteza fosfolipidelor. Corticosteroizii induc, de asemenea, receptorii β pulmonari, care joacă un rol în eliberarea surfactantului și absorbția lichidului alveolar atunci când sunt stimulați (131). Hormonul tiroidian are, de asemenea, un efect sinergic asupra sintezei fosfolipidelor cu corticosteroizi la modelele animale (132, 133). Ambroxolul poate acționa, de asemenea, pentru a crește eliberarea surfactantului și este în curs de investigare pentru utilizare în RDS (134). S-a raportat anecdotic că hidroxiclorochina tratează cu succes copiii cu deficit de SP-C cu sau fără utilizarea de corticosteroizi (135-137). Mecanismul de acțiune este neclar, dar poate fi legat de inhibarea hidroxiclorochinei a procesării intracelulare a precursorilor SP-C, ducând la acumularea tardivă a SP-C (138). S-a demonstrat că alți agenți, cum ar fi factorul de creștere a keratinocitelor, cresc secreția de surfactant sau sinteza acestuia (139).
Concluzii
Pe scurt, surfactantul pulmonar are funcții importante dincolo de reducerea tensiunii superficiale și modificarea proprietăților mecanice care duc la scăderea activității de respirație. Deoarece epiteliul pulmonar se află într-o expunere constantă la mediu, agentul tensioactiv oferă o primă linie crucială de apărare împotriva infecției, îmbunătățind îndepărtarea agenților patogeni, modulând răspunsul celulelor inflamatorii și optimizând activitatea biofizică pulmonară. Proteinele hidrofile, care constituie o mică parte din surfactant, joacă un rol major în activitatea antimicrobiană. Deși surfactantul este un tratament stabilit pentru RDS la sugarii prematuri, nu a existat până acum niciun beneficiu clinic convingător pentru utilizarea surfactantului exogen la pacienții adulți cu SDRA. Studii suplimentare trebuie efectuate pentru a explora posibilitatea surfactanților ca terapie imunomodulatoare sau proiectarea moleculelor mici care modulează disponibilitatea componentelor surfactanților în bolile respiratorii.
- Rolul vitaminelor în patogeneza bolilor hepatice grase nealcoolice
- Rolul emergent al autofagiei în bolile hepatice alcoolice
- Tipuri de infecții virale respiratorii WTOP
- U2 s The Edge aduce misiunea de echitate în sănătate la Vatican prin alimente care luptă împotriva bolilor - Uită-te la
- Proces UCSF cu boală inflamatorie a intestinului → Cercetări personalizate asupra dietei în colita ulcerativă și