Abstract
ARTICOLE LEGATE
Acest articol face parte dintr-o secțiune tematică despre reacția la grăsimi și vasculară Pentru a vizualiza celelalte articole din această secțiune vizitați http://dx.doi.org/10.1111/bph.2012.165.issue-3
Introducere
Corelarea rezistinei cu sensibilitatea la insulină, diabet și sindrom metabolic
Când rezistența a fost descrisă pentru prima dată în 2001 (Steppan și colab., 2001b), au fost raportate mai multe descoperiri majore: nivelurile de rezistență plasmatică au fost crescute în formele genetice și induse de dietă ale modelului șoarecilor obezi; administrarea unui anticorp anti-rezistin a crescut sensibilitatea la insulină la animalele obeze și rezistente la insulină; tratamentul șoarecilor sănătoși cu rezistență recombinantă care afectează toleranța la glucoză și acțiunea insulinei; și, administrarea de rezistină a afectat absorbția glucozei indusă de insulină în adipocite. Din aceste observații, s-a ajuns la concluzia că rezistența joacă un rol important în rezistența la insulină și obezitate la modelul de șoarece diabetic.
Cu toate acestea, aplicabilitatea acestor descoperiri la studii la om a fost dificil de determinat. La șoareci, rezistina este secretată în principal din țesutul adipos alb. În schimb, rezistina la om este secretată în principal din monocitele sanguine circulante, niveluri scăzute provenind din țesutul adipos alb (Savage și colab., 2001). De asemenea, rezistina umană este omologă doar cu 59% la rezistența șoarecelui la nivelul aa (Ghosh și colab., 2003), ceea ce evidențiază din nou limitele utilizării unui model de șoarece pentru a studia metabolismul uman. În cele din urmă, persistă controversa cu privire la rolul patogen al rezistinei în dezvoltarea rezistenței la insulină și a obezității la om.
Mai multe studii susțin o corelație pozitivă între obezitate, rezistența la insulină și rezistența serică crescută la om. În primul rând, s-a descris că rezistina este exprimată în hepatocite umane și induce rezistența la insulină (Sheng și colab., 2008). De asemenea, s-a constatat că nivelurile de mARN de rezistină sunt ușor de detectat la PBMC umane și mai mari la pacienții cu DM2 comparativ cu femeile sănătoase, sugerând un rol pentru rezistență în patogeneza DM2 umană (Tsiotra și colab., 2008). În mod similar, într-o investigație a relației dintre nivelurile de rezistență serică, obezitate și rezistență la insulină la 125 de pacienți iordanieni cu DM2, s-a determinat că nivelurile serice de rezistență au fost mai mari la pacienții obezi cu DM2 (indicele de masă corporală ≥ 30 kg · m −2) comparativ cu martorii obezi non-diabetici; această corelație nu a fost semnificativă statistic între diabetici și martorii cu greutate normală sau supraponderală (Gharibeh și colab., 2010). Aceste dovezi sugerează că rezistina joacă un rol în patogeneza obezității și rezistenței la insulină la om, ambele contribuind la dezvoltarea DM2.
Concentrațiile de rezistență s-au dovedit a fi mai mari în medie la pacienții cu diabet gestațional (GDM) (21,9 ng · mL -1) decât la femeile gravide cu toleranță normală la glucoză (19,03 ng · mL -1) și la femeile care nu sunt însărcinate (14,8 ng · mL −1, P 14 zile pentru vindecare - nivelurile de rezistină plasmatică și IL-6 au fost crescute în comparație cu pacienții cu DM2 și fără ulcerații ale piciorului, legând din nou rezistina, DM2 și inflamația (Tuttolomondo și colab., 2010).
Există discrepanțe în datele referitoare la relația dintre rezistină și obezitate și/sau diabet. În unele modele de rozătoare, s-a demonstrat că expresia mRNA a rezistenței în țesutul adipos al animalelor obeze nu se corelează cu nivelurile serice de rezistină, care la rândul lor nu se corelează cu insulina sau glucoza serică (Lee și colab., 2005); în alte studii, rezistența sa dovedit a fi de fapt reglementată în jos în țesutul adipos al animalelor obeze (Le Lay și colab., 2001; Milan și colab., 2002). În studiile efectuate la om, nivelurile circulante ale rezistenței și ale expresiei genei rezistinei au fost raportate ca fiind crescute și neschimbate în rezistența la obezitate și/sau insulină (Lee și colab., 2003; Filippidis și colab., 2005; Hasegawa și colab., 2005; Iqbal și colab., 2005). Între timp, un alt studiu (Laudes și colab., 2010) a constatat că expresia rezistinei a crescut semnificativ la subiecții obezi comparativ cu martorii, dar fără corelație cu DM2. În mod clar, implicarea rezistinei (sau lipsa acesteia) în patogeneza rezistenței la insulină legate de obezitate și DM2 justifică o investigație suplimentară; este probabil ca rezistina să fie un biomarker pentru și/sau să contribuie la rezistența la insulină în populații specifice.
Asocierea rezistinei cu bolile cardiovasculare
Rezistină și macrofage
Un pas cheie în formarea bolii aterosclerotice inflamatorii cronice este migrarea monocitelor circulante în spațiul subendotelial, unde se diferențiază în macrofage. Macrofagele preiau apoi lipoproteinele aterogene Apo-B aterogene bogate în colesterol (VLDL, IDL și LDL), formând celule de spumă (Glass și Witztum, 2001). La om, rezistina este exprimată în principal în monocite/macrofage (Savage și colab., 2001). Receptorii de eliminare a macrofagelor (SR), cum ar fi clasa A SR (SR-AI, SR-AII, SR-AIII) și clasa B SR (SR-BI, SR-BII, CD36), sunt responsabili pentru internalizarea LDL oxidat oxLDL ) (Kunjathoor și colab., 2002). Celulele de spumă derivate din macrofage joacă un rol critic în inițierea și progresia aterosclerozei (Glass și Witztum, 2001; Li și Glass, 2002). Aceste celule se infiltrează în artere și inițiază sau promovează aterogeneza secretând diverse citokine pro-inflamatorii (Ross, 1999).
Rezistină și citokine
Citokinele sunt molecule mici de semnalizare celulară care mediază inflamația. Citokinele își leagă receptorii de suprafață celulară potrivite și declanșează căi de semnalizare intracelulară, care la rândul lor modifică funcțiile celulare. Acest lucru poate duce la reglarea ascendentă și/sau reglarea descendentă a mai multor gene și factorii de transcripție a acestora, rezultând în producerea altor citokine, o creștere a numărului de receptori de suprafață celulară pentru alte molecule sau suprimarea propriului efect de către inhibarea feedback-ului. S-a demonstrat că rezistina promovează activarea celulelor endoteliale prin eliberarea ET-1 și reglarea în sus a moleculei de adeziune a celulelor vasculare și a moleculei de adeziune intercelulară-1; între timp, rezistina duce la reglarea descendentă a expresiei factorului de necroză tumorală (TNF) asociată cu factorul 3 (TRAF-3), un inhibitor al semnalizării ligandului membrului 5 (CD40) al superfamiliei receptorului TNF (Verma și colab., 2003 ). În plus, sa demonstrat că rezistina induce pentraxina 3, un mediator inflamator implicat în ateroscleroză, în celulele endoteliale umane (Kawanami și colab., 2004).
Rezistina în sine este o adipokină și s-a constatat că induce expresia citokinelor și chemokinelor în condrocitele articulare umane (Zhang și colab., 2010). S-a demonstrat că rezistina induce expresia ARNm a 20 de citokine și chemokine testate în condrocite umane normale, precum și în condrocite din zona conservată a cartilajului osteoartritic; acestea au inclus TNF-a, IL-1α, IL-1β, CCL2, CCL3, CCL3L1, CCL4, CCL5, CCL8, CXCL1, CXCL2 și CXCL3. Pentru a explora mecanismele potențiale prin care rezistina induce reglarea în sus a chemokinelor și citokinelor inflamatorii din condrocite, s-a efectuat analiza computațională asupra genelor exprimate diferențial; s-a constatat că genele care au fost cele mai puternic reglate în sus au un factor de legare a factorului nuclear kappa-lanțul ușor de amplificare a celulelor B activate (NFκB), care a fost confirmat folosind un constructor reporter NF NB luciferază în condrocite umane. Între timp, sa constatat că factorul de transcripție C/EBPβ are un scor mare de legare și cotransfecția vectorului de expresie C/EBPβ a îmbunătățit activitatea promotorului CCL3 și CCL4. Luate împreună, aceste date sugerează că NFκB și C/EBPβ ar putea juca roluri cheie în nivelul ridicat al expresiei citokinelor și chemokinelor în condrocitele umane după tratamentul cu rezistină.
Rezistență și funcția endotelială
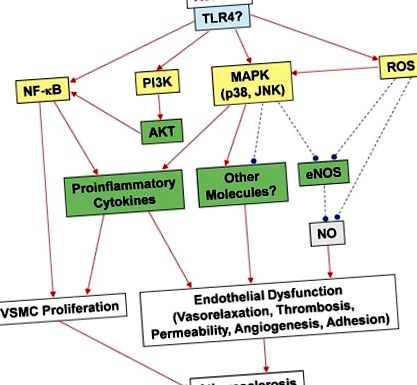
Recent, am investigat dacă rezistina afectează funcțiile endoteliale prin afectarea sistemului endotelial de oxid nitric sintază (eNOS) din celulele endoteliale ale arterei coronare umane (HCAEC) (Chen și colab., 2010). eNOS a fost selectat pentru investigație datorită rolurilor sale importante în controlul tonusului vascular și neovascularizării (Palmer și colab., 1987; Murohara și colab., 1998; Chen și colab., 2010). În studiul nostru, concentrațiile relevante din punct de vedere clinic ale rezistenței au redus semnificativ nivelurile de ARNm eNOS, proteine și activitate, precum și stabilitatea ARNm eNOS și nivelurile celulare de NO. Nivelurile celulare ale speciilor reactive de oxigen (ROS), incluzând anionul superoxid, au fost semnificativ crescute în HCAEC tratate cu rezistență, în timp ce potențialul membranei mitocondriale și activitățile catalazei și superoxidului dismutază au fost reduse în comparație cu celulele netratate. Antioxidanții au blocat efectiv reglarea descendentă a eNOS indusă de rezistină.
Un studiu recent al efectelor rezistinei asupra funcției vasculare și vasorelaxării evocate de insulină a constatat că administrarea de rezistență la șoareci C57BL/6 tineri și bătrâni și la celule endoteliale cultivate afectează semnificativ vasodilatația evocată de insulină dependentă de doză prin reducerea activității enzimatice eNOS. in vivo și in vitro (Gentile și colab., 2008). Sa demonstrat anterior că insulina induce vasodilatație prin eliberare de NO mediată de eNOS (Zeng și Quon, 1996). Efectele rezistinei din acest studiu au fost specifice insulinei asupra acțiunii vasculare, deoarece vasodilatația indusă de creșterea dozelor de acetilcolină sau nitroglicerină nu a fost influențată de rezistină (Gentile și colab., 2008). În plus, s-a determinat că fosforilarea AKT și eNOS evocată de insulină cu rezistență în celulele endoteliale și fosforilarea tirozină/serină a receptorului de insulină 1, alterând ulterior interacțiunea sa cu PI3K și întrerupând astfel calea pro-vasorelaxantă. Aceste studii colective demonstrează că rezistina modifică funcțiile vasomotorii coronariene atât in vivo cât și in vitro. Sunt necesare mai multe studii pentru a defini mai clar rolurile și căile prin care rezistența influențează fiziologia coronariană și formarea bolilor vasculare.
Rezistină și tromboză
Tromboza apare atunci când se formează cheaguri în interiorul unui vas de sânge, obstrucționând fluxul de sânge prin sistemul circulator. Acest lucru poate apărea atunci când un vas de sânge este rănit, rezultând recrutarea de trombocite și fibrină în zona rănită, care formează un cheag de sânge pentru a preveni pierderea de sânge. Dovezi în creștere sugerează un rol central al trombozei în progresia și complicațiile aterosclerozei, iar tromboza a fost legată de apariția clinică a SCA (Libby și Aikawa, 2002; Libby și colab., 2002). O serie de studii experimentale și clinice indică faptul că factorul tisular (TF) joacă un rol esențial în fiziopatologia SCA prin declanșarea formării trombilor intracoronari în urma unei leziuni endoteliale (Wilcox și colab., 1989; Pawashe și colab., 1994; Anexa și al., 1995; Ragni și colab., 1996). Mai multe studii au arătat că rezistina poate spori formarea trombului în timpul formării plăcii aterosclerotice. De exemplu, s-a demonstrat că tratamentul HCAEC cu rezistină determină o reglare crescută a expresiei TF, care pare a fi mediată de radicalii fără oxigen și activarea factorului de transcripție NFκB, promovând astfel o stare pro-trombotică (Calabro și colab ., 2011).
Deși în prezent nu există dovezi directe pentru un rol al rezistinei în formarea trombului, rezistina poate fi implicată în tromboză prin reglarea enzimei eNOS. eNOS generează în mod constitutiv NO în endoteliu prin conversia L-argininei pentru a forma L-citrulină și NO. Molecula de semnalizare NO relaxează VSMC, controlând astfel tonusul vascular. NO a fost, de asemenea, implicat în agregarea și adeziunea plachetară in vitro; între timp, rolurile NO și ale celorlalte trei enzime NOS (eNOS, iNOS și nNOS) sunt încă sub investigare in vivo. Moore și colab. (2011, 2010) au investigat rolul eNOS la șoareci și au constatat că NO endogen derivat din eNOS joacă un rol critic în reglarea funcției plachetare in vivo. Autorii au descoperit că eNOS joacă un rol semnificativ în agregarea trombocitelor, în timp ce iNOS și nNOS par să aibă roluri minime în acest proces. Prin urmare, regulatorii în amonte și în aval ai eNOS, cum ar fi rezistina, ar putea reprezenta ținte importante pentru efectele antitrombotice; acest lucru trebuie evaluat în continuare prin modele experimentale adecvate. Deoarece dovezile crescânde indică faptul că rezistina participă la patogeneza aterosclerozei, rolul rezistinei în tromboză merită o investigație suplimentară.
Rezistina și angiogeneza
Efectele rezistinei murine asupra angiogenezei au fost investigate, de asemenea; efectele rezistinei asupra angiogenezei pot fi mediate de inductorul slab al apoptozei asemănător TNF-α (TWEAK), ale cărui niveluri s-au dovedit a fi crescute semnificativ în celulele endoteliomului b.End5 de șoarece după tratamentul cu rezistină. Între timp, s-a constatat că neutralizarea TWEAK blochează proliferarea și migrația celulelor mediate de rezistină (Robertson și colab., 2009b). Proteina TWEAK solubilă exercită răspunsuri proinflamatorii și angiogene și sa constatat că promovează formarea vaselor de sânge într-un test de angiogeneză a corneei de șobolan; de asemenea, s-a dovedit că o expresie a TWEAK și a receptorului său specific, Fn14 (receptorii moleculei 14 inductibile de FGF), au fost reglate în sus în leziunile și bolile cronice ale țesuturilor, inclusiv artrita reumatoidă (RA) și ischemia cerebrală (Burkly et al., 2007). În consecință, Robertson și colab. a concluzionat că expresia reglată în sus a TWEAK poate contribui la creșterea inflamației și a angiogenezei în timpul formării ateromului (2009b).
Mecanismele din spatele creșterilor induse de rezinina murină în migrația și încolțirea celulelor endoteliale au fost determinate să implice fosforilarea PI3K/AKT și NKκB pe baza abolirii proprietăților angiogene ale celulelor tratate cu rezistină după inhibarea specifică a acestor mediatori. S-a descoperit că calea Akt/I-κβ-kinază promovează expresia genei angiogenă și metastatică în cancerul colorectal prin activarea NFκB și a β-cateninei (Agarwal și colab., 2005). Între timp, PI3K/Akt induce activarea NFκB și producerea VEGF în celulele epiteliale murine (Li și colab., 2005). Astfel, rezistina murină poate influența angiogeneza și poate contribui la dezvoltarea metastazelor canceroase. Între timp, ameliorarea angiogenezei a fost intens investigată ca posibil instrument terapeutic în tratarea bolilor cardiace ischemice, chiar dacă angiogeneza și neovascularizarea intimă au fost propuse ca evenimente pro-aterosclerotice (Carmeliet, 2005; Khurana și colab., 2005); deci, este important să se elucideze în continuare rolul rezistinei asupra angiogenezei în aceste condiții. În timp ce dovezile crescânde sugerează că rezistina joacă un rol în promovarea formării BCV, este posibil ca investigarea rolului său în angiogeneză să ofere informații clinice utile pentru tratamentul bolilor cardiace ischemice.
Funcția de rezistență și celulă a mușchiului neted vascular
Celulele musculare netede vasculare formează straturi în peretele vasului și controlează fluxul sanguin prin contractare sau relaxare ca răspuns la stimuli externi. VSMC nu proliferează în condiții fiziologice normale. Cu toate acestea, ca răspuns la leziuni sau stimuli inflamatori, VSMC încep să crească și să se divizeze. Proliferarea aberantă a VSMC poate duce la modificări patologice în pereții vaselor (Boettger și colab., 2009). Într-adevăr, s-a constatat că rezistina induce proliferarea celulelor musculare netede aortice umane într-o manieră dependentă de doză, iar aceasta pare a fi mediată de căile de semnalizare ERK1/2 și Akt (Calabro și colab., 2004).
Resistin promovează, de asemenea, migrarea VSMC (Jung și colab., 2006; Jiang și colab., 2009). S-a demonstrat că homocisteina se acumulează în țesutul adipos și induce expresia rezistinei (Li și colab., 2008). Recent, s-a demonstrat că expresia rezistinei indusă de homocisteină stimulează migrația VSMC într-un adipocit - cocultură VSMC; ARN de interferență mică (siARN) împotriva rezistenței migrația VSMC atenuată semnificativ în sistem. Migrația VSMC pare să fie mediată de modificări cito-scheletice induse de rezistină și de activarea integrinei α5β1 printr-o cale de aderență focală kinază/paxilină-Rasină cu aderență focală kinază/paxilină-Ras 1 (Jiang et al., 2009). Îmbunătățirea proliferării și migrației VSMC exercitată de rezistină oferă dovezi suplimentare ale interacțiunii dintre această adipokină și celulele vasculare și aceasta poate reprezenta un factor important în modificările patologice ale vaselor.
Considerații terapeutice
Rezistina este o citokină proinflamatorie și efectul său este mediat de TNF-α (Silswal și colab., 2005). Prin urmare, efectul tratamentului anti-TNF-α a fost investigat la pacienții cu RA, o boală inflamatorie cronică. Administrarea infliximabului, un anticorp monoclonal anti-TNF-α, a dus la o reducere semnificativă a nivelurilor serice de rezistină la pacienții cu RA (Gonzalez-Gay și colab., 2008).
Alimentele îmbogățite cu acid folic au fost folosite pentru a reduce nivelul plasmatic de homocisteină, iar hiperhomocisteinemia este un factor de risc bine cunoscut pentru BCV. Efectele consumului de acid folic asupra nivelurilor serice de rezistență și sănătatea endotelială au fost astfel studiate într-un model de șoarece. Consumul de acid folic cu doze mari (71 µg · kg −1) a determinat o reducere semnificativă a nivelurilor de rezistină la șoarecii diabetici obezi (Seto și colab., 2010). Între timp, acidul oleic, acidul gras monoinsaturat predominant al uleiului de măsline, s-a dovedit, de asemenea, că reduce expresia genei rezistinei în adipocitele izolate (Rea și Donnelly, 2006).
Terapia care vizează reducerea nivelurilor serice de rezistină este o strategie promițătoare pentru traducerea clinică a cunoștințelor noastre în curs de dezvoltare despre rolul rezistinei în formarea bolii. Mai exact, dacă se confirmă că rezistența joacă roluri cheie în sensibilitatea la insulină, diabet, MetS, diferite forme de BCV, tromboză și disfuncție a celulelor endoteliale și macrofage, rezistina ar putea fi o țintă terapeutică utilă pentru BCV. În plus față de antiinflamatoare și statine, noile medicamente care vizează în mod specific rezistina pot include oligonucleotide antisens, anticorpi și inhibitori moleculari mici. Mai mult, dacă căile de semnalizare induse de rezistență sunt clar trasate, ținte suplimentare din aval de rezistență ar putea fi evaluate pentru inhibare prin dezvoltarea medicamentului. În mod clar, acesta este un domeniu interesant pentru viitorul studiu și traducerea descoperirilor științifice de bază în aplicația clinică.
rezumat
- Obezitatea și excesul de greutate conduc la mortalitatea prematură a bolilor cardiovasculare, descoperă cercetările
- Obezitatea ca etiologie a bolii, tratament și considerații de management pentru pacientul obez -
- Relația dintre grăsimea viscerală și factorii de risc ai bolilor cardiovasculare Tanno și Sobetsu
- Răspunsuri la un sondaj de familie controverse actuale în dietă și boli cardiovasculare Familia BMC
- Băuturi răcoritoare, aspartam și riscul de cancer și boli cardiovasculare