Abstract
Calea insulinei/factorului de creștere asemănător insulinei (IGF-1) conduce o rețea conservată evolutiv care reglează durata de viață și longevitatea. Persoanele cu sindrom Laron care poartă mutații în receptorul hormonului de creștere (GHR) gena care duce la un deficit congenital sever de IGF-1 cu scăderea insulinei/semnalizarea IGF-1 (IIS) prezintă rate de prevalență reduse ale acneei, diabetului și cancerului. Dieta occidentală cu aport ridicat de carbohidrați hiperglicemici și lactate insulinotrope supra-stimulează IIS. Reducerea IIS la subiecții Laron demască rolul potențial al IIS hiperactiv persistent mediat de dieta occidentală în dezvoltarea bolilor civilizației și oferă o perspectivă rațională pentru ajustările dietetice cu diete mai puțin insulinotrope, cum ar fi dieta paleolitică.
Introducere
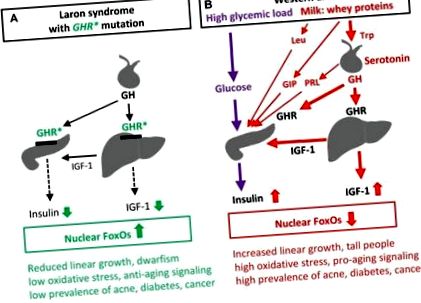
Recent, Guevara-Aguirre și colab a raportat la 99 de persoane ecuadoriene cu sindromul Laron din cauza receptorului hormonului de creștere (GHR) deficit și deficit congenital de factor de creștere de tip insulină-1 (IGF-1), care nu au dezvoltat diabet de tip 2 (T2D) și au fost aproape fără cancer, spre deosebire de rudele lor sănătoase cu insulină normală/semnalizare IGF-1) [ 1]. Un sondaj recent la nivel mondial al lui Steuerman și colab a demonstrat că niciunul dintre 230 de indivizi cu sindrom Laron nu a dezvoltat cancer [2]. Sindromul Laron este un experiment foarte informativ al naturii și descoperă legătura dintre IIS scăzut și protecția aferentă împotriva bolilor civilizației în contrast cu IIS exagerat indus de dieta occidentală, așa cum se arată în Figura 1.
Impactul semnalizării insulinei/IGF-1 în sindromul Laron (A) și dieta occidentală (B) asupra reglării genei mediate de FoxO și a patologiilor asociate. GHR *, pierderea mutației funcției receptorului hormonului de creștere în sindromul Laron; GIP, polipeptidă insulinotropă dependentă de glucoză, o incretină indusă de proteinele din zer, care stimulează proliferarea celulelor β și secreția de insulină; PRL, prolactină; Secreția PRL este indusă de semnalizarea hipotalamică serotoninergică; Trp, triptofan și Leu, leucină, aminoacizi esențiali îmbogățiți în proteina din zer α-lactalbumină; Trp prin sinteza serotoninei stimulează secreția pituitară de GH și PRL, iar Leu stimulează proliferarea celulelor β și secreția de insulină.
Semnalizarea insulinei/IGF-1/FoxO la organismele neumane
Patogeneza bolilor legate de vârstă a fost asociată cu o capacitate afectată de a contracara leziunile celulare induse de stresul oxidativ. În T2D, unele dintre consecințele unui mediu oxidativ sunt dezvoltarea rezistenței la insulină, disfuncția celulelor β, toleranța afectată a glucozei și disfuncția mitocondrială [8]. Stresul oxidativ, implicat în etiologia cancerului, rezultă dintr-un dezechilibru în producția de specii reactive de oxigen (ROS) și protecția antioxidantă a celulei. ROS dereglează homeostazia redox și promovează formarea tumorii prin inițierea unei inducții aberante a rețelelor de semnalizare care cauzează tumorigeneză [9]. Proteinele FoxO sunt regulatori esențiali ai rezistenței la stres oxidativ și activează expresia superoxidului de mangan dismutază și catalazei [5]. Mai mult, FoxO1 la nivel de promotor induce expresia Hmox1 (hemoxigenaza 1) scăzând astfel respirația mitocondrială și formarea ROS [5]. Astfel, creșterea IIS cu niveluri FoxO nucleare reglementate în jos afectează eliminarea adecvată a ROS, un mecanism critic implicat în promovarea acneei, T2D și cancerului.
Semnalizare insulină/IGF-1/FoxO și diabet de tip 2
FoxO1 inhibă proliferarea celulelor β [10]. Modificările nutriționale ale activității transcripționale FoxO1 cu celule β sunt mediate predominant prin secreția de insulină stimulată de glucoză și semnalizarea receptorilor de insulină. Recent, conceptul de „diapauză metabolică” a fost propus pentru modificările induse de FoxO1 pentru a proteja celulele β împotriva stresului oxidativ care stă la baza conceptului de odihnă a celulelor β ca obiectiv de tratament în T2D [11]. Astfel, FoxO1, punctul de convergență al IIS, orchestrează proliferarea celulelor β și apoptoza, ambele crescând în T2D [12].
Semnalizare insulină/IGF-1/FoxO și cancer
GH, IGF-1 și insulina au acțiuni de promovare a cancerului, iar nivelurile serice crescute de IGF-1 au fost asociate cu un risc crescut de cancer de prostată, sân și colorectal [13]. Steuerman și colab a efectuat un amplu sondaj la nivel mondial cu privire la prevalența cancerului la pacienții cu diverse cauze ale deficitului congenital secundar de IGF-1 și a confirmat că subiecții cu sindrom Laron cu deficit congenital de IGF-1 par protejați de dezvoltarea cancerului [2]. IIS reglementează distribuția nucleară a proteinelor FoxO care sunt considerate din ce în ce mai mult ca reprezentând ținte celulare unice îndreptate împotriva cancerului uman în lumina efectelor lor pro-apoptotice și a capacității lor de a duce la stoparea ciclului celular [5, 14]. FoxO-urile sunt implicate în controlul angiogenezei, proliferării celulelor stem, aderenței celulelor, răspunsurilor la stres oxidativ, precum și imunității înnăscute și dobândite. Creșterea permanentă a IIS cu reducerea consecutivă a nivelurilor nucleare de FoxO poate promova astfel dezvoltarea cancerului [14].
Semnalizare insulină/IGF-1/FoxO și acnee
Dieta occidentală potențează semnalizarea insulinei/IGF-1
Alimentele pe bază de cereale, zaharurile și produsele lactate sunt elementele esențiale ale dietei occidentale. Dietele cu sarcină glicemică mare au fost recunoscute ca factori agravanți ai acneei, în timp ce o dietă cu sarcină glicemică scăzută a îmbunătățit acneea și a scăzut biodisponibilitatea IGF-1 liber în plasmă [21].
Laptele și produsele lactate fermentate care conțin proteine din zer prezintă un nivel ridicat indicele insulinemic în comparație cu conținutul lor scăzut de carbohidrați [22]. Acest fenomen pare să fie secretul IIS al laptelui de mamifer, un program furnizat în mod evolutiv pentru promovarea creșterii neonatale [16]. Consumul de lapte de vacă la om deplasează axa somatotropă la niveluri mai ridicate și crește semnificativ nivelurile serice de GH și IGF-1 [23] (Figura 1B). S-a demonstrat că ingerarea orală a proteinei din zer α-lactalbumină crește axa somatotropă la femeile sănătoase. Există dovezi epidemiologice puternice că consumul de lactate crește semnificativ nivelurile serice de IGF-1 la om [24]. Aceasta explică de ce aportul mare de lapte crește creșterea liniară [25]. În schimb, statura scurtă este o trăsătură caracteristică a deficitului congenital de IGF-1 în sindromul Laron. Astfel, dieta occidentală mută axa GH/IGF-1 la niveluri anormal de ridicate, exact în direcția opusă a IIS scăzut observat în sindromul Laron [1, 2] (Figura 1).
Semnalizarea exagerată a insulinei/IGF-1 prin dieta occidentală și diabetul de tip 2
Rezistența la insulină și hiperinsulinemia sunt trăsături caracteristice ale sindromului metabolic. Consumul extins de alimente hiperglicemice cu transducție crescută a semnalului mediată de glucoză către celulele β pancreatice este un factor major de proliferare a celulelor β mediate de glucoză/FoxO1 și răspunsuri afectate de stres oxidativ ale celulelor β [8-11].
Consumul de lapte după perioada de înțărcare menține niveluri ridicate de IIS stimulând persistent proliferarea celulelor β pancreatice [26]. Supra-stimularea continuă a celulelor β pancreatice prin IIS condus de proteine din zer după perioada de după înțărcare poate diminua continuu nivelurile nucleare de FoxO, promovând astfel deteriorarea stresului oxidativ al celulelor β, rezultând în cele din urmă debutul precoce al senescenței celulare β-celulare și apoptoza [26]. Într-adevăr, proliferarea crescută și apoptoza celulelor β pe parcursul vieții sunt semnele distinctive ale T2D [12].
Semnalizarea insulinei exagerate/IGF-1 a dietei occidentale și a cancerului
Creșterea IIS a fost implicată pentru a juca un rol important în majoritatea tipurilor de neoplazie epitelială [13, 27]. Niveluri mai mari de IGF-1 în ser au fost asociate cu un risc crescut de deces prin cancer la bărbații mai în vârstă care locuiesc în comunitate [28]. Pe de altă parte, subiecții cu sindrom Laron exemplifică faptul că IIS scăzut este asociat cu o prevalență scăzută a cancerului [1, 2]. Cu toate acestea, trebuie menționat faptul că subiecții Laron nu trăiesc mai mult decât subiecții normali care iau o dietă occidentală și, dacă nu sunt tratați corespunzător, mor de boli cardiovasculare.
Concluzie și perspective de viitor
Sindromul Laron cu scăderea IIS este asociat cu o prevalență redusă de acnee, T2D și cancer. În schimb, IIS-ul reglementat de dieta occidentală pare să promoveze dezvoltarea bolilor cronice ale civilizației. Dieta paleolitică, care exclude carbohidrații hiperglicemici și lactatele insulinotrope, a fost introdusă cu succes pentru prevenirea și tratamentul acneei, T2D și bolilor cardiovasculare [16, 29]. Ar trebui întreprinse eforturi viitoare pentru scăderea indicelui insulinemic ridicat al laptelui (I.I. 140) și al altor produse lactate pe bază de zer pentru a atinge valori ale cărnii de vită (I.I. 51) sau brânză (I.I. 45) [16, 29]. Mai mult, ar trebui restricționate combinațiile de carbohidrați hiperglicemici și lactate insulinotrope cu efecte potențiale asupra IIS.
Persoanele cu polimorfisme genetice cu nucleotide unice (SNP) care rezultă în IIS hiperactiv pot prezenta un risc special pentru dezvoltarea bolilor legate de vârstă, predominant atunci când IIS-ul lor intrinsec ridicat este suprapus de IIS exagerat al dietei occidentale. În mod curios, variațiile genetice cu IIS redus datorită SNP-urilor componentelor care interacționează ale cascadelor IIS (GH1, IGF1, IGF1R, IRS1, FoxO1A, FoxO3A) și au fost asociate cu o longevitate crescută [30, 31]. Astfel, cercetările viitoare ar trebui să ia în considerare impactul interacțiunii genetice intrinseci, precum și a factorilor dietetici extrinseci implicați în reglarea IIS.
Accesul la cantități mai mari de alimente insulinotrope și crescătoare de IGF-1 (zahăr, cereale și lactate) a avut loc în urmă cu aproximativ 10.000 de ani în timpul Revoluția neolitică și a fost suplimentat în continuare de Revolutia industriala. Cu toate acestea, este posibil ca genomul uman să nu se fi adaptat la această „trecere recentă” la IIS mai mare determinat de dieta occidentală. Conform datelor ADN-ului mitocondrial, oamenii moderni cu o structură genomică aproape similară au trăit acum aproximativ 200.000 de ani și au consumat o dietă paleolitică mai puțin insulinotropă. În acest sens, s-a propus să ne adaptăm din nou nutriția la caracteristicile benefice ale dietelor noastre pre-agricole [32]. Momentul introducerii unei diete paleolitice bine echilibrate poate fi o problemă specială de îngrijorare, deoarece IIS adecvat este important pentru funcția sistemului de reproducere și a sistemului nervos central. Cu toate acestea, la vârsta adultă, restricțiile dietetice care scad IIS pot reduce riscul de patologie asociată vârstei, cum ar fi proteotoxicitatea, după cum sa demonstrat recent într-un model de șoarece al bolii Alzheimer [33].
Abrevieri
subunitate catalitică a PI3K a C. elegans
- Dieta cu gorile occidentale STORRE O sinteză din șase situri
- Zahărul este acum dușmanul numărul unu în dieta occidentală - Business Insider
- Trecerea la o dietă sănătoasă împiedică efectele dăunătoare ale dietei occidentale într-o
- Shocker Lumea de Vest; Dieta face ca toată lumea să fie înțeleaptă
- Bacteriile orale pot declanșa bolile intestinale, mănâncă o dietă prietenoasă cu intestinele pentru a reduce riscul