Departamentul de Științe Medicale de Bază, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Chimie Medicinală și Farmacologie Moleculară, Colegiul de Farmacie, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Științe Clinice Veterinare, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Științe Medicale de Bază, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Patobiologie Veterinară, Centrul pentru Cancer, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Științe ale Animalelor, Colegiul de Agricultură, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Științe ale Animalelor, Colegiul de Agricultură, Universitatea Purdue, West Lafayette, Indiana, SUA
Institutul cardiovascular, Universitatea din Pittsburgh, Pittsburgh, Pennsylvania, SUA
Departamentul de Științe Medicale de Bază, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Acești autori au contribuit în mod egal la această lucrare. Căutați mai multe lucrări ale acestui autor
Departamentul de Științe Medicale de Bază, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Acești autori au contribuit în mod egal la această lucrare. Corespondență: Școala de Medicină Veterinară, Universitatea Purdue, 625 Harrison St., West Lafayette, IN 47907, SUA. E-mail: [email protected] Căutați mai multe lucrări ale acestui autor
Departamentul de Științe Medicale de Bază, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Chimie Medicinală și Farmacologie Moleculară, Colegiul de Farmacie, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Științe Clinice Veterinare, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Științe Medicale de Bază, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de patobiologie veterinară, Centrul pentru cancer, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Științe ale Animalelor, Colegiul de Agricultură, Universitatea Purdue, West Lafayette, Indiana, SUA
Departamentul de Științe ale Animalelor, Colegiul de Agricultură, Universitatea Purdue, West Lafayette, Indiana, SUA
Institutul cardiovascular, Universitatea din Pittsburgh, Pittsburgh, Pennsylvania, SUA
Departamentul de Științe Medicale de Bază, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Acești autori au contribuit în mod egal la această lucrare. Căutați mai multe lucrări ale acestui autor
Departamentul de Științe Medicale de Bază, Școala de Medicină Veterinară, Universitatea Purdue, West Lafayette, Indiana, SUA
Acești autori au contribuit în mod egal la această lucrare. Corespondență: Școala de Medicină Veterinară, Universitatea Purdue, 625 Harrison St., West Lafayette, IN 47907, SUA. E-mail: [email protected] Căutați mai multe lucrări ale acestui autor
ABSTRACT
Atrofia mușchilor keletali, o reducere a conținutului de proteine contractile și a forței musculare, poate rezulta din deteriorarea mușchilor, boli, neutilizare sau îmbătrânire (1-4); debilitarea rezultată poate compromite serios calitatea vieții. Terapia fizică și administrarea factorilor de creștere (5), inhibitori ai proteolizei (6) sau stimulatori ai sintezei proteinelor (7) sunt metode studiate pentru tratarea atrofiei; cu toate acestea, sunt necesare tratamente mai eficiente. Calea proteazomului ubiquitin (UPP), prin care substraturile proteice sunt degradate (8), este proeminentă printre mecanismele cunoscute pentru a modula atrofia mușchilor scheletici; cu toate acestea, se știe puțin despre factorii care activează această cale.
MATERIALE ȘI METODE
Animale Toate procedurile au fost aprobate de Comitetul de îngrijire și utilizare a animalelor Purdue. ND4 - Șoarecii elvețieni Webster (Harlan - Sprague, Indianapolis, IN) au fost utilizați în toate procedurile, cu excepția studiilor tumorale care au folosit șoareci atimici (NCr - nu; Harlan - Sprague). Animalele au fost adăpostite în facilitățile Universității Purdue, monitorizate de medicii veterinari de laborator și au furnizat hrană și apă ad libitum.
Suspensia membrelor posterioare
Cuștile suspendate personalizate au fost construite așa cum s-a descris anterior (16). Șoarecii au fost așezați în aceste cuști, odihnindu-se într-o înclinare de aproximativ 30 ° cu capul în jos, cu membrele posterioare ridicate, astfel încât nu au putut să pună nicio sarcină pe membrele posterioare. Șoarecii martori au fost ținuți în cuști de șoarece comerciale într-o stare normală cu greutate.
Inducerea tumorii
Kb celule canceroase esofagiene umane (7000 celule/100 pl de mediu RPMI cu 10% FBS și 1% glutamină; 17) au fost implantate subcutanat (s.c.) în axila dreaptă a șoarecilor atimicin= 8; NCr - nu; Harlan-Sprague). Șoareci de control (n= 8) au fost injectate cu vehicul. Șoarecii au fost cântăriți săptămânal timp de 6 săptămâni. Tumorile au fost măsurate cu un etrier digital o dată la două săptămâni.
Western blot
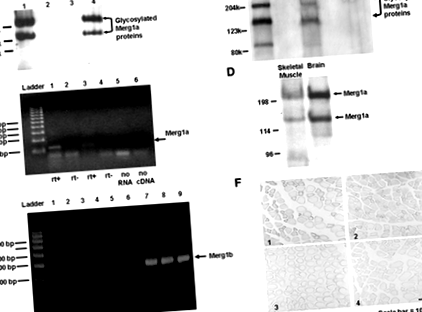
Pentru imunobloti, proteinele de membrană au fost extrase din mușchii gastrocnemius și creier (14). Probele au fost imunoblotate folosind anticorp erg1 (Ab) (14). După ștergere, membranele au fost colorate cu 0,1% Coomassie R-250 pentru a confirma că probele de membrană conțin proteine egale.
Secțiuni de țesut și colorare
Mușchii gastrocnemius au fost pregătiți și crio-secționați (14 µm) așa cum s-a descris anterior (16). Secțiunile au fost colorate pentru activitatea β-galactozidazei (lacZ) (16) sau imunocolorate (16) folosind erg1 Ab (14), cu excepția cazului în care se menționează. Imaginile secțiunilor au fost capturate cu o cameră digitală Leaf Micro - Lumina (Scitex; Tel - Aviv, Israel). Numărul de pixeli al fiecărei secțiuni transversale a fibrelor musculare a fost determinat (Adobe Photoshop 6) și transformat în µm 2. Au fost analizate două secțiuni (câte 50 de fibre) din fiecare secțiune a mușchiului.
Plasmide
Clonele Mergla (10), Merg1b (10) și DN - Mergla (G628S; 15) au fost în pBK/citomeglovirus (CMV). Luciferaza cu licurici ubiquinată (Ub - FL) din pGL - 3/CMV a fost un cadou de la Dr. David Piwnica - Worms (18; Washington University, St. Louis, MO). Vectorul CMV - nlacZ în pNL a fost achiziționat de la Centrul Comercial de Gros (Toulouse, Franța). PhRL sintetic Renilla vectorul reporter luciferază (RL) a fost achiziționat de la ProMega (Madison, WI).
Electroporare
Șoarecii au fost anesteziați cu 0,01 μl/mg în greutate corporală de xilazină (1 mg/ml) și ketamină (9 mg/ml) în ser fiziologic steril. Mușchii Gastrocnemius ai membrelor posterioare bărbierite au fost injectați cu plasmide și electroporați cu 8 impulsuri la 200V/cm timp de 20 ms la 1 Hz (19) cu o matrice extracelulară (ECM) 830 ElectroSquare Porator (BTX; Hawthorne, NY).
Reacție în lanț a polimerazei cu transcripție inversă (RT - PCR)
RT-PCR a fost efectuat așa cum s-a descris anterior (16), cu excepția faptului că ADN-ul contaminant a fost îndepărtat din extractul total de ARN prin două tratamente de 10 minute cu DNază I (ProMega). Probele de ARN duplicat au fost expuse fie la reverstranscriptază, fie numai la vehicul. Probele de control șablon nu au primit ARN. Produsul de transcriere inversă a fost amplificat cu PCR, combinat cu bromură de etidiu și electroforizat pe un gel de agaroză 2%. Exemple pentru Mergla au fost: 5′– CGC AGA ACA CCT TCC TCG ACAC - 3 ′ (înainte) și 5′– GCA GAA GCC GTC GTT GCA GTA G - 3 ′ (invers). Grundele pentru Merg1b au fost: 5 ′ - AGT CCT CCA TGG CGA TTC - 3 ′ (înainte) și 5 ′ - GGC CTG CAG CTT ATA CTC - 3 ′ (invers).
Astemizol (Sigma, St. Louis, MO)
Antihistaminicul astemizol (20) a fost suspendat în apă.
Șoarecii au fost anesteziați cu un corp de 240 mg/kg în greutate i.p. injecție de 20 mg/ml Avertin (2, 2, 2 - tribromoetanol; Sigma) într-o soluție de 1,25% alcool terț-amilic în soluție salină (21). Un ECG cu plumb II standard a fost obținut prin plasarea electrozilor cu ac de calibru 18 s.c. în piciorul anterior drept (-), piciorul posterior stâng (+) și piciorul posterior drept (sol). ECG-urile au fost înregistrate (3 minute) folosind un sistem de înregistrare fiziologic Biopac MP100 multicanal (Biopac Systems Inc; Goleta). Intervalele QT au fost măsurate și corectate pentru ritmul cardiac folosind formula: QTC = QTo/(RRo/100) 0,5 (22).
Test de reporter dual luciferază
Kitul de analiză Dual - Luciferase Reporter (Promega) a fost utilizat în conformitate cu instrucțiunile producătorului. Luciferază licurică și Renilla luciferaza (RActivitățile L) au fost măsurate cu un luminometru TD - 20/20 (Promega).
Statistici
Datele au fost analizate de ANOVA pentru un design complet randomizat. Când s-au găsit diferențe semnificative, mijloacele au fost separate de Fisher's Protected Least - Diferența de semnificație. Toate datele au fost analizate utilizând procedura generală a modelului liniar al SAS. Declarațiile de semnificație s-au bazat pe P‐Livele așa cum sa menționat.
REZULTATE
Expresia tumorii induce sinteza și atrofia Mergla în mușchiul scheletic
La șase săptămâni după injectarea celulelor tumorale, greutatea medie a șoarecilor purtători de tumori (minus greutatea tumorii) a fost cu 10,8% (P≤0,005) mai mică decât șoarecii martor. Șoarecii cu expresie tumorală au avut 18% (P≤0.001) raportul greutății greutății corpului (1,10 ± 0,019%, sem) mai scăzut decât cel al șoarecilor martor (1,34 ± 0,018%, sem), demonstrând că șoarecii purtători de tumori au pierdut masa musculară. Suprafața medie a secțiunii transversale a fibrei musculare (csa) a mușchilor gastrocnemius stângi de la șoarecii purtători de tumori a fost cu 25% mai mică (P≤0,05) decât cea a șoarecilor martor (1445,8 ± 103,8 µm 2 sem vs.. 1925,0 ± 161,6 µm 2 sem, respectiv), demonstrând că șoarecii purtători de tumori au prezentat atrofie a mușchilor scheletici. Analiza Western blot a proteinelor de membrană extrase a detectat două proteine Mergla în mușchii scheletici cachectici ai șoarecilor, așa cum sa raportat anterior în creier și inimă (14; FIG. 1A). Nu a fost detectată proteină de canal Merg1 în țesutul de control (Fig. 1A).
Suspensia membrelor posterioare are ca rezultat atrofia și sinteza Mergla în mușchiul scheletic
Electroporarea are ca rezultat exprimarea ADN-ului plasmidic
Mușchii gastrocnemius stângi a 14 șoareci au fost injectați cu plasmidă de expresie care codifică Merg (30 ug; 10), în timp ce mușchii gastrocnemius stângi ai altor 14 șoareci au primit plasmida de expresie care codifică Merg1b (30 ug; 10). Gastrocnemii drepți ai tuturor șoarecilor au fost injectați cu plasmidă de expresie care codifică lacZ (30 pg; 10). Mușchii Gastrocnemius au fost electroporați pentru a facilita absorbția plasmidelor (19). După 7 zile, proteinele Mergla (14) au fost detectate în mușchii injectați Mergla prin analiza Western blot; aceste proteine nu au fost detectate în mușchiul control (FIG. 2A). O proteină Merg1b a fost detectată cu puțin peste 95 kDa la mușchii injectați cu plasmida Merg1b; această proteină a fost absentă din mușchiul de control (Fig. 2B).
Expresia Mergla la șoarecii purtători de greutate induce atrofia mușchilor scheletici
Mușchii gatrocnemius din stânga a 14 șoareci au fost injectați cu lacZ (20 ug) și plasmide de exprimare de control (40 ug). Mușchii gastrocnemii drepți ai șapte dintre acești șoareci au fost co-injectați cu Mergla (20 pg; 10), lacZ (20 pg) și plasmide de expresie ADN pBK/CMV de control (20 pg). Mușchii gastrocnemi adecți ai șoarecilor rămași (n = 7) au fost coinjectate cu trei plasmide de expresie, fiecare codificând fie: Mergla (20 µg; 10), lacZ (20 µg), fie un mutant Mergla negativ dominant (DN Mergla; 20 µg; 15). Produsul genei DN Mergla este un mutant al porilor care este transportat către membrana celulară, dar previne conducerea curentului Merg1 (15). Șoarecii au rămas în greutate. La șapte zile după electroporare, fibrele gastrocnemius care exprimă Mergla și lacZ (fibre albastre) au înregistrat o scădere semnificativă cu 16,3% a fibrei musculare csa în raport cu fibrele injectate numai cu plasmida lacZ (FIG. 3A1, 2; B1, 2). Blocarea funcției Mergla de către DN Mergla a împiedicat toate, cu excepția a 6,7% din atrofia indusă de expresia Mergla (Fig. 3A1, 3; B1, 3). Această salvare incompletă nu este surprinzătoare, deoarece nu este probabil ca toate canalele asamblate aleatoriu să conțină subunitate de canal mutant.
Blocarea funcției Mergla inhibă atrofia mușchilor scheletici indusă de suspensia membrelor posterioare
Expresia ectopică a Merg1b în mușchiul gastrocnemius nu induce atrofie
Mușchii gastrocnemius stângi a șapte șoareci au fost injectați cu plasmidă de expresie lacZ (20 µg) și plasmidă de expresie martor (30 µg), în timp ce gastrocnemii drepți au primit plasmidă de expresie lacZ (20 µg) și plasmidă de expresie Merg1b (30 µg; 10). La șapte zile după electroporare (19), nu a existat nicio diferență semnificativă în fibrele csa ale mușchiului control care exprimă lacZ singur (2456 ± 13 µm 2, sem) și cele care exprimă lacZ și Merg1b (2449 ± 16 µm 2, sem). Această constatare sugerează că scăderea semnificativă a dimensiunii fibrelor indusă de Merg1 este specifică variantei 1a.
Curba doză-răspuns a estizizol
Trei grupuri de câte trei șoareci au fost gavate o dată la fiecare 12 ore cu o suspensie de astemizol, un puternic blocant de canal erg1 (20); pentru a produce 80, 160 sau 320 mg/kg corp greutate. Un grup de control a fost gavat cu un volum egal. de apa. ECG-urile și greutățile animalelor au fost măsurate zilnic. În ziua a șaptea de tratament, intervalele QT corectate (QTc, 22) ale tuturor animalelor tratate au fost semnificativ mai lungiP≤0,02) decât cele din grupul de control, demonstrând că medicamentul a blocat canalul Merg1 în inimă. Deoarece pierderea în greutate a fost minimă și prelungirea QTc a fost maximă, 160 mg/kg au fost utilizate în studiul de suspensie.
Tratamentul cu Astemizol inhibă atrofia la șoarecii suspendați la nivelul membrelor posterioare și mărește dimensiunea mușchilor la controalele cu greutate
| Grupa 1: Control | 7,0 ± 0,12 a | 0,19 ± 0,006 a | 0,58 ± 0,033 a | 28,2 ± 0,5 a | 1900 ± 29,4 a |
| Grupa 2: Astemizol | 5,9 ± 0,6 a | 0,21 ± 0,005 b | 0,66 ± 0,015 b | 27,9 ± 0,4 a | 2025 ± 24,8 b |
| Grupa 3: Suspendare | −7,0 ± 1,5 c | 0.17 ± 0.160 c | 0,59 ± 0,018 a, c | 26,0 ± 0,9 b | 1610 ± 32,8 c |
| Grupa 4: Astemizol și suspensie | −4,2 ± 0,06 b | 0,19 ± 0,005 a | 0,63 ± 0,010 b, c | 29,8 ± 0,8 c | 1841 ± 29,4 a |
- Datele sunt raportate ca mijloace ± se. Declarațiile de semnificație se bazează pe P ≤ 0,05. Nu există diferențe statistice între grupurile etichetate cu aceeași literă într-o coloană. Diferite litere indică diferențe semnificative în cadrul unei coloane. QTc sunt similare cu cele raportate la șoareci anesteziați cu Avertin (21).
Expresia Mergla induce activitatea UPP
Inducerea activității UPP este specifică Mergla
Ambii mușchi gastrocnemius a 12 șoareci au fost coinjectați cu Ub - FL (40 µg; 18) și RL (10 pg) plasmide de expresie. Mușchii drepți gastrocnemius ai șase dintre acești șoareci au fost co-injectați cu plasmida de expresie Mergla (30 µg; 10), în timp ce mușchii drepți ai gastrocnemius ai celor șase șoareci rămași au fost coinjectați cu plasmida de expresie Merg1b (30 µg; 10). Mușchii gastrocnemius stâng au primit plasmida de control adecvată (30 (g). La șapte zile după electroporare (19), expresia ectopică a Mergla a crescut semnificativ activitatea UPP, dovadă fiind o scădere (80%) a activității relative a Ub-FL (Fig. 4B1, 2); cu toate acestea, expresia ectopică a Merg1b nu a crescut activitatea UPP, după cum a demonstrat o scădere nesemnificativă (9,4%) a raportului Ub - FL - la - RL (Fig. 4A1, 3), o cantitate care ar putea rezulta din asamblarea Merg1b subunitate cu niveluri scăzute de Mergla endogenă. Datele arată că Mergla, și nu Merg1b, crește în mod specific activitatea UPP.
DISCUŢIE
- Mecanisme pentru specificitatea fibrelor de atrofie a mușchilor scheletici
- Dieta Keto câștigă mușchi și pierde grăsime
- Cum să pierzi grăsimea din burtă pentru un mușchi bun; Fitness
- Cum să pierzi grăsimea și să câștigi mușchi în același timp Gro-Fit
- Cum să pierzi cel mai mult grăsime și să construiești cel mai mult mușchi în 30 de zile - Build-Muscle