J. Chil. Chem. Soc, 52, nr. 4 (2007), pp. 1314-1317
DEGRADARE A ACIDULUI POLIACRILIC DE REACTIVUL FENTON
AÍDA NEIRA 1, MIGUEL TARRAGA 2 ȘI ROSA CATALAN 2
1 Facultatea de Științe, Universidad del Bío-Bío, Avda. Collao 1202, Concepción, Chile.
2 Facultatea de Științe Chimice, Universitatea Concepție, Casilla 160-C, Concepción, Chile
Acidul poliacrilic (PAA) este degradat într-un mediu apos cu reactivul Fenton. La timpi de reacție lungi, 17 ore la 60 ° C, polimerul acidului acrilic suferă decarboxilare cu reactivul Fenton. La sfârșitul procesului de degradare, produsul polimeric s-a schimbat fizic, devenind un material neted amorf. A pierdut cristalinitatea inițială.
Datele DSC indică degradarea polimerului cu scăderea în greutate a produselor volatile ca o consecință a decarboxilării. Formarea macroradială care experimentează reacții de încrucișare, formând o structură mai stabilă, aceasta se indică prin procentul mai mic de pierdere în greutate.
În același timp, PAA cu reactiv Fenton la 5 și 17 ore, prezintă un exoterm la 418 ° C și respectiv 416 ° C. Aceasta indică degradarea produselor volatile și macrostructura liberă a polimerului.
Cuvinte cheie: Analiza FTIR, Comportament termic, Fenton, Acid poliacrilic.
INTRODUCERE
Polimerizarea radicală este una dintre cele mai frecvente metode de obținere a polimerilor acrilici 1-3. Sinteza super-absorbanților din monomeri acrilici se realizează folosind inițiatori radicali precum amoniu-persulfat, permanganat de potasiu, reactivul Fenton printre alte tipuri 4,5. Chimia Fenton este chemată la oxidarea substraturilor organice de fier (II) și peroxid de hidrogen. În 1894 a fost publicată o lucrare 6 cu oxidarea acidului tartric de peroxid de hidrogen în prezența fierului (II). Mecanismul reacției este un mecanism cu lanț în care fierul (II) este regenerat. În 1999, o nouă cercetare a reacției ionului feros cu peroxid de hidrogen a fost publicată de Kremer 7. Aceasta este o poveste despre mecanismul de oxidare a fierului (II) și a fierului (III) de către peroxidul de hidrogen. Mecanismul Kremer cu fier (II) în exces, evoluția oxigenului este neglijabilă. Cu peroxid de hidrogen în reacție excesivă cu Fe0 2+, se produce evoluția oxigenului în etapele inițiale. Iese posibilitatea ca mecanismul fierului (II) cu peroxid de hidrogen să nu implice deloc radicalii liberi.
În 1932, Bray și Gorin 8 au conectat reacțiile Fe (II) și Fe (III). Ei au propus evoluția oxigenului cu peroxid de hidrogen în exces. Astfel, au propus ca ionii feroși și ferilici atașați la peroxidul de hidrogen, dar nu și la ioni ferici. Acest mecanism explică descompunerea peroxidului de hidrogen în timpul oxidării foarte rapide a Fe (II) la Fe (III). Astfel, controversa continuă cu alții 9.10. Pentru a explica mecanismul lanțului de radicali liberi pentru descompunerea catalizată de fier (III) a rezultatelor experimentale ale peroxidului de hidrogen, au fost publicate. Kremer [11] a furnizat argumente suplimentare conform cărora radicalii hidroxil nu sunt importanți în chimia Fenton. Copolimerizarea prin altoirea monomerilor acrilici în diverși polimeri naturali și sintetici, cum ar fi celuloza, bumbacul și amidonul, utilizează inițiatorii radicali menționați anterior 12-13. Cu toate acestea, în studiul proceselor de polimerizare, s-a discutat puțin despre degradarea polimerului în centrul reacției. Acidul poliacrilic (PAA) este unul dintre polimerii cei mai utilizați pentru a modifica proprietățile polimerilor naturali și această macromoleculă are o degradare termică și oxidativă 2 la timpi de reacție lungi și temperaturi ridicate 14-16 .
J. Dong și colab. 20 raportează modificări dependente de temperatură pentru benzile de întindere C = 0 asociate grupului COOH de acid poli (acrilic) în intervalul 40 - 140 ° C. Cu temperatura crescută rezultă o reducere a intensității banda de absorbție, legătura C = 0 și altele. Efectul temperaturii în regiunea IR sub 1500, de ex. Sunt raportate și benzile 1451, 1248, 1178 și 902 cnr 1.
Pentru a studia acțiunea reactivului Fenton asupra PAA, reacția a fost efectuată în condiții de grefare a polimerizării acidului acrilic pe fibra de celuloză și produsele de reacție au fost obținute analizate la diferiți timpi de reacție pentru soluția apoasă de PAA pentru condițiile de pH, Fe +2 și H202 utilizat la altoirea acestuia pe polimerul natural.
EXPERIMENTAL
Prepararea soluțiilor de acid poliacrilic. Acidul poliacrilic (PAA) utilizat pentru prepararea soluțiilor are 1.250 Kdalton și aTg = 106 ° C Soluțiile apoase preparate sunt de 10 mM în Fe (II), 20 mM în peroxid de hidrogen, pH = 4,0 la 70 ° C și la reacții diferite ori. Produsele au fost obținute în vrac sub atmosferă de azot.
Probele au fost plasate la 105 ° C timp de 24 de ore. După ce au fost introduse într-un cuptor sub vid la 40 ° C timp de cel puțin o săptămână pentru a îndepărta apa reziduală și depozitate sub vid înainte de măsurători spectrale.
Spectroscopie cu infraroșu. Spectrele în infraroșu au fost obținute de un Nicolet Magna 550. Pulberile polimerului au fost preparate în pelete KBr.
Analiza termogravimetrică. Măsurătorile termice au fost efectuate folosind un Thermo balance Polymer Laboratories STA 625 și un calorimetru de scanare diferențială.
Microscopie electronică. Morfologia polimerilor a fost studiată folosind un instrument SEM, un AUTOSCAN U-1. Probele au fost tratate anterior cu aur.
REZULTATE SI DISCUTII
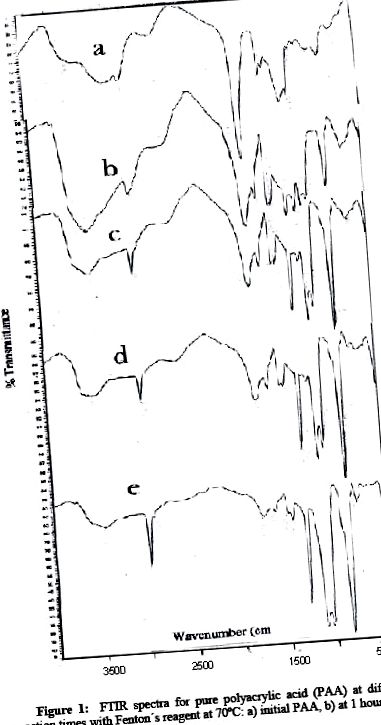
Figura 1 prezintă o compoziție a spectrului în infraroșu la timpi de reacție diferiți pentru PAA. După cum se poate observa în spectrele IR, benzile PAA medii până la slabe pentru 1714, 2960, 1260 și 804 v (cm -1), se schimbă la timpi de reacție lungi. Banda de v (cm -1) 1715 cm -1, caracteristică grupărilor carboxilice, se diminuează semnificativ după 5 ore de reacție, dispărând total la 17 ore. În plus, banda largă a legăturii de hidrogen cu hidroxil, caracteristică acestei grupe funcționale, la 3450 cm -1 în diminuează semnificativ. Cu toate acestea, benzile atribuite întinderii C-H (C sp 3) de 2960 v (cm 1), C = O de v (cm -1) 1260 și de balansare de metilen la v (cm 1) 840 cresc semnificativ. Ambele situații indică un proces de degradare a PAA care corespunde experimental unui produs cu polaritate și solubilitate mai reduse în mediul apos, indicând faptul că reactivul Fenton nu numai că formează radicali în acest mediu ca inițiator al reacției de altoire, dar este, de asemenea, acumulat ca decarboxilant în produsul dorit.
Tabelul 1 prezintă datele termogravimetrice ale PAA și ale produselor obținute la diferiți timpi de reacție. După cum se poate observa în tabelul 1, homopolimerul și produsele de reacție prezintă un proces de degradare în etape. În primul rând, un proces endoterm urmat de un proces exoterm. Este clar observabil că componentele termice și stabilitățile produselor de reacție sunt diferite de cele ale polimerului inițial. La 500 ° C, 85% din PAA s-a degradat, în timp ce doar 75% din produsele de reacție s-au descompus, indicând faptul că produsele de reacție cu reactivul Fenton prezintă o stabilitate termică mai mare decât polimerul inițial.
Figura 2 prezintă o secvență de micrografii ale acestui proces, din care se poate concluziona că morfologia materialului polimeric s-a schimbat semnificativ la perioade lungi de reacție, devenind un material amorf, neted, care a pierdut caracteristica cristalină a polimerului PAA inițial. Aceste date sunt de acord cu pierderea funcționalității prezentate în secvența spectrelor în infraroșu.
Figura 3 prezintă micrografii PAA pure și cristaline
Au fost discutate multe mecanisme de degradare a glucidelor 21. În oxidarea amilopectinei de amidon de porumb, depolimerizarea a fost însoțită de o oxidare rapidă și extinsă a unităților finale pentru a produce acid formic, acid oxalic și dioxid de carbon. Acest rezultat a susținut teoria conform căreia H202 atacă predominant unitățile finale reducătoare și siturile deja oxidate, de ex. grupuri oxo. Celuloza se comportă similar și depolimerizarea este urmată de degradarea în C02, acid formic, acid oxalic și acid D-arabinonic 22 .
Degradarea Ruff 23 oxidând sarea unui acid aldonic la următoarea aldoză inferioară și COr. Degradarea Ruff este cunoscută în general pentru scurtarea lanțului de carbon al zaharurilor. Procedura este simplă, o sare solubilă a unui acid aldonic este încălzită cu H202 în prezența Fe (Ac) 3 la aproximativ 40 ° C. Utilizarea rășinilor schimbătoare de ioni a îmbunătățit foarte mult acest lucru și face ca metoda să fie exploatată pe scară largă. Există o discrepanță semnificativă în literatura de specialitate cu privire la temperatura și natura formării anhidridului în PAA, acid poli (acrilic) 24-26. J.J. Maurer și colab. 1 în caracterizarea termică a poli (acidului acrilic), evoluția maximă a apei datorită formării anhidridului și a evoluției dioxidului de carbon datorită descompunerii anhidridei a avut loc la 170 și, respectiv, 230 ° C.
Reacția de degradare a PAA cu reactivul Fenton este în acord cu alte mecanisme oxidative observate în procesele de degradare a acizilor carboxilici printr-un mecanism radical cunoscut sub numele de degradare Ruff. Dintre metoda disponibilă sau scurtarea lanțului de carbon al zaharurilor 27, degradarea Ruff este una dintre cele mai fezabile metode 28-29 . A sarea solubilă a unui acid aldonic este tratată cu apă oxigenată în prezența acetatului de fier (III) la aproximativ 40 ° C. D-gluconatul de calciu dă un randament de 25% în D-arabinoză. În absența peroxidului de hidrogen, expunerea la lumina soarelui produce și D-arabinoză 30. Ruff a observat că sarea de fier rămasă după îndepărtarea D-arabinozei avea o putere reducătoare considerabilă atribuită prezenței acizilor hexulosonici 31. Quen 32 a arătat că gazele din sistemele de reactivi-carbohidrați în tone de fen constau aproape în întregime din dioxid de carbon. Experimentele lui Stirling 33 cu reactivul D-glucoză și Fenton susțin ideea interacțiunii lentă a ionului feric-produs, chiar și după pierderea completă a peroxidului original. Gilbert și colab. recenzie 34 fotoreducție a acizilor ß-cetocarboxilici. Ei propun un complex între grupul carboxi-Fe (III). Acest complex este stabilizat cu o decarboxilare acidă pentru a produce Fe (II).
Apoi, într-o primă etapă, ionii Fe +3 vor fi produși prin oxidarea reactivului Fenton în prezența H202 într-un mediu acid, care ar forma un complex intern cu ionii carboxil ai polimerului, așa cum este indicat în Diagrama 1. Acest complex rapid experimentează un proces de reducere a oxidului de ioni Fe +2, producând radicali carboxilici care se stabilizează datorită pierderii de anhidridă carbonică. Noul radical format ar experimenta un nou proces de reducere intramoleculară cu ionii Fe-III vecini, formând o specie care tinde să stabilizeze procesele acid-bazice cu solventul.
Datele DSC indică degradarea polimerului cu scăderea în greutate a produselor volatile ca o consecință a decarboxilării și a formării macroradicale care experimentează reacții de încrucișare, formând o structură a rețelei mai stabilă, care este indicată de procentul mai mic de pierdere în greutate (Figura 4).
Datele DSC pentru PAA și produsele de reacție la 5 și 17 ore sunt prezentate în Figura 4. Apa este eliminată din structura PAA la temperaturi sub 100 ° C cu o Tg de aproximativ 105 ° C. La 246,3 ° C, PAA pur experimentează o reacție endotermică la 5 și 17 ore reacțiile se manifestă la 276,1 ° C și respectiv 275,0 ° C, indicând structuri mai stabile termic.
În același timp, produsele de reacție au experimentat un proces exoterm la 418,2 ° C și respectiv 416,9 ° C, indicând degradarea produselor volatile și se desprind din macrostructură. Acest proces nu este respectat pentru polimerul acrilic pur. Alte date semnificative de stabilitate pentru produsele de reacție au fost observate în procentul de pierdere în greutate, deoarece PAA a prezentat 85% pierdere în greutate peste 500 ° C. În schimb, pierderea în greutate pentru produsele de reacție este sub 75%, indicând o structură termică mai stabilă, probabil datorită generării unei structuri de tip net prin formarea de legături între macroradicale.
CONCLUZII
| ? | S-a constatat că PAA se degradează cu reactivul Fenton în condițiile utilizate pentru altoirea fibrelor de celuloză. |
| ? | Analiza DSC și entalpia de fuziune pentru toate substraturile reactive PAA indică faptul că, cu timpi de reacție lungi, există variații semnificative ale polimerului, indicând schimbări în structura sa. |
| ? | La perioade lungi de reacție a polimerului acid acrilic, s-a constatat că decarboxilizează la pH acid cu reactivul Fenton, rezultând un polimer cu o structură care are o stabilitate termică mai mare. |
MULȚUMIRI
Mulțumim Proyect nr. 020404 3/R, direcția de cercetare, Universitatea din BíoBío, Concepción.
BIBLIOGRAFIE
1. J.J. Maurer, D.J. Eustace, C. T. Ratcliffe, Macromolecule, 20, 196-202, (1987). [Link-uri]
2. Gulten Gürdag, Gamze GüClu, Saadet Ozgumus, J. Appl. Polym Sci, 80, 2267-2272 (2001). [Link-uri]
3. Ramadan C.; mustafa Y., Mehmet S., J. Appl. Polym Sci, 75, 766 (2000). [Link-uri]
4. Lars-Ake Linden și Jan F. Rabek, Journal of Applied Polymer Science, 50, 1331-1341 (1993). [Link-uri]
5. Run Cang, Jeremy Tomkinson, Journal of Wood Science, 48, 222-226 (2002) [Legături]
6. H.J.H. Fenton. J. Chem.Soc., 899 (1894) [Legături]
7. M.L. Kremer., Phys.Chem.Phys., 3595 (1999) [Legături]
8. W.C. Bray, M.H. Gorin., J. Am. Chem. Soc., 2114 (1932) [Legături]
9. P.A.MacFaul, D.D.M. Wayner, K.U. Ingold, Acc. Chem. Rec., 31, 159 [Link-uri]
10. S. Goldstein, D. Meyerstein, Acc. Chem. Rec., 31, 547 (1999) [Legături]
11. ML Kremer J Jnorg.Bioch., 78, 255 (2000) [Legături]
12. Charles R. Yang, Yufeng Xu și Dengjing Wang, Ind. Eng. Chem. Rez., 35, 4037-4042 (1996) [Legături]
13. Arevindakshan, V. G. Kumar, J. Appl. Polym Sci, 84, 528 (2002) [Legături]
14. Jian Dong, Yuxihiro Ozaki și Kenichi Nakashima, Macromolecule, 50, 1117 (1997) [Legături]
15. Umemura, Shuichi, Kawal, Societatea de cercetare a lemnului din Japonia, 48, 25-31 (2002) [Link-uri]
16. Eisenberg T. Yakoyama și Emma Sambalido, J. Appl. Polym Sci, 7, 1717-1728 (1969) [Legături]
17. Paul, P. Taylor, J. Chem Soc, Perkin Trans., 2, 511-518 (1996). [Link-uri]
18. î.Hr. Gilbert, G. R. Hodges, J. R. Linsay S., P. MacFaul, P. Taylor, J. Chem. Soc. Perkin Trans, 2, 519-524 (1996). [Link-uri]
19. N. Tanaka, H. Kitano, N. Ise, J. Phys.Chem., 94, 6290 (1990) [Legături]
20. Nakashima, 1997, Macromolecule, 30, 1111-1117 (1997) [Legături]
21. H.L. Isbell, H.L. Spush., Carbohidrati.Res., 161, 181 (1987) [Legături]
22. Jurisch, J. Jentgen 's Kunstseide u.Zellwolle, 23, 266 (1941) [Link-uri]
23. Stefan J.H.F. Arte. Erwin J.M., Mombarg, Herman van Beckum, Roger A. Sheldon. Sinteză, 597 (1997) [Legături]
24. A. Eisenberg, Yokoyama, E.J. Sambalido, J. Polym. Ști., Chem, A-I, 7, 1717 (1969) [Legături]
25. M. CMcGaugh, S.J. Kottle, J. Polym. Știință., 5, 817 (1967) [Link-uri]
26. H.G. Girard, P., Mongol, Hebd. Seances Acad.Sci. Ser., C279,597 (1974) [Legături]
27. J. Moody, Progrese în carbohidrați chim., 19, 149-179 (1964) [Legături]
28. Rutland E. Fisher. Ber., 33, 2142 (1900) [Legături]
29. O. Ruff Ber., 32, 550 (1899) [Legături]
30. O. Ruff Ber., 31, 1573 (1895) [Legături]
31. O. Ruff Ber., 32, 2270 (1899) [Legături]
32. F.M. Kuen, Biochimie. Z., 215, 12 (1929) [Legături]
33. J.D. Stirling, Biochimie ., 24, 1048 (1834) [Legături]
34. î.Hr. Gilbert, G.R. Hodges, R. Linsay, P. Mac Fault, P. Taylor, J.Chem. Soc. Perkin Trans 2, 519 [1996] [Legături]
Tot conținutul acestei reviste, cu excepția cazurilor în care este identificat, este o licență Creative Commons
- Acid salicilic circulant și profil metabolic după o intervenție nutrițională comportamentală de 1 an
- Acid citric
- Acidul citric se folosește în beneficiul pielii Skinsei
- CLA poate acest acid gras să vă ajute să pierdeți în greutate Experiența vieții
- GC - ANALIZA MS ȘI RATIUNILE ACIDULUI GRAS AL POTIȘILOR ARHEOLOGICI DIN MARE BAZIN DE VEST A