Jessica L. Buescher
1 Departamentul de Pediatrie și
Laura P. Musselman
2 Departamentul de Medicină Internă, Școala de Medicină a Universității Washington, St Louis, MO 63110, SUA
Christina A. Wilson
1 Departamentul de Pediatrie și
Tieming Lang
1 Departamentul de Pediatrie și
Madeline Keleher
1 Departamentul de Pediatrie și
Thomas J. Baranski
2 Departamentul de Medicină Internă, Școala de Medicină a Universității Washington, St Louis, MO 63110, SUA
Jennifer G. Duncan
1 Departamentul de Pediatrie și
REZUMAT
Studiile epidemiologice la nivel mondial au demonstrat în repetate rânduri o asociere între mediul nutrițional prenatal, greutatea la naștere și susceptibilitatea la bolile adulte, inclusiv obezitatea, bolile cardiovasculare și diabetul de tip 2. În ciuda progreselor înregistrate în sistemele de modelare a mamiferelor, mecanismele moleculare care stau la baza acestui fenomen sunt neclare, dar ar putea implica mecanisme de programare precum epigenetica. Aici descriem un nou sistem de evaluare a mecanismelor de programare metabolică folosind un model Drosophila simplu, tractabil genetic. Am examinat efectul excesului caloric matern asupra descendenților și am constatat că o dietă maternă bogată în zahăr modifică compoziția corporală a descendenților larvați timp de cel puțin două generații, mărește un fenotip asemănător cu obezii în condiții de hrănire suboptimală (bogată în calorii) la descendenții adulți, și modifică expresia genelor metabolice. Datele noastre indică faptul că mecanismele de programare nutrițională ar putea fi extrem de conservate și ar sprijini utilizarea Drosophila ca model pentru evaluarea contribuțiilor genetice și epigenetice subiacente la acest fenomen.
INTRODUCERE
Astfel de observații epidemiologice au fost coroborate în modele de mamifere, dar se știe puțin despre mecanismele moleculare care stau la baza acestui fenomen (Mitchell și colab., 2009; Rajia și colab., 2010; Simmons și colab., 2001; Tamashiro și colab., 2009) . Organismele model tractabile genetic, precum Drosophila melanogaster, oferă oportunități unice de a studia impactul nutriției asupra metabolismului. Drosophila posedă sisteme cheie de organe metabolice și împărtășește numeroase funcții metabolice conservate cu vertebratele, inclusiv insulina analogă, factorul de creștere asemănător insulinei și ținta căilor de semnalizare a rapamicinei (TOR) și reglarea zaharurilor circulante, stocarea energiei și mobilizarea energiei (Baker și Thummel, 2007; Schlegel și Stainier, 2007). Progresele recente de la Drosophila au oferit o perspectivă asupra relației complexe dintre mediul nutrițional, expresia genelor și metabolismul (Birse și colab., 2010; Bujold și colab., 2010; Fujikawa și colab., 2009; Horner și colab., 2009; Musselman și colab. al. al., 2011; Ruaud și colab., 2011; Sieber și Thummel, 2009). Cu toate acestea, efectele transgeneraționale ale nutriției nu au fost raportate. Aici, descriem un model transgenerațional nou de Drosophila în care descendenții muștelor materne supuse excesului caloric demonstrează homeostazia metabolică perturbată, care este asociată cu modificări transcripționale ale regulatorilor metabolici.
REZULTATE
O dietă bogată în zahăr induce obezitatea la muștele femele adulte
Pentru a stabili un model de Drosophila pentru examinarea efectelor transgeneraționale ale excesului caloric, am examinat mai întâi efectul unei diete bogate în calorii asupra compoziției corpului la 1118 muște virgine. În termen de 24 de ore de la ecluzie, w 1118 muște femele virgine Drosophila au fost plasate pe alimente semi-definite care au fost completate fie cu 0,15 mol/l zaharoză [control cu zahăr scăzut (LS)], fie cu 1 mol/l zaharoză [zahăr ridicat (HS)] timp de 7 zile și ulterior au fost examinați pentru modificări ale compoziției corpului. Acest mediu alimentar semidefinit a fost descris anterior (Backhaus și colab., 1984) și a fost dezvoltat inițial în scopul evaluării modificărilor nutriționale și metabolice din Drosophila, evitând în același timp variabilitatea frecventă găsită între loturile alimentare de alimente stoc care conțin melasă și făină de porumb. . Astfel, dietele pe care le-am ales să folosim acest aliment semi-definit ca bază cu mai mult de șase ori mai mult zaharoză în dieta HS. S-a demonstrat că o dietă HS provoacă obezitate și rezistență la insulină în larvele Drosophila (Musselman și colab., 2011; Pasco și Léopold, 2012). În plus, muștele adulte cultivate pe hrană HS timp de 3 săptămâni au fost raportate recent că au dezvoltat defecte metabolice și cardiomiopatie (Na și colab., 2013). Cu toate acestea, efectele unei diete HS în mod specific asupra muștelor materne reproductive nu au fost examinate.
IMPACT TRADUCȚIONAL
Problemă clinică
Mai multe studii epidemiologice au legat un mediu nutrițional prenatal suboptim cu susceptibilitatea la boli metabolice și cardiovasculare la vârsta adultă. Acest concept a luat naștere prin lucrarea lui David Barker, care demonstrează impactul malnutriției materne asupra riscului de boală metabolică la descendenți, dar acum este evident că obezitatea maternă și diabetul predispun și la obezitatea infantilă și la dezvoltarea diabetului. Din păcate, obezitatea maternă este acum extraordinar de frecventă, iar ratele de obezitate cresc la rate alarmante la copii. S-a postulat că un mediu prenatal suboptim poate conduce la evenimente de reprogramare metabolică care fac descendenții mai sensibili la obezitate și boli metabolice (de exemplu, diabetul de tip 2). Înțelegerea mecanismelor care stau la baza acestui tip de programare ne va permite să intervenim terapeutic în stadii anterioare pentru a preveni aceste boli grave.
Rezultate
Pentru a înțelege mecanismele de bază care stau la baza programării nutriționale, autorii au stabilit un nou model transgenerațional de Drosophila care facilitează examinarea detaliată a căilor implicate în metabolismul modificat. Folosind acest model, ei arată că o dietă maternă bogată în zahăr are ca rezultat creșterea stocării carbohidraților, precum și scăderea stocării colesterolului în urma descendenților. În mod similar, descendenții adulți au acumulat niveluri crescute de trigliceride atunci când au fost provocați cu o dietă bogată în zahăr. În plus, autorii demonstrează că expresia multor gene implicate în metabolism este modificată la descendenții ale căror mame au fost hrănite cu o dietă bogată în zahăr. În cele din urmă, autorii au observat schimbări similare la descendenții din a doua generație, sugerând că obezitatea poate fi moștenită prin mai multe generații.
Implicații și direcții viitoare
Aceste rezultate susțin cu tărie ideea că dieta maternă afectează metabolismul la descendenți. Descendenții Drosophila care sunt hrăniți cu o dietă bogată în zahăr sunt predispuși la acumularea excesului de grăsimi, indicând că, la fel ca oamenii, sunt predispuși la obezitate. Expresia modificată a genelor metabolice oferă indicii pentru unele dintre căile implicate în medierea acestor schimbări, deschizând astfel calea pentru investigații suplimentare asupra potențialilor candidați care ar putea fi exploatați pentru a dezvolta noi strategii terapeutice. Stabilirea unui model de muște simplu și tractabil experimental va permite elucidarea rapidă a mecanismelor și căilor implicate în programarea metabolică, care ar putea fi apoi traduse cu ușurință în sistemele de mamifere.
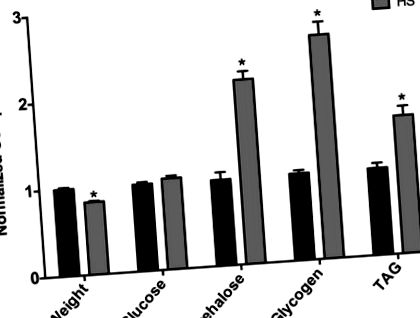
Am constatat că femelele virgine au fost supuse unei diete HS timp de 7 zile în timpul maturității cântărite mai puțin comparativ cu femelele hrănite cu LS (Fig. 1). Această scădere a greutății reflectă probabil schimbările fiziologice care au ca rezultat creșterea morbidității și mortalității asociate cu hrănirea pe termen lung a dietei HS, așa cum a fost observat anterior de laboratoarele Baranski și Cagan (date neprezentate) (Na și colab., 2013). Mai exact, Na și colab. a observat că muștele care s-au hrănit timp de doar 3 săptămâni cu o dietă HS au crescut aritmia cardiacă și că muștele hrănite cu HS au avut în general o durată de viață scăzută (Na și colab., 2013). Astfel, greutatea scăzută la femelele virgine reflectă probabil morbiditatea timpurie asociată dietei. Femelele hrănite cu o dietă HS timp de 7 zile au prezentat trehaloză crescută a întregului corp, în timp ce glucoza a rămas neschimbată și o creștere a glicogenului (Fig. 1). Mai mult, triacilglicerolul (TAG) a fost semnificativ crescut la muștele alimentate cu HS (Fig. 1), reprezentând o creștere semnificativă a procentului de grăsime corporală. Astfel, o dietă HS de 7 zile provoacă un fenotip asemănător cu obezitatea la muștele femele.
Puii masculi wL3 de la muștele materne hrănite cu HS prezintă o expresie genetică modificată. (A, B) Analiza qRT-PCR a ARNm de la descendenții masculini mL3 pentru gene implicate în metabolismul lipidelor (CG17191, Lip3, Fas, dACC, Cpt1, dFOXO) și metabolismul glucidic [CG4797 (transportor de glucoză), PyK, Eno, Pgi, Tps1, Pdk, CG15400 (glucoză-6-fosfatază), DHR38]. Barele reprezintă o expresie relativă ± s.e.m., prezentate ca o modificare a pliurilor în comparație cu valoarea de control (= 1.0) în fiecare caz. Toate datele de expresie au fost normalizate la α-tubulină 84B mARN. n = 8-10 probe combinate; * P Fig. 4B). Expresia unui transportator de zahăr supus, CG4797, a scăzut la descendenți din muștele materne hrănite cu HS. De asemenea, genele glicolitice au prezentat expresie diferențială în comparație cu animalele martor: CG17654 [enolaza (Eno)] a fost reglată în sus, în timp ce CG8251 [fosfoglucoză izomerază (Pgi)] și CG7070 [piruvat kinază (PyK)] au fost reglate în jos. Tps1 [trehaloza-6-fosfat sintaza 1 (CG4104)], care este implicată în conversia glucozei în trehaloză, a fost ușor crescută, dar aceasta nu a fost semnificativă statistic. În cele din urmă, evaluarea expresiei genelor pentru enzimele efectoare ale gluconeogenezei a arătat o tendință spre reglarea în sus a CG15400 (glucoză-6-fosfatază), care catalizează etapa finală în gluconeogeneză și glicogenoliză. Nivelurile de CG10924 [activitate de fosfenolpiruvat carboxicinază (PEPCK) prezisă] și CG5165 [fosfoglucomutază (PGM-1)] nu au fost semnificativ diferite în comparație cu martorii, dar ambele au avut o expresie ușor scăzută. De asemenea, am evaluat alte lipaze (CG5932, brummer), insulina Drosophila ca peptide (dILPs) și genele Niemann-Pick (NPC). Doar NPC1b a evoluat către o scădere a larvelor HS (P = 0,08).
Puii larvați de generația a doua au modificări semnificative în compoziția corpului după o dietă maternă HS. wL3 compoziția corporală totală a descendenților masculi din generația F2 (A - C) [(A) glucoză, (B) trehaloză, (C) TAG] și femele (D - F) [(D) glucoză, (E) trehaloză,) TAG ]. etichetele axei x denotă dieta maternă-dieta larvară F1 și dieta adultă-dieta larvară F2. Barele reprezintă compoziția corporală medie, normalizată la greutate și prezentată în comparație cu martorul (LS-LS-LS = 1,0) ± s.e.m; n = 20-30 de probe combinate; * P Fig. 7). Mai exact, am constatat că descendenții wL3 au prezentat o creștere a întregului corp și a hemolimfei glucozei și trehalozei, precum și reduceri modeste ale glicogenului și colesterolului. Creșterea nivelului de glucoză și trehaloză a întregului corp a persistat în urmașii generației F2. În ciuda absenței defectelor TAG în populația F1 wL3, descendenții F2 wL3 au demonstrat, de asemenea, modificări în compoziția TAG. Mai mult, pe lângă faptul că prezintă stocare crescută de glicogen în condiții de cultură LS, descendenții masculi adulți de la muște materne hrănite cu HS par a fi predispuși la adipozitate atunci când sunt provocați cu o dietă HS. Modificările atât în compoziția descendenților larvați, cât și a celor adulți au fost, de asemenea, însoțite de expresia genică modificată a regulatorilor metabolici. Luată împreună, această lucrare susține utilizarea Drosophila ca model nou pentru examinarea efectelor transgeneraționale ale nutriției și pune bazele pentru investigații viitoare asupra mecanismelor moleculare care stau la baza programării metabolice.
Rezumatul proiectării și rezultatelor experimentale. Muștele femele virgine au fost plasate pe o dietă LS sau HS timp de 7 zile și apoi încrucișate cu muște masculi de tip sălbatic (din hrană stoc). Toți descendenții s-au dezvoltat pe hrana LS. Descendenții F1 au fost examinați atât în stadiul larvar cât și în cel adult și au modificat compoziția corporală și expresia genelor țintă metabolice. Puii de sex feminin de sex feminin F1 au fost colectați și încrucișați cu masculi hrăniți cu hrană. Atât descendenții larvali F2, cât și cei masculi, au avut modificări ale compoziției corpului. FAO, oxidarea acizilor grași.
Există date limitate în alte modele animale referitoare la impactul obezității materne sau al diabetului în stadii incipiente de dezvoltare. Un studiu al aportului matern de fructoză la șobolanii gravide a fost asociat cu niveluri crescute de glucoză și fructoză circulante la descendenții tineri (Vickers și colab., 2011). A existat, de asemenea, o asociere între aportul matern de fructoză și nivelurile modificate de leptină la descendenți, sugerând posibile consecințe neuroendocrine ale unei diete materne bogate în fructoză. Dovezi suplimentare la șoareci indică faptul că expunerea la acizi grași trans în timpul sarcinii și alăptării modifică homeostazia glucozei și semnalizarea insulinei la puii nou-născuți (Kavanagh și colab., 2010). La om, există date abundente că adipozitatea maternă este asociată cu obezitatea descendenților (Boerschmann și colab., 2010; Fraser și colab., 2010; Hochner și colab., 2012), dar modificările timpurii ale dezvoltării sunt neexplorate. Modelul nostru Drosophila permite examinarea schimbărilor metabolice în mai multe puncte în dezvoltare și, în consecință, oferă o oportunitate pentru descoperirea mecanismelor care modifică căile metabolice precoce ale dezvoltării, oferind o bază pentru viitoarele studii axate pe sistemele de mamifere. Studiile viitoare s-ar putea concentra asupra semnalizării insulinei, precum și asupra semnalizării căii TOR, ambele fiind implicate în modelele cu hrană bogată în calorii la muște (Birse și colab., 2010).
Datele noastre susțin utilizarea Drosophila ca model nou pentru examinarea efectelor transgeneraționale ale nutriției și pune bazele pentru investigații viitoare în mecanismele moleculare care stau la baza programării metabolice. Într-adevăr, expresia genică modificată la descendenți de la muștele materne hrănite cu HS, împreună cu compoziția corpului modificată în generația F2 este foarte indicativă a programării metabolice. Utilizând Drosophila tractabilă genetic ca model de programare metabolică, anticipăm că investigația asupra rolului căilor metabolice specifice și a rolului de reglementare a modificărilor epigenetice în generații multiple va duce la elucidarea rapidă a mecanismelor de programare într-un mod care nu este fezabil. în organismele superioare.
MATERIALE ȘI METODE
Stocuri de zbor
w 1118 stocuri de Drosophila au fost obținute de la Bloomington Drosophila Stock Center și menținute la 25 ° C pe hrană cu mușcă pe bază de melasă. Muștele femele virgine au fost colectate din stocuri și plasate în decurs de 24 de ore de la ecluzie pe hrana LS sau HS timp de 7 zile (Fig. 7). Conținutul alimentar al dietelor LS și HS este listat în Tabelul 1. Greutățile și măsurătorile compoziției întregului corp au fost colectate în grupuri de șase larve și grupuri de opt muște.
- Articolul complet Active pentru alimentație Impactul nutrițional al programării bazate pe active în Niger
- Efectele unei mese de seara a fasolei brune asupra markerilor de risc metabolici și a hormonilor de reglare a apetitului la
- Efectul consumului de ceapă aburită (ONIRO) asupra grăsimii corporale și a profilurilor metabolice la supraponderali
- Efectele renunțării la fumat asupra creșterii în greutate, a ratei metabolice, a consumului caloric și a lipidelor din sânge
- Modele dietetice și risc pentru sindromul metabolic la femeile coreene