Termeni asociați:
- Hipermagnezie
- Hipomagneziemie
- Magneziu
- Tensiune arteriala
- Masa osoasa
- Densitatea oaselor
- Nivelul sanguin de magneziu
- Aportul de calciu
Descărcați în format PDF
Despre această pagină
Fiziopatologia absorbției calciului, fosfatului și magneziului
2 MECANISME DE ABSORBȚIE A MAGNEZIULUI
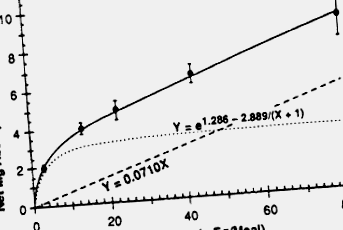
Magneziul alimentar este absorbit de trei mecanisme: absorbție activă, perfuzie pasivă și rezistență la solvent. 357, 358 Absorbția activă este un proces de transport transcelular saturabil și este reglementat de 1,25 (OH) 2D3. Similar fosfatului, absorbția activă devine importantă din punct de vedere fiziologic pentru aportul de magneziu numai atunci când concentrația de magneziu intraluminală este scăzută. Pentru aporturile dietetice standard, cantitatea absolută de magneziu absorbit activ este relativ mică în comparație cu mecanismele pasive. În consecință, rolul vitaminei D în reglarea absorbției magneziului este marginal. Perfuzia pasivă are loc prin difuzie ionică paracelulară și depinde de concentrația luminală de magneziu. Absorbția pasivă reprezintă cea mai mare parte a magneziului absorbit în jejun și ileon. 358 În timp ce absorbția jejunului proximal crește liniar cu concentrația luminală de magneziu, în ileon procesul de absorbție a magneziului este complet saturat la concentrații luminale peste 10 mM 359 (Fig. 6-9). Deoarece mișcarea de magneziu în intestin urmărește fluxul de apă în celulele intestinale, rezistența la 360 de solvenți reprezintă un mecanism suplimentar de absorbție a magneziului.
Figura 6-9. Absorbția netă de magneziu (linia solidă), evaluată prin metoda echilibrului metabolic, în funcție de aportul la persoanele sănătoase. Ecuația pentru absorbția netă, e 1,286-2,889/(X + 1) + 0,0710x, reprezintă combinația unei funcții hiperbolice (linie punctată) plus o funcție liniară (linie punctată).
În general, intestinul întreg poate absorbi magneziul. Prin urmare, aportul net depinde atât de eficiența absorbției, cât și de timpul de tranzit la fiecare segment intestinal unic. În consecință, deși cea mai mare rată de absorbție a magneziului apare în duoden, cea mai mare parte a magneziului alimentar este absorbită în intestinul distal din cauza timpului de tranzit mai lung. 357 Există diferențe de specie în ceea ce privește rolul colonului în această funcție. La păsări și la mamiferele inferioare, colonul este locul principal de absorbție a magneziului, în timp ce la om majoritatea elementului este absorbit înainte de a intra în colon. 357, 358 Cu toate acestea, ar trebui să se ia în considerare faptul că absorbția colonului poate apărea atunci când se administrează clisme care conțin magneziu. 361
Hipertensiune
ALTE MĂSURI
Nu s-a constatat că modificarea aportului de magneziu și calciu are un efect semnificativ asupra TA la populația vârstnică, deși creșterea aportului de vitamina C are un efect hipotensiv ușor și un efect pozitiv asupra profilului lipidic la hipertensivii mai în vârstă. 46 Cofeina poate avea un efect presor acut la persoanele care nu au primit cafeină, dar aportul regulat de cofeină nu are efect presor (deși unele studii au arătat că creșterea consumului este asociată cu un risc crescut de CHD). Exercițiul aerob ușor (mersul pe jos 30 de minute pe zi de trei până la patru ori pe săptămână) are ca rezultat reduceri importante ale TA (aproximativ 20/10 mm Hg) la hipertensivii mai în vârstă. De asemenea, reduce riscul de accident vascular cerebral independent de acțiunea sa hipotensivă și îmbunătățește profilurile de glucoză, reduce greutatea și îmbunătățește bunăstarea generală. 47
Hormoni și tulburări ale metabolismului mineral
Cauzele intestinale ale hipomagneziemiei.
Deficitul selectiv de magneziu din dietă nu apare și este remarcabil de dificil, de fapt, să inducem epuizarea magneziului în mod experimental prin hrănirea dietelor cu deficit de magneziu, probabil pentru că conservarea renală a magneziului este atât de eficientă. Cantități mari de magneziu se pot pierde în stări diareice cronice (acest lichid poate conține mai mult de 10 mEq/L de magneziu) sau prin fistule intestinale sau drenaj gastro-intestinal prelungit. 592 Mai frecvent, magneziul devine prins în săpunurile acizilor grași în tulburările asociate cu malabsorbția cronică. 593 Investigația unei tulburări recesive autosomale rare, hipomagnezmia cu hipocalcemie secundară (HSH) a condus la identificarea proteinei canalului potențial receptor tranzitor TRPM6, sub forma unui hetero-oligomer cu proteina canal strâns legată TRPM7, ca mediator molecular cheie a transportului de magneziu transepitelial intestinal (și tubular renal). 594
Tulburări de potasiu și magneziu
Louis-Philippe Laurin, Martine Leblanc, în Nefrologie de îngrijire critică (ediția a treia), 2019
Tratament
Întreruperea aportului de magneziu (suplimentarea, medicația, nutriția parenterală) este primul pas în gestionarea hipermagnezemiei. La pacienții cu funcție renală normală, întreruperea aportului de magneziu permite hipermagnezemiei să se corecteze; la pacienții cu insuficiență renală sau cu hipermagnezemie simptomatică severă, poate fi necesară o terapie de substituție renală. Hemodializa este preferabilă hemofiltrării, deoarece scăderea concentrației serice de magneziu are loc mai repede cu prima. Când sunt prezente simptome severe, calciul poate fi administrat ca antagonist de magneziu pentru a inversa aritmiile cardiace, hipotensiunea și depresia respiratorie. Doza uzuală este de 50 până la 100 mg de calciu elementar timp de 5 până la 10 minute, dar pot fi necesare cantități mai mari.
Aportul de minerale dietetice (magneziu, calciu și potasiu) și procesele biologice ale îmbătrânirii
Mg, Ca și K dietetice și concentrația lor în organism contribuie la modularea proceselor biologice despre care se știe că sunt implicate în procesul de îmbătrânire.
Creșterea aportului alimentar de Mg și K este asociată cu o sănătate cardiovasculară mai bună, dar dovezile sunt mai puțin clare pentru Ca dietetic.
Suplimentarea cu Ca pare a fi asociată cu un risc cardiovascular modest crescut.
Creșterea aportului alimentar de Mg, Ca și K este asociată cu scăderea tensiunii arteriale
Aportul mai mare de K este asociat cu un risc redus de accident vascular cerebral. Dovezi similare, dar mai slabe, sunt disponibile și pentru Mg și Ca.
Consumul alimentar mai mare de Ca și, într-o măsură mai mică, K și Mg, este asociat cu un risc redus de diabet de tip 2.
În timp ce dovezile care demonstrează un efect protector al aportului alimentar de Mg, Ca și K și sănătatea cardiovasculară, precum și T2D sugerează cu tărie un efect similar asupra îmbătrânirii creierului și a declinului cognitiv, deoarece CVD și T2D sunt factori de risc importanți și cunoscuți pentru creier și cognitiv. sănătate, cercetările în acest domeniu lipsesc.
Relația dintre legume și fructe (vitamine antioxidante, minerale și fibre) Aportul și riscul bolilor cardiovasculare
Magneziu
Homeostazie cu magneziu
Depleția de magneziu și osteoporoza: modele experimentale de animale
Figura 12. După 16 săptămâni de deficit de magneziu la șobolan (bare solide), numărul osteoblastelor a fost semnificativ redus comparativ cu martorii (bare deschise) (Rude și colab., 1999) * p
Figura 13. După 4 și 16 săptămâni de deficit de magneziu la șobolan (bare solide), numărul osteoclastelor a fost crescut semnificativ comparativ cu martorii (bare deschise) (Rude și colab., 1999) * p
Figura 14. Efectul unei diete scăzute de Mg la 10% din necesarul de nutrienți asupra volumului osului trabecular (BV/TB), lățimii trabeculare medii (TTh) și numărului trabecular (TbN) la șobolani hrăniți cu Control (C) sau cu diete cu magneziu scăzut (MgD) ca determinată prin tomografie microcomputată. Valorile sunt medii ± SD, n = 7. Barele fără o literă comună diferă (p Rude și colab., 2004).
Este puțin probabil ca aceste grade severe de deficit de Mg să apară frecvent la populația umană. Recent am raportat grade mai puțin severe de restricție Mg la șobolan (10%, 25% și 50% din necesarul nutrițional recomandat) și am observat, de asemenea, un efect negativ asupra osului (Rude și colab., 2004; Rude și colab., 2005 Rude și colab., 2006) incluzând reducerea osului trabecular, scăderea formării osoase și creșterea resorbției osoase. Efectul unei diete Mg la 10% din necesarul nutrițional recomandat asupra osului trabecular este demonstrat în Fig. 14. Aceste niveluri inadecvate de Mg din dietă sunt prezente în segmente ale populației umane, așa cum sa discutat mai devreme și implică deficiența de Mg ca posibil factor de risc pentru osteoporoză.
Magneziu și relația cu diabetul
Deficiență de 3 mg în populația generală, bolnavi cronici și diabetici
În America de Nord, aporturile de Mg nu respectă recomandările dietetice pentru o mare parte din populație. 2.13 În 2004, mai mult de 34% dintre adulții canadieni cu vârsta peste 19 ani aveau aporturi de Mg din alimente și apă sub cerința medie estimată stabilită de Institutul de Medicină (OIM). 13,14 Modificările tiparelor dietetice și creșterea procesării alimentelor sunt factori contabili cheie pentru deficitul consumului de Mg. Comitetul consultativ pentru liniile dietetice din 2015 a identificat Mg ca un nutrient deficitar. 15
Procentul mare de populații care nu îndeplinesc aporturile recomandate pentru Mg sugerează că poate exista o problemă a deficitului de Mg. Cu toate acestea, în prezent, există o slabă înțelegere a cantităților de Mg necesare pentru o sănătate optimă. Acest lucru este reflectat de diferențele mari în ceea ce privește aporturile recomandate stabilite de organisme științifice autorizate din diferite jurisdicții. 14,16,17 În plus, lipsește un biomarker pentru evaluarea stării fiziologice a Mg care poate fi utilizat pentru screeningul de rutină cu un interval de referință definit pe baza unui rezultat de sănătate. Prin urmare, în prezent este imposibil să se determine cu precizie prevalența deficitului de Mg și a riscului de sănătate aferent în populația generală.
Estimările naționale recente ale concentrațiilor totale de Mg serice din Canada au fost raportate pe baza datelor din ciclul 3 al sondajului canadian de măsuri de sănătate realizat în 2012-2013. 21 Rezultatele acestui studiu sugerează că concentrațiile serice actuale de Mg la canadieni sunt mai mici decât concentrațiile din populația SUA la începutul anilor 1970, sugerând o posibilă scădere a statutului de Mg în populația nord-americană în ultimii 40 de ani. Mai mult de 15% din unele grupe de vârstă sexuală au avut concentrații serice de Mg mai mici de 0,75 mmol/L.
Concentrația scăzută de Mg în ser este frecvent prezentă la pacienții spitalizați. 22 Dintre pacienții cu afecțiuni critice, incidența hipomagneziemiei marcate poate fi de până la 65%. 23 Absorbția intestinală a Mg intestinală și creșterea excreției urinare de Mg de la boli, subnutriție sau utilizarea medicamentelor sunt factori care contribuie.
Magneziu
Absorbția intestinală
Absorbția netă de Mg rezultă din absorbția dietetică de Mg și secreția de Mg în tractul intestinal prin bilă și suc gastric și pancreatic. La adulții sănătoși, 30-50% din Mg din dietă este absorbită. Mg secretat este reabsorbit în mod eficient, iar pierderile fecale endogene sunt de numai 20-50 mg zi -1. Absorbția Mg are loc de-a lungul întregului tract intestinal, dar intestinul subțire distal (jejun și ileon) este locul principal. Este în esență un proces intercelular pasiv prin gradient electrochimic și rezistență la solvenți. Transportul activ are loc doar pentru aportul extrem de scăzut de Mg din dietă și nu se cunoaște reglarea acestuia. Captarea de Mg în marginea pensulei poate fi mediată de un complex Mg/anion, iar efluxul de Mg peste membrana basolaterală poate implica sisteme antiport Na +/Mg 2+. A fost identificată o genă implicată în deficitul de Mg la om. Este exprimat în intestin și rinichi și pare să codifice o proteină care combină proprietățile canalului permeabil la Ca și Mg cu activitatea protein kinazei. Această genă poate fi implicată în absorbția Mg. Datorită importanței procesului pasiv, cantitatea de Mg din tractul digestiv este factorul principal care controlează cantitatea de Mg absorbită.
Tulburări ale metabolismului calciului, fosfatului și magneziului
Manipulare intestinală și renală a magneziului
Absorbția intestinală a magneziului alimentar are loc atât printr-un proces de transport saturabil, cât și printr-un proces pasiv, cea mai mare parte fiind absorbită în intestinul subțire. Pasul de intrare în membrana de margine a periei de enterocite este controlat de canalul de magneziu TRPM6, care a fost clonat recent și a cărui caracterizare funcțională este în curs. Absorbția de 3 Mg 2+ poate varia cu până la 25% până la 60%, cu o absorbție medie de aproximativ 30%. Transportul intestinal nu se modifică ca răspuns la modificările cronice ale magneziului alimentar. Cu toate acestea, TRPM6 este reglat în jos de o creștere a Mg 2 intracelular+ .
Diversi factori modifică absorbția intestinală a Mg 2+. Consumul ridicat de fosfat din dietă este inhibitor, la fel și consumul ridicat de fitați. Efectul calciului alimentar este complex, iar vitamina D are probabil un efect îmbunătățitor. Hormonul de creștere crește ușor absorbția Mg 2+, în timp ce aldosteronul și calcitonina par să o reducă. S-a raportat că vitamina B6 o îmbunătățește.
Mg 2+ este eliminat de rinichi. Pierderile prin secreție intestinală și transpirație sunt neglijabile în condiții normale. Cu o concentrație de magneziu plasmatică ultrafiltrabilă de 0,5 până la 0,7 mmol/l (80% din magneziul plasmatic total), sarcina filtrată de magneziu se ridică la aproximativ 104 mmol (sau 2500 mg) pe zi. Debitul urinar reprezintă aproximativ 5% din sarcina filtrată (4 până la 5 mmol sau 100 mg pe zi). Porțiunea majoră de magneziu filtrat este reabsorbită de tubulii renali (25% în tubul proximal, 65% în bucla groasă ascendentă a lui Henle și 5% în tubul distal contorsionat) (Fig. 10.22).
Transportul Mg 2+ în membrul ascendent gros este în primul rând pasiv pe calea paracelulară. Cu toate acestea, sunt necesare două condiții pentru reabsorbția normală a Mg 2+: mai întâi, generarea unui gradient electric, lumen-pozitiv indus de reabsorbția NaCl care creează forța motrice necesară reabsorbției cationilor divalenți; și în al doilea rând, expresia claudinei 16 în joncțiunea strânsă, care este responsabilă pentru selectivitatea reabsorbției cationilor divalenți. Diferite anomalii asociate cu reabsorbția NaCl sau cu expresia claudinei 16 (denumită anterior paracelină) duc la hipermagnezurie, de exemplu, cazuri atipice ale sindromului Bartter, care este definit de defecte genetice legate de transportul NaCl în membrul ascendent gros (vezi și discuția ulterioară) . 34
În nefronul distal, adică, tubul distorsionat și tubul de legătură, Mg 2+ este reabsorbit prin calea transcelulară împotriva unui gradient electrochimic ascendent. Identitatea moleculară a canalului gatekeeper care controlează intrarea Mg 2+ în epiteliul tubular peste membrana frontieră a periei a fost descoperită recent ca TRPM6. 3 Este identic cu cel al intestinului.
Transportul tubular Mg 2+ este modulat de serul Mg 2+ și Ca 2+ și volumul de lichid extracelular. O creștere a concentrației plasmatice de Mg 2+ sau Ca 2+ are ca rezultat o depresie a transportului de magneziu. Extinderea volumului extracelular produce o scădere a reabsorbției tubulare proximale Mg 2+, în paralel cu cea a Na + și Ca 2+. Restricția fosfatului alimentar are ca rezultat hipercalciurie și hipermagnezurie marcate și poate duce astfel la hipomagneziemie evidentă. PTH, vasopresina, calcitonina și glucagonul cresc reabsorbția tubulară a Mg 2+, în timp ce acetilcolina, bradichinina și peptida natriuretică atrială stimulează excreția urinară de Mg 2+.
În cele din urmă, s-a demonstrat că o serie de medicamente cresc excreția renală de Mg 2+, inclusiv diureticele buclă precum furosemidul și acidul etacrinic, diureticele distale precum tiazidele și diureticele osmotice precum manitol și uree. Diureticele tiazidice măresc livrarea de sodiu în canalul de colectare cortical, disipând gradientul electrochimic favorabil pentru intrarea de magneziu în acest loc. Mai mult, s-au observat sindroame renale de pierdere a magneziului la pacienții tratați cu antibiotice, cum ar fi gentamicina, agenți antineoplazici, cum ar fi cisplatina și inhibitorii calcineurinei, ciclosporina și tacrolimus. Mecanismele precise de acțiune ale acestor agenți nu sunt bine înțelese.
- Hipuricemia - o prezentare generală Subiecte ScienceDirect
- Circulația hiperdinamică - o prezentare generală Subiecte ScienceDirect
- Ciuperci medicinale - o prezentare generală Subiecte ScienceDirect
- Leukoencefalopatia - o privire de ansamblu asupra subiectelor ScienceDirect
- Ileita - o prezentare generală a subiectelor ScienceDirect